多黏類芽孢桿菌NX6對感染炭疽病西瓜幼苗抗氧化酶的影響



摘要:從西瓜炭疽病的生物防治角度出發,在西瓜根際土壤中分離篩選獲得1株對西瓜炭疽病菌(Colletorichum lagenerium)有抑制作用的菌株NX6,研究其生物防治效果及生防機制。結果表明,經菌落形態及16S rDNA 序列分析鑒定該菌為多黏類芽孢桿菌(Paenibacillus polymyxa)。平板對峙試驗結果顯示,菌株NX6平板內抑菌率達81.00%;8 d盆栽研究結果表明,NX6菌株防效達65.44%。NX6菌株可誘導西瓜幼苗胞內TP及GSH含量呈先升高后降低的趨勢,并在4 d后達到峰值后逐漸穩定,顯著高于對照。但NX6菌株對AsA的誘導效果并不顯著。同時,NX6菌株亦可誘導SOD、POD及CAT等抗氧化酶活性顯著上調,其中T1處理的POD及CAT活性上調幅度顯著高于其他組,在6 d后時活性分別達到90.50、25.40 U/mg prot。在活性氧代謝方面,NX6菌株處理西瓜幼苗后,胞內H2O2及MDA含量呈現先升高后下降的趨勢,并于8 d后時降至正常水平。綜上所述,NX6菌株通過誘導西瓜幼苗胞內抗氧化劑含量及抗氧化酶活性上調以緩解炭疽病菌引起的氧化脅迫,提高西瓜幼苗對炭疽病的抗病能力。研究結果為西瓜炭疽病的生物防治提供了理論依據。
關鍵詞:西瓜;炭疽病;生物防治;多黏類芽孢桿菌;抗氧化酶
中圖分類號:S436.5 文獻標志碼:A
文章編號:1002-1302(2024)18-0147-07
收稿日期:2024-01-10
基金項目:濰坊市科技發展計劃(編號:2021GX106);山東省自然基金青年基金(編號:ZR2023QC326);山東省重點研發計劃(編號:2023TZXD028)。
作者簡介:張 燕(1995—),女,山東濰坊人,碩士,講師,研究方向為植物生理學。E-mail:zhangyan951009@163.com。
通信作者:李乃成,博士,副教授,研究方向為植物生理生態學。E-mail:linaicheng23@163.com。
西瓜是我國重要的經濟作物,深受消費者喜愛,是繼蘋果、橙子之后的第三大經濟水果,在我國水果生產中占有舉足輕重的作用[1]。據聯合國糧食及農業組織統計資料顯示,2019年我國西瓜總種植面積達到147萬hm2,總產量超6 000萬t,占全球西瓜產量的60%以上[2]。然而,炭疽病作為習見真菌性病害,嚴重制約了西瓜產業的發展。
作為對西瓜危害僅次于枯萎病的病害,西瓜炭疽病由瓜類炭疽病菌[Colletorichum lagenerium (Pass.) Ell.et Halst]引起。該菌屬半知菌亞門,黑盤孢目,刺盤孢屬真菌[3-4]。西瓜炭疽病在西瓜的整個周期均可發生,發病部分常出現圓形、褐色的斑點,嚴重時導致葉片焦枯、莖蔓枯死及果實腐爛,失去商品價值[5]。由于炭疽病的危害,每年西瓜產量平均降低5%~20%,嚴重年份甚至絕收[1]。此外,即使處于貯存及轉運階段,同樣存在暴發炭疽病的風險,最高發病率達100%[6]。目前,西瓜炭疽病的防控策略仍以化學防治為主,田間管理為輔。但長期的農藥大量使用亦導致部分問題頻發:一是農藥殘留導致環境污染,危害人體健康;二是藥量積累,病原菌株抗藥性增加;三是農藥無差別抑菌,導致有益微生物群落遭到破壞,加劇病害的流行[7]。因此,尋找綠色環保、安全高效的防控策略成為國內外相關領域的研究熱點之一[8]。基于此,生防菌劑的研發與推廣逐漸受到研究者們的關注。
相較于傳統化學防控,生防菌劑具備抑菌效果佳、安全效果強、防控成本低等一系列優勢[9-10]。已有大量研究表明,生防菌如芽孢桿菌、放線菌、木霉等均可高效實現對植物病害的防控,部分菌株對西瓜細菌性果斑病、枯萎病及蔓枯病的防效顯著[11-15]。生防菌作用方式多樣,部分菌株可通過合成、分泌抑菌物質,與病原菌株競爭生態位;部分菌株亦可充分發掘作物潛能,誘導植物產生抗病性[16-17]。然而,目前生防微生物在西瓜炭疽病上的研究及應用較少,鮮見報道。
基于此背景,本研究從西瓜根際土壤中篩選獲得1株對西瓜炭疽病病原菌具備顯著抑制效果的菌株NX6,通過形態特征及16S rDNA基因序列分析進行菌株鑒定,采用平板拮抗及盆栽幼苗評估防效,并著重研究該菌株對西瓜幼苗中抗氧化酶活性的誘導效應,評價菌株的生物防治潛力,以期為西瓜炭疽病生防菌劑的開發及作用機制研究提供理論基礎。
1 材料與方法
1.1 供試材料
西瓜炭疽病菌菌株Colletorichum lagenerium由濰坊理工學院分離并保存。供試西瓜品種為甜王8號,購自山東壽禾種業有限公司(山東濰坊)。拮抗菌株的分離及篩選采用NA培養基(牛肉膏3 g、蛋白胨5 g、瓊脂粉20 g,定容至1 000 mL,pH值為7.0);病原菌的培養及平板拮抗試驗采用PDA培養基(馬鈴薯200 g、葡萄糖20 g、瓊脂粉15 g,定容至1 000 mL,pH值為7.0)。
1.2 生防菌株的分離
取寧夏銀川、山東安丘和青州等西瓜種植區域的根際土壤樣品50余份,采用無菌袋封裝運回實驗室后保存備用。稱取10 g土壤樣品,放入盛有90 mL無菌水的錐形瓶中,其內放置無菌玻璃珠若干,在30 ℃、200 r/min條件下振蕩20 min,保證土壤充分散開并制成10-1土壤懸浮液樣品,而后采用梯度稀釋法以無菌水稀釋至10-3、10-4[18]。取100 μL稀釋土壤懸浮液轉移至NA平板,涂布均勻后靜置1 h,而后于28 ℃條件下倒置培養48 h,每個梯度重復3次。依據菌落形態挑選菌種,經平板劃線純化后保存備用。
1.3 生防菌株的篩選
將活化后的西瓜炭疽病病菌接種于PDA培養基內培養7 d,在菌落邊緣處采用打孔器打6 mm的菌餅備用。生防菌株的篩選采用平板對峙法。將待測拮抗菌株接種于NB培養基,28 ℃、180 r/min培養72 h以上,無菌條件下收集培養液。將6 mm的西瓜炭疽病菌菌餅轉移至PDA平板(D=90 mm)中央,菌絲面與平板接觸,培養24 h后,通過十字交叉法在距離培養基中央25 mm的位置均勻打4個孔,每個孔注入發酵液50 μL,以無菌NB培養基及無菌水為對照處理,每個處理重復3次。接種后置于28 ℃條件下培養,待對照菌落菌絲即將布滿整個平板時,測量各菌落的直徑,通過以下公式計算各菌株的抑制率[17]。
抑制率=(對照菌落直徑―處理菌落直徑)/對照菌落直徑×100%。
1.4 生防菌株NX6的鑒定
活化后的菌株NX6接種于NA平板內,28 ℃培養24 h后觀察菌落顏色及形態,同時挑取適量菌落進行革蘭氏染色。選擇細菌16S rDNA通用引物27F/1 492R,以NX6菌株基因組為模板進行PCR擴增,產物直接進行雙向測序[19]。測序工作由生工生物工程(上海)股份有限公司完成,測序結果通過GenBank數據庫進行Blast同源分析比對[20]。采用MGEA 7.0進行系統發育樹的構建。
1.5 生防菌株NX6的盆栽防控效果
盆栽試驗于2022年5月在濰坊理工學院試驗中心栽培室開展。取露白西瓜種子播種于種植盆內,放入恒溫培養箱內培養。待西瓜長出5張真葉時,處理組1(T1)采用噴霧法接種NX6菌株懸浮液,接種濃度為1×106 CFU/mL,處理組2(T2)及對照組(CK)噴施等量無菌水[3]。待葉片晾干后,處理組1和處理組2采用噴霧法接種西瓜炭疽病病原菌孢子懸浮液,接種濃度為1×106個/mL;對照組接入等量無菌水。每個處理組處理5株,重復3次。接種后的西瓜幼苗置于24~26 ℃、相對濕度(RH)為95%~100%的黑暗條件下保濕2 d后,置于正常生長條件下培養。接種8 d后,觀察感病情況。以病情指數(DI)及防治效果評價菌株NX6的防控效率[21]。病情指數及防治效果計算公式如下:
DI=∑(各級病葉數×各級代表值)最高級代表值×調查總葉數 ×100 ;
防治效果=(對照組病情指數-處理組病情指數)對照組病情指數×100%。
1.6 生防菌株NX6對西瓜幼苗抗氧化系統的影響
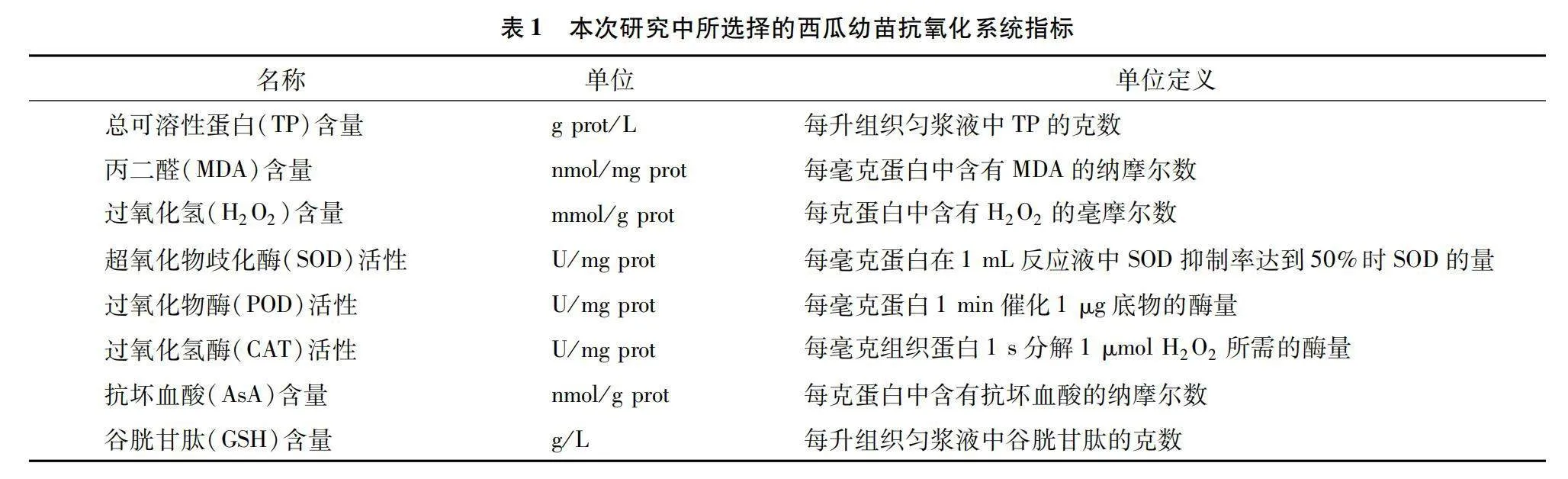
在盆栽試驗過程中,分別于接種當天(接種前)和接種后2、4、6、8 d,隨機選擇5株幼苗的真葉(第2、3張葉)測定抗氧化系統指標。抗氧化系統指標明細見表1。其中,總可溶性蛋白含量采用考馬斯亮藍法測定[22]。丙二醛含量采用王學奎等的方法測定[23]。過氧化氫含量、超氧化物歧化酶活性及過氧化物酶活性測定采用李合生等的方法[24]。抗壞血酸及還原型谷胱甘肽含量采用陳建勛等的方法測定[25]。
1.7 數據處理
生防菌株對西瓜幼苗抗氧化系統的誘導效應使用SPSS 22.0軟件進行單因素方差分析。
2 結果與分析
2.1 拮抗菌株的篩選
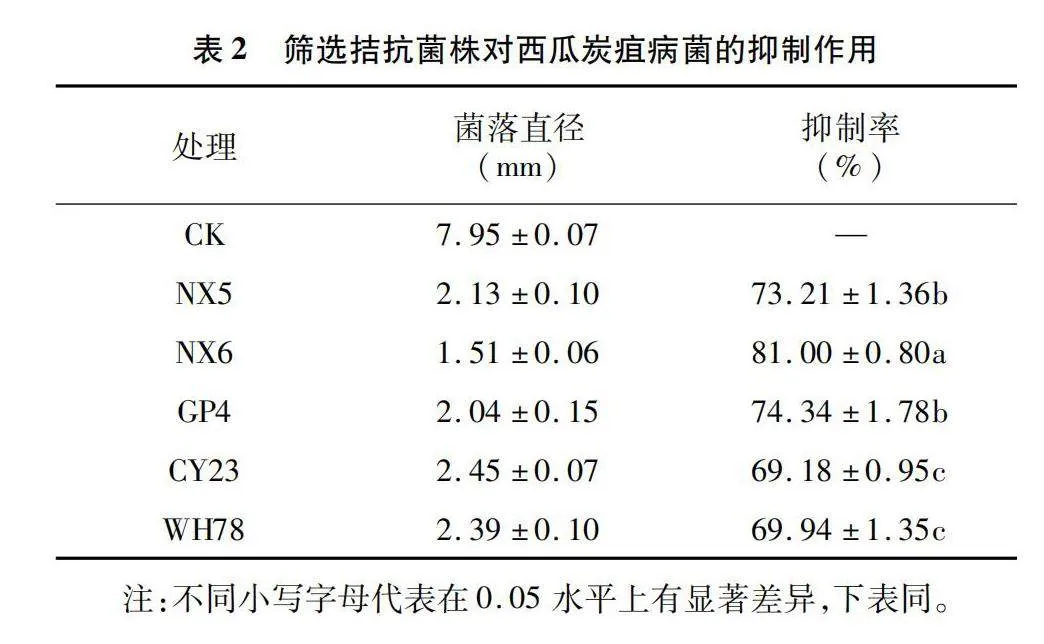
通過對50余份根際土壤樣品進行分離獲得純化菌株236株。通過平板對峙培養篩選獲得抑制率達到60%以上的菌株5株(表2),其中以菌株NX6的抑菌效果最為顯著(圖1),抑制率達到81.00%,顯著高于其他菌株,因此選取菌株NX6做進一步研究。
2.2 西瓜炭疽病菌拮抗菌株NX6的鑒定
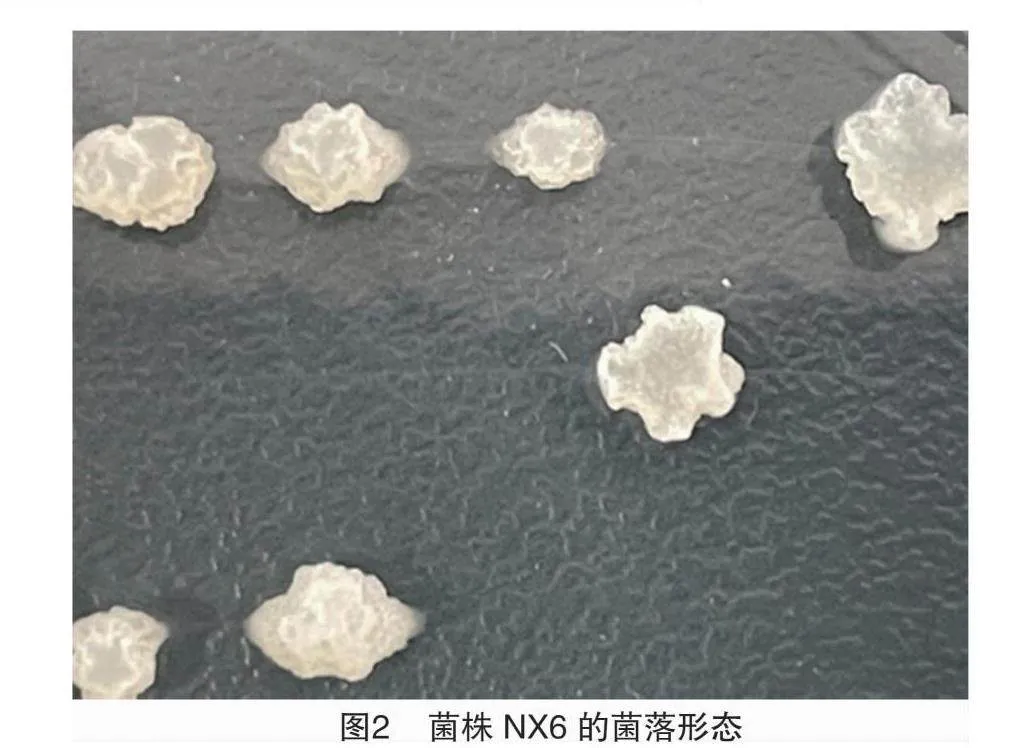
在NA固態培養基上,菌株NX6的菌落呈乳白色,形狀不規則,表面凸起有褶皺,透明狀(圖2)。革蘭氏染色為陽性。將菌株NX6的16S rDNA通過BLAST軟件進行同源序列比對,選取同源性較高的參考菌株16S rDNA序列,以最大似然法構建系統發育樹。菌株NX6歸屬于類芽孢桿菌屬(Paenibacillus sp.),且與多黏類芽孢桿菌(P. polymyxa)親緣關系較近(圖3)。結合菌落特征等因素,菌株NX6被鑒定為多黏類芽孢桿菌。
2.3 菌株NX6的盆栽防效分析
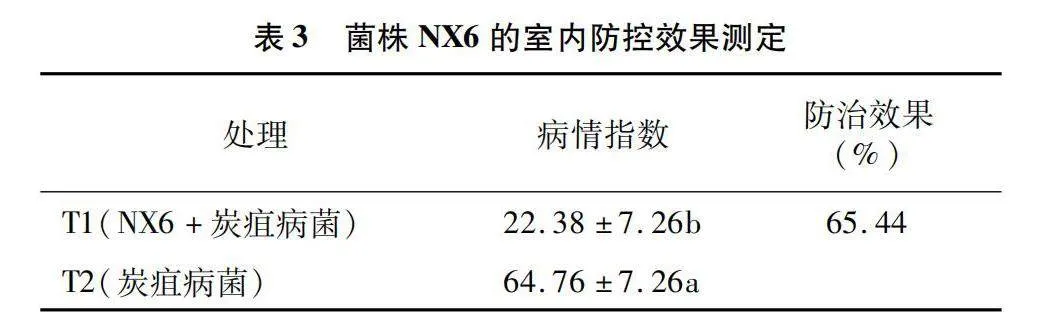
噴霧接種8 d后觀察西瓜幼苗發病情況,結果(表3)表明,只接種西瓜炭疽病菌孢子液的T2處理組發病最為嚴重,病情指數達到64.76。先接種拮抗菌株NX6再接種炭疽病菌的植株發病率較低,病情指數僅為22.38,且與T2處理組差異顯著,防治效果達到65.44%。
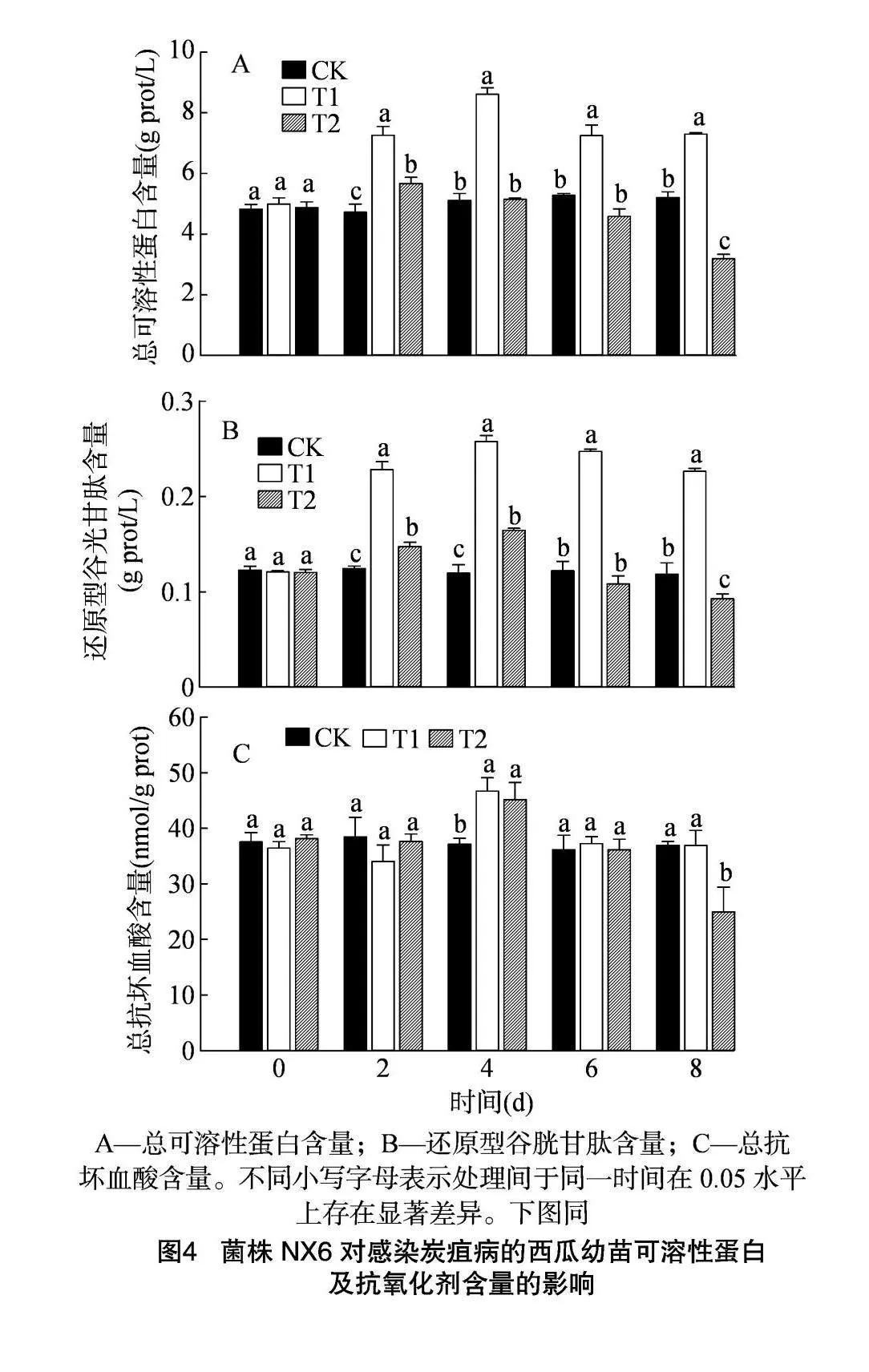
2.4 菌株NX6對西瓜幼苗可溶性蛋白及抗氧化劑含量的影響
接種西瓜炭疽病菌及拮抗菌株NX6后,西瓜可溶性蛋白及抗氧化劑含量均呈現顯著響應,但響應過程存在差異(圖4)。T1處理組的TP含量呈現先升高后下降的趨勢(圖4-A),接種2 d后,總蛋白含量開始上調,并于4 d后達到峰值,為8.61 g prot/L,顯著高于其他組。隨著接種時間的延長,T1處理內TP含量呈下降趨勢,但T1處理組內TP含量仍顯著高于其他組。T2處理組的TP含量于接種后6 d后開始下降,并于接種后8 d后降至3.19 g prot/L,顯著低于對照組,表明細胞內蛋白受到損傷(圖4-A)。
在植株抗氧化劑積累方面,NX6菌株對細胞內GSH積累的影響更為明顯。與TP含量變化趨勢類似,細胞內GSH含量變化呈現先升高后降低的趨勢(圖4-B)。在接種后4 d,T1及T2處理組內的GSH含量較對照組分別升高116.65%、37.74%。在接種6 d后,T1及T2處理組內細胞GSH含量開始下降,其中T2處理組在處理8 d后細胞內GSH含量顯著低于對照組,僅為0.09 g/L。另一方面,菌株NX6對細胞內AsA含量影響并不明顯,在接種4 d后,T1處理組的AsA含量顯著升高。處理8 d后,T2處理組的AsA含量呈現顯著下降趨勢,僅為對照組的67.49%(圖4-C),表明植株內抗氧化劑積累不足,活性氧清除能力下降。
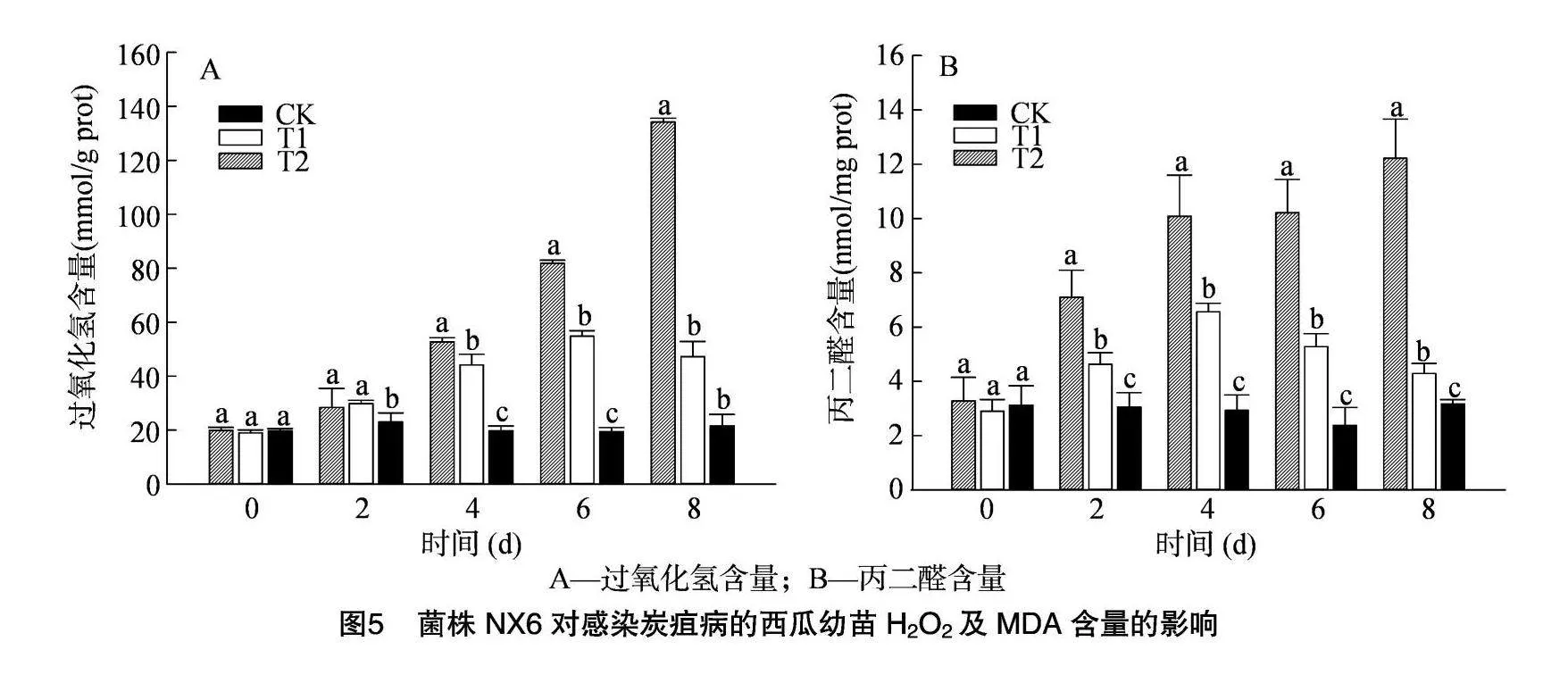
2.5 菌株NX6對西瓜幼苗H2O2及MDA含量的影響
H2O2及MDA是反映植物胞內活性氧積累及膜脂過氧化反應的重要參數。T2處理組西瓜胞內H2O2含量逐漸升高(圖5-A),并于接種8 d后達到132.14 mmol/g prot,為對照組的6.19倍,顯著高于其他處理組。T1處理組的H2O2含量亦呈現升高趨勢,但上升幅度低于T2處理組,在接種8 d后,H2O2含量呈現下降趨勢,與對照組含量無顯著差異,表明菌株NX6可提高西瓜幼苗的活性氧清除能力。
對照培養條件下,細胞內MDA含量未呈現明顯波動,均值為2.93 nmol/mg prot(圖5-B)。在T2處理組內,丙二醛含量呈現升高趨勢,于8 d后升至12.21 nmol/mg prot,顯著高于其他處理組,表明炭疽病菌侵染加劇了細胞膜脂的過氧化反應。在T1處理組內,MDA含量呈現先升高后降低的趨勢。接種4 d后,MDA含量達到6.56nmol/mg prot,約為對照組的2.14倍。隨后胞內MDA含量開始逐漸下降,接種8 d后降至4.29 nmol/mg prot,僅為對照組的1.36倍,表明菌株NX6減緩了膜脂的過氧化反應。
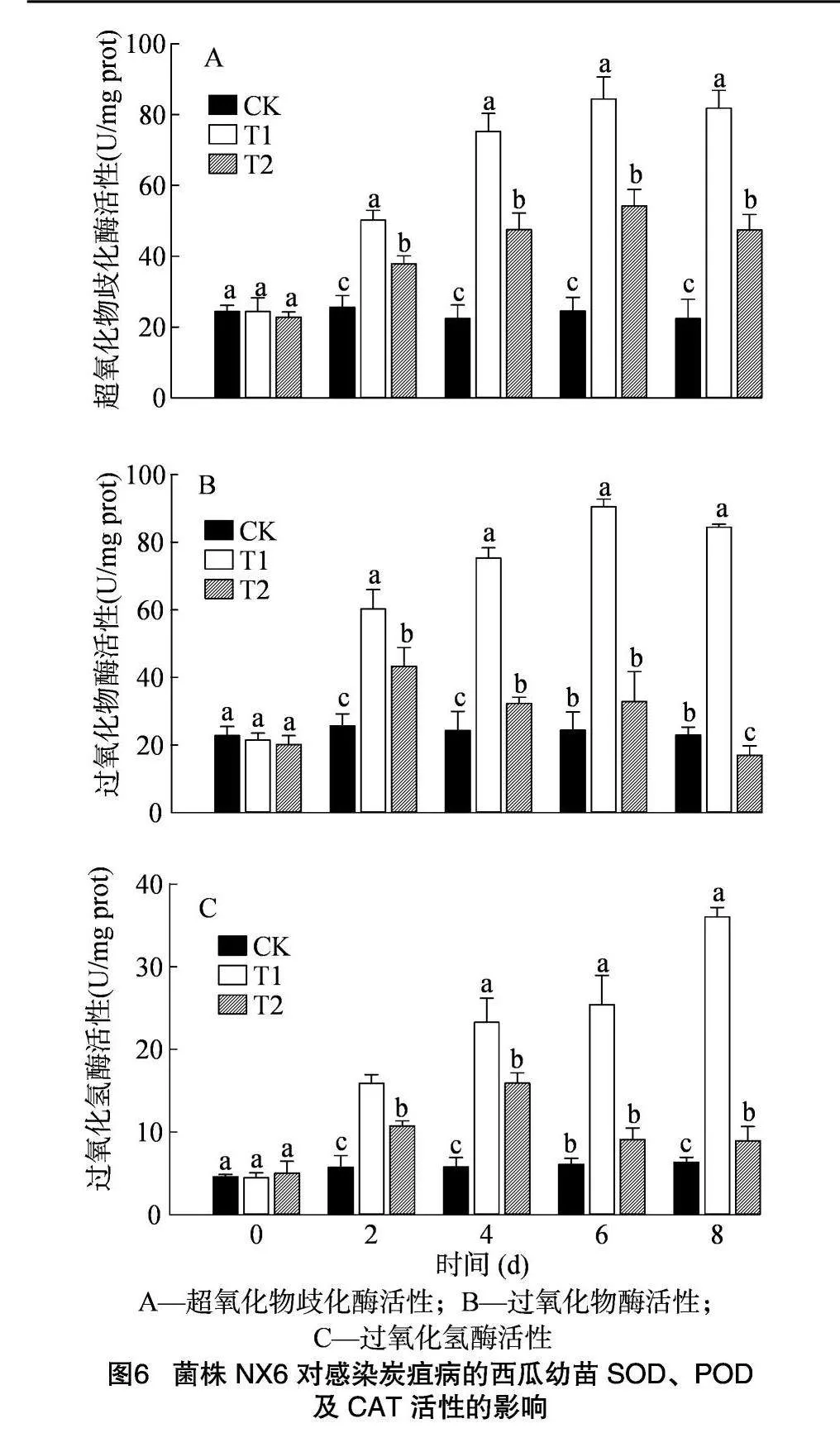
2.6 菌株NX6對西瓜幼苗抗氧化酶活性的影響
SOD、POD、CAT是植物逆境條件下清除活性氧的主要防御性酶。炭疽病菌侵染期間SOD活性響應明顯。病菌侵染2 d后,T1、T2處理組植株胞內SOD活性均顯著升高(圖6-A),6 d后達到峰值,分別為對照組的3.44、2.20倍。但T1處理組的SOD活性上調幅度顯著高于T2處理組,表明菌株NX6可增強西瓜清除活性氧的能力。
病菌脅迫下,T1、T2處理組POD活性變化趨勢存在差異(圖6-B)。在T1處理組,POD活性呈現先升高后降低的趨勢,接種6 d后達到峰值6af1d235c9c54af58f4bd6a5ec92a4dfa57583ef13d569cbd8a58ef256f15c06,為90.50 U/mg prot,顯著高于其他組別。T2處理組POD活性呈現先升高后下降的趨勢,接種2 d后達到峰值,為43.30 U/mg prot;隨后POD活性開始下降,在接種8 d后,T2處理組POD活性僅為16.99 U/mg prot,顯著低于對照組,表明植物細胞可能受到損傷。
由圖6-C可知,T1及T2處理組內CAT活性變化趨勢存在差異。T1處理組的CAT活性逐漸升高,8 d后顯著高于其他組,表明植株上調CAT活性快速進行活性氧清除。在T2處理組內,CAT活性呈現升高后降低趨勢,接種4 d后達到15.93 U/mg prot,為對照組的2.76倍;隨后CAT活性開始下降,至8 d后活性僅為8.93 U/mg prot,僅為對照組的1.41倍,表明炭疽病菌侵染條件下西瓜CAT活性存在下調,活性氧清除能力下降。
3 討論
多黏類芽孢桿菌(Paenibacillus polymyxa)屬革蘭氏陽性菌株,可產芽孢,以前歸屬于芽孢桿菌屬(Bacillus sp.),后由Ash等基于分子生物學研究水平劃分至類芽孢桿菌屬(Paenibacillus sp.),并定為該屬模式菌株[26]。多黏類芽孢桿菌抑菌譜較廣,對多種細菌及真菌性病害如蘋果炭疽病、辣椒疫病、番茄青枯病等都具有很好的防治效果[27-29]。然而,多黏類芽孢桿菌在西瓜炭疽病防治方面的研究卻鮮有報道。本次研究結果顯示,多黏類芽孢桿菌NX6菌株可高效抑制西瓜炭疽病的發生,防效達到65.44%。雖然NX6菌株防治效果低于10%苯醚甲
環唑等化學藥品,但是高于解淀粉芽孢桿菌(B.amyloliquefaciens)對辣椒炭疽病的防治效果,加之類芽孢桿菌具有固氮溶磷、促生抗病等優勢,NX6菌株仍可作為防治西瓜炭疽病的有效拮抗菌,展示出其在西瓜炭疽病防治方面較好的研發及應用前景[30-32]。
在正常條件下,植物的活性氧(ROS)的產生及清除處于動態平衡中,但當植物遭受生物或非生物因素脅迫時,植物體內會積累大量活性氧分子,進而破壞生物膜,引發膜脂過氧化反應[33]。H2O2作為植物清除ROS分子的初級產物,其含量可有效反映植物清除ROS分子的效率[34]。在炭疽病菌脅迫條件下,T2處理組的H2O2及MDA含量均呈現顯著升高的趨勢,表明炭疽病引發西瓜胞內活性氧分子大量積累且破壞了細胞膜結構完整性,質膜透性增加,植物自身不足以抵御炭疽病菌帶來的脅迫壓力,這與西瓜處于低溫、離子脅迫等非生物因素脅迫條件下的響應相吻合[35-36]。但T1處理組的H2O2及MDA含量短暫升高后逐漸下降,表明活性氧分子得到及時清除,NX6菌株有效緩解了炭疽病菌引起的氧化脅迫壓力,保障了膜系統的完整性。
為抵御ROS分子帶來的傷害,植物體內演化形成酶促及非酶促2類ROS分子保護系統。其中SOD、POD及CAT等則被認為是最為重要的抗氧化酶[37]。在胞內ROS含量上調時,SOD通過歧化反應將O-2·催化為H2O2,隨后被POD轉化為水[38]。CAT則與SOD協同作用,清除體內的活性氧自由基[39]。已有研究顯示,西瓜苗期對炭疽病的抗性與POD活性及TP含量顯著相關[40]。在本次研究中,被炭疽病菌侵染后,西瓜幼苗內3種抗氧化酶活性均有顯著升高,表明3種抗氧化酶在抵御炭疽病菌侵染的過程中均存在積極作用。生防菌在防病中提高植物抗氧化酶的活性是植物產生誘導系統抗性或系統獲得性抗性的表現之一[41]。此種現象在西瓜枯萎病、番茄灰霉病及草莓灰霉病等生物防控過程中均有類似報道[17,42-43]。但T2處理組的POD活性在8 d后活性顯著下降,植物活性氧分子清除效率下降,植物自身不足以進行病害防御。然而,在T1處理組內,3種抗氧化酶活性呈現顯著升高的趨勢,且上調幅度高于其余組,表明菌株NX6能夠誘導西瓜幼苗SOD、POD及CAT等抗氧化酶活性升高,維持ROS始終處于較低水平,緩解ROS對葉片膜系統的傷害,提高西瓜幼苗對炭疽病的抗性。
GSH-AsA是循環植物直接清除H2O2的重要催化系統,二者更是細胞內重要的非酶抗氧化劑,其含量直接反映出植物對逆境的抵抗能力[44]。GSH和AsA不僅可以直接參與ROS的清除,亦可以分別作為GPX及APX的酶促底物進行H2O2的解毒[45]。本次研究結果表明,在炭疽病菌侵染過程中,植物體內GSH含量呈現應激性升高,表明西瓜幼苗激活了GSH-AsA循環以有效降解SOD催化產生的H2O2。此種現象與植物遭受鹽、低溫等逆境脅ce28ba7898fca144d5478bb4e255acf7578bd0567e39c221d0d650f3e7bbf00a迫時的反應[45-47]相一致。而AsA含量未呈現明顯波動則可能是其參與自由基清除反應因而處于氧化態,亦可能是炭疽病菌及NX6菌株對AsA誘導合成效應響應不顯著[44]。
4 結論
綜上所述,多黏類芽孢桿菌NX6菌株對西瓜炭疽病存在較好的防控效果,防效達到65.44%。在施用NX6菌懸液后,西瓜幼苗胞內TP含量、GSH含量及3種抗氧化酶活性均有顯著升高,H2O2及MDA含量呈現顯著下降,減小了炭疽病菌侵染期間ROS對西瓜幼苗的氧化脅迫壓力,進而提高了西瓜幼苗面對炭疽病菌脅迫時的自我保護能力。
參考文獻:
[1]Guo Z,Luo C X,Wu H J,et al. Colletotrichum species associated with anthracnose disease of watermelon (Citrullus lanatus) in China[J]. Journal of Fungi,2022,8(8):790.
[2]FAO. Food and Agricultural Organization of the United Nations (FAOSTAT) [DB/OL].[2023-09-02].https://www.fao.org/faostat/zh/#data/QCL.
[3]魏春華,郜 森,甘 露,等. 西瓜炭疽病接種技術規程[J]. 中國瓜菜,2019,32(1):45-47.
[4]郜 森,王恩煜,楊小振,等. 西瓜炭疽病及抗性育種研究進展[J]. 中國瓜菜,2021,34(5):1-7.
[5]張慧青,孫玉燕,范 敏. 西瓜炭疽病研究進展[J]. 浙江農業科學,2020,61(2):292-295.
[6]Dean R,van Kan J A L,Pretorius Z A,et al. The Top 10 fungal pathogens in molecular plant pathology[J]. Molecular Plant Pathology,2012,13(4):414-430.
[7]竺利紅,梁建根,吳吉安,等. 抑霉菌素對西瓜炭疽病菌的抑菌活性及防病效果[J]. 中國生物防治,2009,25(增刊1):84-86.
[8]張曉云,叢 蓉,趙衛松,等. 30億CFU/g芽孢桿菌可濕性粉劑的研制及其對馬鈴薯黃萎病和瘡痂病的防治效果[J]. 農藥學學報,2023,25(1):140-149.
[9]張靜雅,李欣雨,張 成,等. 木薯炭疽病拮抗木霉菌篩選與室內防效研究[J]. 中國生物防治學報,2022,38(1):115-124.
[10]Huang Z Q,Liu B W,Yin Y,et al. Impact of biocontrol microbes on soil microbial diversity in ginger (Zingiber officinale Roscoe)[J]. Pest Management Science,2021,77(12):5537-5546.
[11]劉連金,李正令,李雪理,等. 八角炭疽病生防菌株篩選及發酵條件研究[J]. 植物保護,2022,48(5):204-211.
[12]潘潔明,陳雪玉,貝永建,等. 八角炭疽病拮抗放線菌RX2-2的分離鑒定及其生物活性評價[J]. 微生物學通報,2022,49(3):991-1003.
[13]王雪妍,馬 煥,岳丹丹,等. 一株西瓜細菌性果斑病生防菌的篩選、鑒定及其培養基優化[J]. 中國瓜菜,2022,35(9):9-15.
[14]沈婷婷,張 琇,楊國平,等. 生防菌劑對西瓜根際土壤微生物群落和尖孢鐮刀菌屬的影響[J]. 西北農林科技大學學報(自然科學版),2023,51(7):115-125.
[15]張旭輝,張紅楠,李 勇,等. 抑制西瓜蔓枯病菌的生防真菌篩選、鑒定及發酵條件優化[J]. 中國生物工程雜志,2017,37(5):76-86.
[16]陳梅春,鄧英杰,陳燕萍,等. 芽孢桿菌FJAT-2349脂肽對枇杷采后炭疽病菌抑制作用[J]. 福建農業學報,2021,36(12):1478-1483.
[17]王 靜,寧燕夏,糟雪云,等. 解淀粉芽孢桿菌B6防治西瓜枯萎病及對西瓜幼苗抗氧化酶的誘導作用[J]. 中國植保導刊,2018,38(6):5-10.
[18]謝學文,董瑞利,石延霞,等. 黃瓜炭疽病拮抗細菌的篩選及其抑制效果[J]. 中國生物防治學報,2016,32(2):215-220.
[19]李佳佳,李昭煜,漆永紅,等. 枸杞炭疽病生防菌株篩選、生物功能測定及防治效果[J]. 植物保護學報,2020,47(6):1343-1352.
[20]朱飛舟,陳利玉,陳漢春. 16S rRNA基因序列分析法鑒定病原細菌[J]. 中南大學學報(醫學版),2013,38(10):1035-1041.
[21]沈小英,劉暮蓮,蘇蘭少,等. 32.5%苯醚甲環唑·嘧菌酯懸浮劑防治西瓜炭疽病田間藥效試驗初報[J]. 廣西植保,2019,32(3):16-18.
[22]高俊鳳. 植物生理學實驗技術[M]. 西安:世界圖書出版公司,2000.
[23]王學奎,黃見良. 植物生理生化實驗原理與技術[M]. 3版.北京:高等教育出版社,2015:76-77.
[24]李合生,孫 群,趙世杰,等. 植物生理生化實驗原理和技術[M]. 北京:高等教育出版社,2000:167-169.
[25]陳建勛,王曉峰. 植物生理學實驗指導[M]. 廣州:華南理工大學出版社,2002:69-71.
[26]AshC,Priest F G,Collins M D. Molecular identification of rRNA group 3 bacilli (Ash,Farrow,Wallbanks and Collins) using a PCR probe test.Proposal for the creation of a new genus Paenibacillus[J]. Antonie van Leeuwenhoek,1993,64(3/4):253-260.
[27]Kim Y S,Balaraju K,Jeon Y. Effects of rhizobacteria Paenibacillus polymyxa APEC136 and Bacillus subtilis APEC170 on biocontrol of postharvest pathogens of apple fruits[J]. Journal of Zhejiang University Science B,2016,17(12):931-940.
[28]張JOCeOK1v7clPlNcLKU7Nds/HdWbkbofJdGxyyE3O01Y= 亮,袁 紅,段良霞,等. 多黏類芽孢桿菌LRS-1對辣椒疫霉菌脅迫下根系分泌物的影響[J]. 中國蔬菜,2022(9):80-86.
[29]張 亮,向陳艷,袁 紅,等. 多黏類芽孢桿菌LRS-1對番茄青枯病害根際土壤細菌群落的影響[J]. 湖南農業科學,2021(7):1-6.
[30]何永新. 10%苯醚甲環唑等4種藥劑防治西瓜炭疽病藥效試驗[J]. 南方園藝,2016,27(2):44-45.
[31]朱曉琴,方樹賢,劉冬梅,等. 辣椒炭疽病生防菌株的篩選、鑒定及其抑菌機理[J]. 植物保護學報,2023,50(4):913-922.
[32]KhanZ,Kim S G,Jeon Y H,et al. A plant growth promoting rhizobacterium,Paenibacillus polymyxa strain GBR-1,suppresses root-knot nematode[J]. Bioresource Technology,2008,99(8):3016-3023.
[33]盧 園,李瑞娟,趙 娜,等. 硅對鎘脅迫下玉米生長和抗氧化防御系統的影響[J]. 江蘇農業科學,2023,51(20):77-84.
[34]Li N C,Tong M M,Glibert P M. Effect of allelochemicals on photosynthetic and antioxidant defense system of Ulva prolifera[J]. Aquatic Toxicology,2020,224:105513.
[35]劉曉輝,張 顯,鄭俊鶱,等. 激素預處理對低溫脅迫下西瓜幼苗活性氧含量和抗氧化酶活性的影響[J]. 西北植物學報,2014,34(4):746-752.
[36]張兆輝,汪李平,陳春宏.不同水平Cl-對西瓜幼苗膜脂過氧化及活性氧清除系統的影響[J]. 上海農業學報,2011,27(1):73-76.
[37]AroraA,Sairam R K,Srivastava G C . Oxidative stress and antioxidative system in plants[J]. Current Science,2002,81(10):1227-1239.
[38]Bela K,Riyazuddin R,Csiszár J. Plant glutathione peroxidases:non-heme peroxidases with large functional flexibility as a core component of ROS-processing mechanisms and signalling[J]. Antioxidants,2022,11(8):1624.
[39]MahmoudA,Abdelgawad H,Hamed B A,et al. Differences in cadmium accumulation,detoxification and antioxidant defenses between contrasting maize cultivars implicate a role of superoxide dismutase in Cd tolerance[J]. Antioxidants,2021,10(11):1812.
[40]羅 婷,張 顯,魏永新. 西瓜不同品種苗期人工接種炭疽病菌后的生理生化變化[J]. 西北農林科技大學學報(自然科學版),2009,37(2):130-134.
[41]Tang J,Wang S Q,Hu K D,et al. Antioxidative capacity is highly associated with the storage property of tuberous roots in different sweetpotato cultivars[J]. Scientific Reports,2019,9(1):11141.
[42]李素平,袁 玲,遲少藝,等. 一種自溶性產酶溶桿菌新菌株 LE16 對溫室番茄灰霉病的抑制作用[J]. 微生物學報,2022,62(10):3871-3885.
[43]李德全,錢亞明,周鳴鳴,等. 海洋細菌NH-8防治草莓灰霉病機理及其抗菌物質分析[J]. 植物保護學報,2016,43(2):215-221.
[44]張韞璐,王 琦,王金緣,等. 干旱預處理對鹽脅迫下水稻幼苗抗氧化酶活性及AsA-GSH循環的影響[J]. 江蘇農業科學,2018,46(7):58-60.
[45]趙子媛,佟冠杰,王延松,等. 外源NO對低溫脅迫下仁用杏花器官AsA-GSH 循環的影響[J]. 河北農業大學學報,2023,46(3):19-27.
[46]張愛慧,劉廣勤,朱士農,等. NaCl脅迫對嫁接西瓜抗氧化酶及葉綠素熒光參數的影響[J]. 江蘇農業學報,2010,26(2):377-382.
[47]孫守江,唐藝涵,馬 馼,等. 紫花苜蓿種子吸脹期胚根線粒體AsA-GSH循環對低溫脅迫的響應[J]. 草業學報,2023,32(3):152-162.

