酸湯中產酸酵母的篩選及性能測定

摘 要:產酸酵母作為酸湯發酵過程中的優勢菌株,是影響酸湯產品品質的關鍵因素。本文通過形態學、生理生化和分子生物學,對從酸湯樣品中分離出的產酸菌株進行鑒定,并測定分析其產酸、耐酸和耐膽鹽能力。結果表明,RS-14為盔狀畢赤酵母(Pichia galeiformis),CS-16和CS-19為膜醭畢赤酵母(Pichia membranaefaciens),45、RS-13、RS-15、CS-21和CS-22為滿洲畢赤酵母(Pichia manshurica)。其中,菌株45的產酸能力最強,總酸含量達到41.47 g·L-1,且8株酵母菌均能在pH值為1.5和牛膽鹽濃度為0.70%的條件下生長,具有較高的耐酸性能和耐牛膽鹽性能。本研究通過對酸湯中產酸酵母的篩選及其性能測定,為開發酸湯純種發酵菌株和提升酸湯發酵產品品質提供理論支撐。
關鍵詞:酵母菌;酸湯;有機酸;耐膽鹽
Abstract: Acid-producing yeast, as the dominant strain in the fermentation process of sour soup, is the key factor affecting the quality of sour soup products. In this paper, the acid-producing strains isolated from sour soup samples were identified by morphology, physiology, biochemistry and molecular biology, and their acid production, acid resistance and bile salt resistance were determined and analyzed. The results showed that RS-14 was Pichia galeiformis, CS-16 and CS-19 were Pichia membranacefaciens, and 45、RS-13、RS-15、CS-21 and CS-22 were Pichia manshurica. Among them, strain 45 has the strongest acid production capacity, with a total acid content of 41.47 g·L-1, and all 8 strains of yeast can grow under the conditions of pH 1.5 and bile salt concentration of 0.70%, with high acid and bile salt resistance. In this study, the screening and performance determination of acid-producing yeast in sour soup provided theoretical support for the development of pure fermentation strains of sour soup and the improvement of the quality of sour soup fermentation products.
Keywords: yeast; sour soup; organic acid; bile salt tolerance
酸湯作為貴州省黔東南苗族、侗族的傳統發酵食品,深受當地消費者的喜愛。酸湯有多種類型,主要分為白酸湯和紅酸湯等。傳統的白酸湯主要以米湯(糯米或秈米)為原料,通過自然發酵制作而成[1];紅酸湯主要是由紅辣椒和紅番茄再輔以一定量的調味料分別發酵后再按照一定比例混合發酵制作而成[2]。紅酸湯是一種利用蔬菜自身附著的微生物或添加人工篩選的乳酸菌,在厭氧環境下發酵而成,深受消費者喜愛的特色風味食品。
在紅、白酸湯發酵過程中,因發酵環境和地理環境不同,微生物菌群組成存在差異,但乳酸菌(Lactobacillaceae)和酵母菌(Saccharomycetaceae)作為發酵產品的共性優勢菌,在酸湯發酵中發揮著重要作用[3]。何揚波等[4]探究出納木雷氏乳桿菌(Lactobacillus namurensis)和戊糖乳桿菌(Lactobacillus pentosus)分別為辣椒酸湯和番茄酸湯的優勢乳酸菌,漢遜德巴利酵母(Debaryomyces hansenii)和膜醭畢赤酵母(Pichia membranifaciens)分別為兩種酸湯發酵后期的優勢真菌。張璇[5]發現紅酸湯中的微生物主要為酵母菌、乳酸菌和芽孢桿菌等。王琪琪等[6]研究結果表明,在白酸湯中,屬水平上的乳桿菌屬、畢赤酵母屬和假絲酵母屬等為優勢菌屬;辣椒紅酸湯中酵母屬、雙足囊菌屬和畢赤酵母屬為優勢真菌屬;番茄紅酸湯中哈薩克斯坦酵母屬和畢赤酵母屬為優勢真菌屬。石敏等[7]發現“凱里米酸湯”發酵中的主要菌群有乳桿菌和酵母菌等。綜上,酵母菌在酸湯食品的發酵過程中起著至關重要的作用[8-9]。
貴州省黔東南地區酸湯發酵主要采用農家自釀法,通過自然發酵的方式進行酸湯制作。但這種發酵方式存在酸湯制作周期長、有效成分含量低、易受周圍環境影響等問題,從而導致酸湯產品質量無法得到有效保障。吳茂釗等[10]篩選出副干酪乳酸桿菌G1-3(Lactobacillus paracasei)和印迪卡有孢圓酵母G2-2(Torulaspora indica),由兩株菌復配發酵后制作的秈米白酸湯和糯米白酸湯中的總酸含量相較于自然發酵酸湯分別提高了5倍和18倍,且兩株菌復配發酵后的白酸湯感官品質也優于自然發酵。胡悅等[11]將用乳酸菌發酵4 d的番茄酸湯和辣椒酸湯按1∶1復配后接種于用酵母菌ym1-3發酵4 d的紅酸湯發酵體系中,結果發現,菌株生長情況良好,可應用于紅酸湯強化發酵模式系統研究;肖甜甜等[12]從貴州傳統特色民族食品苗家白酸湯中篩選出優勢微生物乳酸菌和酵母菌,其中釀酒酵母YJ24菌株降糖率達72.84%,馬克斯克魯維酵母YJ1、曼氏畢赤酵母YX5菌株發酵產品感官得分較高。
當前,國內關于貴州黔東南酸湯的探究已涵蓋多個維度,包括乳酸菌的特性探索、代謝產物與風味組分的分析、發酵流程的優化策略、營養價值評估、微生物群落多樣性及其對酸湯質量的效應和對人體健康益處的探討[13-20]。但在酵母菌的篩選、多元菌株共培養技術以及針對酸湯中醋酸菌與產酸酵母的產酸效能及耐酸特性方面的研究較少。本研究從貴州黔東南市面上及自制的酸湯樣品中分離并遴選出產酸活性顯著的菌株,并對產酸酵母的耐受力與產酸性能進行分析,旨在豐富紅、白酸湯發酵工藝的微生物資源庫,搭建酸湯產酸微生物數據庫,以期為食品企業制作高質量酸湯提供科學依據與菌種資源。
1 材料與方法
1.1 材料與試劑
自制白酸湯、苗吳記白酸湯、紅酸湯,貴州苗吳記食品科技有限責任公司;氯化鈉、碳酸鈣和氫氧化鈉,均為分析純,國藥集團化學試劑有限公司;無水葡萄糖,上海麥克林生化科技股份有限公司。
1.2 儀器與設備
全自動微生物生長曲線分析儀RTS-1C,北京立信宏達科技有限責任公司;醫用離心機,湖南平凡科技有限公司;自動菌落計數儀,上海磐麥科技有限公司;pH計,上海儀電科學儀器有限公司;高壓蒸汽滅菌鍋,致微(廈門)儀器有限公司。
1.3 培養基制備
YPD培養基(100 mL):葡萄糖2 g,蛋白胨1 g,酵母浸出粉0.5 g,瓊脂2 g,自然pH值;酵母菌產酸篩選培養基(100 mL):在YPD培養基中添加CaCO3 1 g,瓊脂2 g;碳源同化試驗基礎培養基(100 mL):(NH4)2SO4 0.50 g,KH2PO4 0.10 g,MgSO4 0.05 g,CaCl2 0.01 g,NaCl 0.01 g,酵母膏0.02 g,其他碳源2 g;氮源同化試驗基礎培養基(100 mL):葡萄糖2 g,MgSO4 0.05 g,酵母膏0.02 g,KH2PO4 0.1 g;產類淀粉化合物培養基(100 mL):KH2PO4 0.10 g,(NH4)2SO4 0.50 g,MgSO4 0.05 g,CaCl2 0.01 g,NaCl 0.01 g,酵母膏0.1 g,葡萄糖3 g。
1.4 實驗方法
1.4.1 產酸菌株的篩選
從凱里酸湯樣品中稱取1 mL新鮮樣品加入50 mL滅菌離心管中,加入無菌水9 mL,于30 ℃、180 r·min-1搖床中振蕩30 min,制成懸浮液。取100 μL接種于10 mL的YPD培養基中,于30 ℃、160 r·min-1的搖床中振蕩培養2 d。將培養液稀釋至10-4、10-5、10-6后,取各稀釋度培養液100 μL,涂布于含1%碳酸鈣的YPD培養基上,置于30 ℃恒溫箱中培養72 h,挑選并保存具有不同形態特征的單一菌落菌株。
1.4.2 菌株鑒定和構建系統發育樹
(1)形態學鑒定。將篩選得到的酵母菌株接種至YPD固體培養基上,于30 ℃培養箱培養2 d,觀察并記錄單個菌落形態。用接種環挑取單個菌落,均勻涂布于載玻片上,在光學顯微鏡下進行細胞形態觀察[21]。
(2)生理生化實驗。菌株糖發酵、碳源同化(麥芽糖、葡萄糖、果糖、蔗糖、乳糖、可溶性淀粉和甘露醇)和氮源同化(蛋白胨、酵母膏、尿素、牛肉膏和硫酸銨)實驗等參照《酵母菌的特征與鑒定手冊》,用于檢驗菌株對各種糖發酵、碳源及氮源的利用情況,并記錄結果[22]。
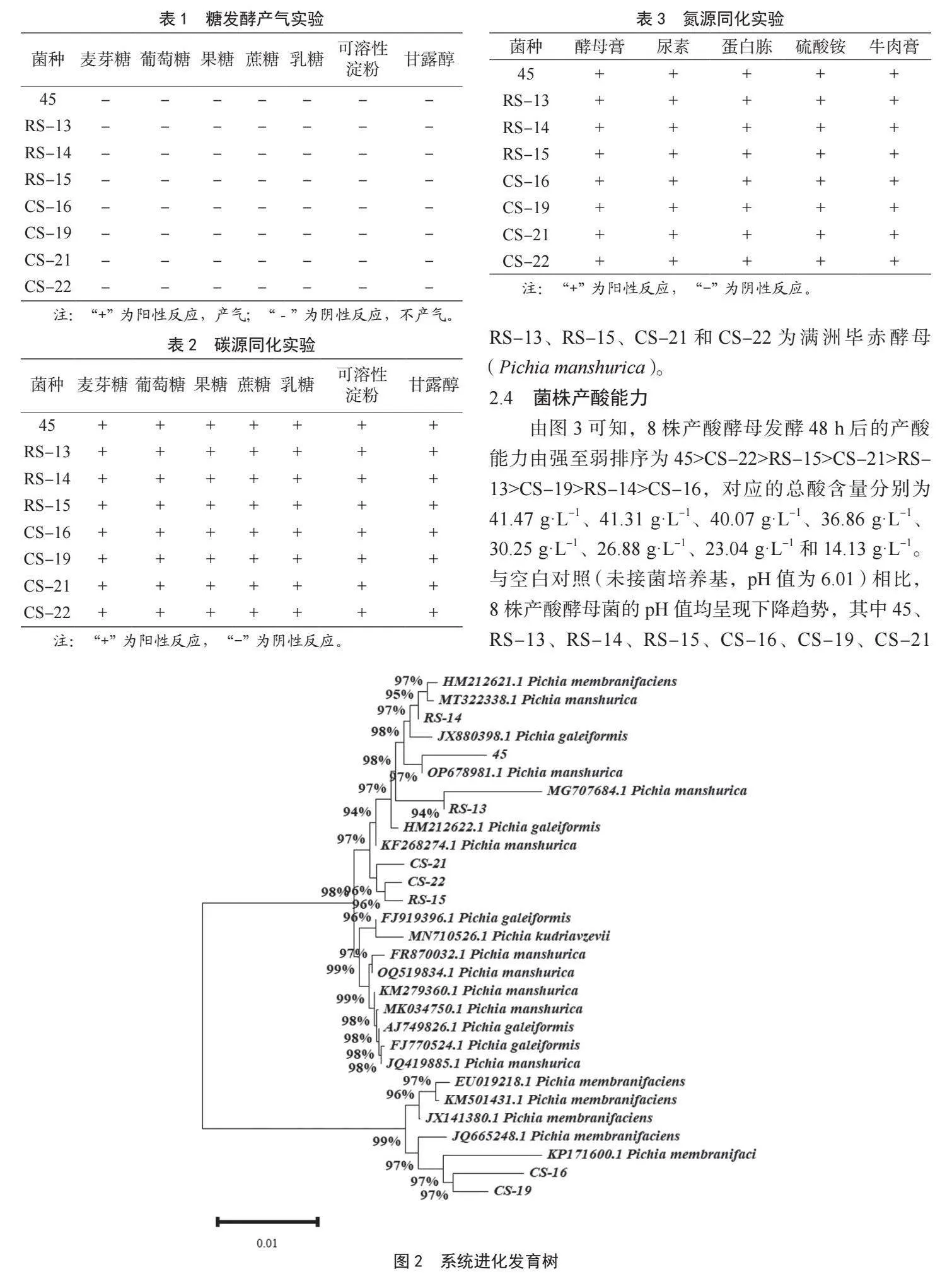
(3)分子生物學鑒定。采用DNA提取試劑盒對酵母DNA進行提取。以提取的酵母DNA為模板,以26S rRNA基因通用引物NL1(5’ -GCATATCAATAAGCGGAAAAG-3’)和NL4(5’ -GGTCCGTGTTTCAAGACGG-3’)為上下游引物,進行26S rDNA片段聚合酶鏈式反應(Po1ymerase Chain Reaction,PCR),而后將PCR擴增產物送至南京擎科生物有限公司測序,所得基因序列提交至NCBI數據庫中進行BLAST同源性對比分析,選取同源性高的序列,用鄰近法構建系統進化發育樹。
1.4.3 菌株的產酸特性
接種1%菌懸液于YPD培養基中,空白組不接菌,然后將兩組平板同時置于30 ℃培養箱中培養48 h,發酵液總酸度根據《食品安全國家標準 食品中總酸的測定》(GB 12456—2021)中的酸堿指示劑滴定法對樣品進行測定,發酵液pH值依據《食品安全國家標準 食品pH值的測定》(GB 5009.237—2016)進行測定,每組重復3次。
1.4.4 耐酸、耐膽鹽性能評價
(1)耐酸性能評價。按照2%接種量將活化的酵母菌種子液分別接種到pH值為1.0、1.5、2.5和3.5的生理鹽水中,于37 ℃培養0 h、3 h后用平板計數法測定活菌數,每組重復3次,以不調節pH值的生理鹽水作為對照。
(2)耐牛膽鹽性能評價。按照2%接種量將活化的酵母菌種子液分別接種至牛膽鹽含量為0%、0.03%、0.10%、0.30%、0.50%和0.70%的生理鹽水中,于37 ℃培養0 h、4 h后用平板計數法測定活菌數,每組重復3次,以未加牛膽鹽的生理鹽水作為對照。酵母菌存活率計算公式為
n=A1/A2×100%(1)
式中:n表示存活率,%;A1表示鹽酸處理3 h或牛膽鹽處理4 h后的最終活菌數,CFU·mL-1;A2表示鹽酸或牛膽鹽處理處理0 h時的活菌數,CFU·mL-1。
2 結果與分析
2.1 產酸酵母菌的分離
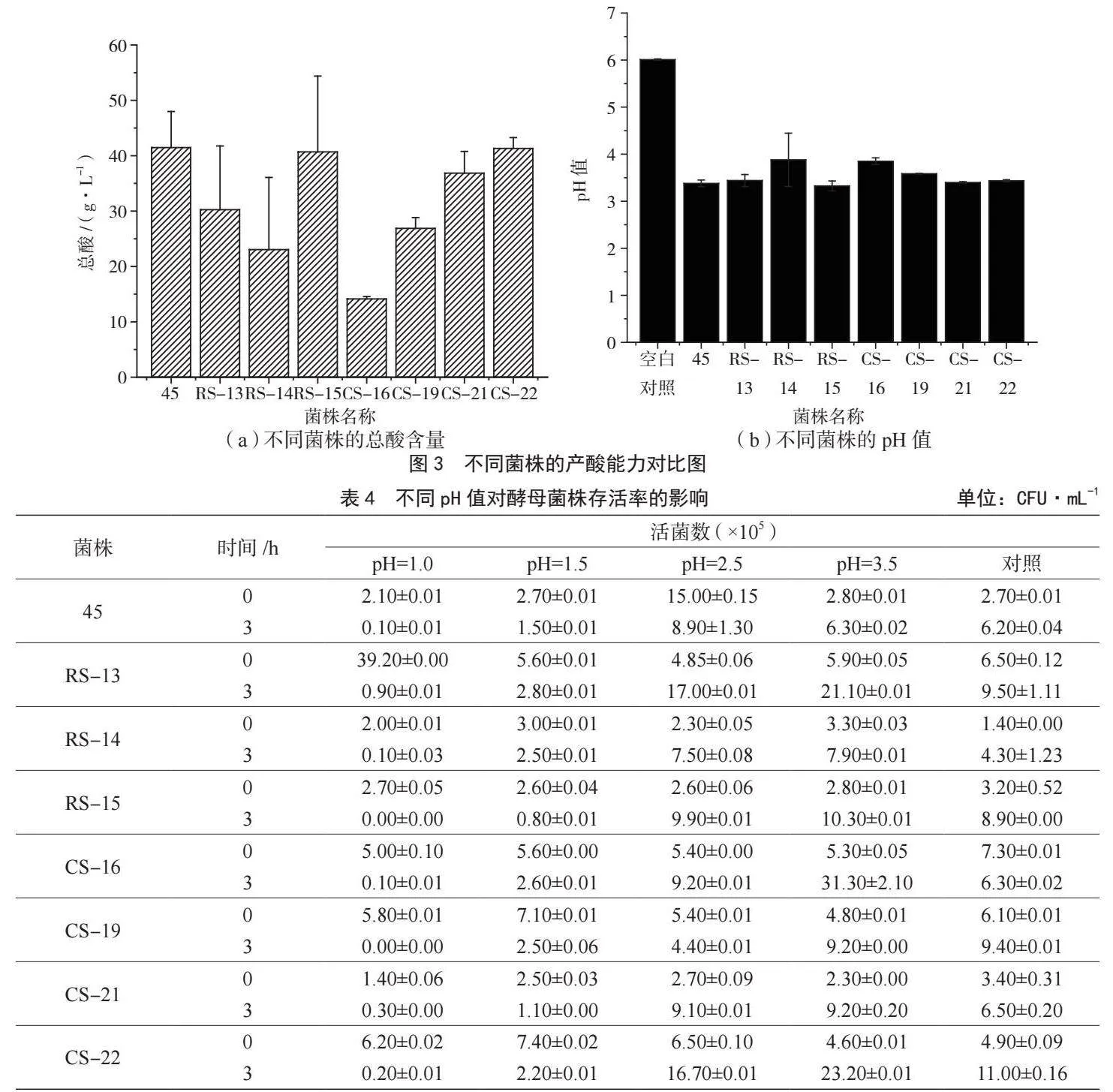
將從YPD篩選培養基中分離純化得到的23株酵母菌進行產酸能力測定。結果表明,有8株酵母菌具有較好的產酸效果,并將其分別命名為45、RS-13、RS-14、RS-15、CS-16、CS-19、CS-21和CS-22。8株酵母菌在YPD固體培養基上生長72 h后,細胞形態和菌落形態見圖1。
2.2 生理生化測定
8株產酸酵母菌的生理生化實驗結果見表1、表2、表3。由表1和表2可知,各菌株可利用7個碳源,包括麥芽糖、葡萄糖、果糖、蔗糖、乳糖、可溶性淀粉和甘露醇,但不產氣。由表3可知,各菌株可利用5個氮源,包括尿素、蛋白胨、酵母膏、牛肉膏和硫酸銨。綜上,表明8株產酸酵母菌對于碳源、氮源具有廣譜性,能夠充分利用營養物質以供自身生長。
2.3 分子生物學鑒定
由圖2可知,將篩選出的8株菌株測序所得26S rRNA序列提交至NCBI數據庫,可判定RS-14為盔狀畢赤酵母(Pichia galeiformis),CS-16和CS-19為膜醭畢赤酵母(Pichia membranaefaciens),45、RS-13、RS-15、CS-21和CS-22為滿洲畢赤酵母(Pichia manshurica)。
2.4 菌株產酸能力
由圖3可知,8株產酸酵母發酵48 h后的產酸能力由強至弱排序為45gt;CS-22gt;RS-15gt;CS-21gt;RS-13gt;CS-19gt;RS-14gt;CS-16,對應的總酸含量分別為41.47 g·L-1、41.31 g·L-1、40.07 g·L-1、36.86 g·L-1、30.25 g·L-1、26.88 g·L-1、23.04 g·L-1和14.13 g·L-1。
與空白對照(未接菌培養基,pH值為6.01)相比,8株產酸酵母菌的pH值均呈現下降趨勢,其中45、RS-13、RS-14、RS-15、CS-16、CS-19、CS-21和CS-22的pH值分別降低了43.76%、42.76%、35.44%、44.59%、35.94%、40.27%、43.43%和42.76%,原因可能是此類菌株能夠借助糖類代謝途徑,生成乳酸、乙酸、酒石酸、蘋果酸和檸檬酸等多種有機酸,導致發酵液中的pH值降低。
2.5 酵母菌耐酸能力分析
由于人胃液中含有大量的胃蛋白酶和鹽酸,標準胃液環境的pH值在2.0~3.5,餐后食物在人體胃液中停留的時間一般低于3 h,且因稀釋作用,pH值會呈現升高趨勢。與細菌和霉菌等產酸菌相比,酵母菌具有更強的酸耐受性[23-24]。而酸湯發酵過程中的pH值通常維持在3.0~4.0,顯示出較弱的酸性條件。因此,若微生物菌株能展現出更強的耐酸特性,則其在胃液環境中存活的可能性也隨之增加。由表4可知,在未調pH值的生理鹽水中培養3 h后,8株酵母菌的活菌數為4.30×105~1.10×106 CFU·mL-1;在pH=3.5的生理鹽水中培養3 h后,8株酵母菌的活菌數為6.30×105~3.13×106 CFU·mL-1,其中CS-16菌株的存活率最高為590.57%。在pH=2.5的生理鹽水中培養3 h后,8株酵母菌的活菌數為4.40×105~1.70×106 CFU·mL-1,其中RS-15菌株的存活率最高為380.77%。在pH=1.5的生理鹽水中培養3 h后,8株酵母菌的活菌數為0.80×105~2.80×105 CFU·mL-1,其中RS-14菌株的存活率最高,為83.33%。在pH=1.0的生理鹽水中培養3 h后,8株酵母菌的活菌數為0~9.00×104 CFU·mL-1,其中CS-21菌株的存活率最高為,21.43%。綜上,在pH值為1.5~3.5時,菌株的存活率隨初始pH值的降低呈下降趨勢,但各菌株均有存活,說明各菌株有一定的酸耐受能力。
2.6 酵母菌耐膽鹽能力分析
人體內膽汁的生理濃度為0.3%~0.5%,食物通過小腸的時間約為4 h,膽汁的平均濃度為0.3%。因此,本實驗通過模擬胃腸道環境,比較牛膽鹽濃度對酵母菌存活率的影響,評價實驗菌株作為益生菌的可行性。由表5可知,在0.30%牛膽鹽濃度下作用4 h后,8株酵母菌的活菌數為1.86×105~3.45×105 CFU·mL-1,其中45的存活率最高為581.25%;在0.50%牛膽鹽濃度下作用4 h后,8株酵母菌的活菌數為1.83×105~4.05×105 CFU·mL-1,其中RS-15的存活率最高,為1 394.74%;在0.70%牛膽鹽濃度下作用4 h后,8株酵母菌的活菌數為1.21×105~4.01×105 CFU·mL-1,其中RS-14的存活率最高,為1 321.05%;而在未添加牛膽鹽作用4 h后,8株酵母菌的活菌數為2.16×105~6.25×105 CFU·mL-1,其中RS-14的存活率最高,為1 904.35%。綜上,各菌株對牛膽鹽的耐受程度較高。
3 結論與討論
貴州凱里酸湯大多采用農家自然發酵,通過微生物間的相互作用對原料中的營養成分進行分解,形成不同的物質如有機酸、氨基酸等。湯慶莉等[25]的研究表明苗族酸湯中的有機酸主要是乳酸、乙酸、酒石酸、檸檬酸和蘋果酸等,其中以乳酸含量最高;萬寧威等[26]的研究表明在白酸湯發酵過程中有機酸含量呈現先上升后平穩的趨勢,以乳酸和乙酸為主。而有機酸具有緩解腸道消化壓力、抑制致病菌的生長以及調控胃腸道菌群等功能[27-28]。此外,有機酸的含量和種類也會影響酸湯的品質。綜上,本研究從酸湯樣品中篩選出的8株優勢產酸酵母,均具有較高的產酸能力和良好的耐牛膽鹽和耐酸特性,有助于酸湯的穩定制備以及產品品質的有效提升。
參考文獻
[1]吳文燕,胡萍,李娟,等.苗族酸湯的研究進展[J].食品與發酵科技,2021,57(6):83-88.
[2]林平,何楊波,李群,等.貴州省紅酸湯產業現狀及發展對策[J].南方農業,2023,17(14):178-180.
[3]Li J,Wang X,Wu W,et al.Comparison of fermentation behaviors and characteristics of tomato sour soup between natural fermentation and dominant bacteria-enhanced fermentation[J].Microorganisms,2022,10(3):640.
[4]何揚波,李國林,李詠富,等.紅酸湯發酵過程中微生物區系及揮發性物質組成變化分析[J].食品工業科技,2022,43(19):177-190.
[5]張璇.貴州“紅酸湯”半成品中微生物區系的研究[D].重慶:西南大學,2011.
[6]王琪琪,田界先,潘宗東,等.基于Illumina MiSeq分析貴州凱里酸湯獨特風味的優勢菌群[J].食品與發酵工業,2020,46(14):40-47.
[7]石敏,張文學,袁瑋,等.“凱里米酸湯”發酵過程中主要微生物及營養成分研究[J].中國調味品,2014,39(9):16-19.
[8]李潔,崔霖蕓,陳芳勇,等.凱里地區辣椒酸細菌群落多樣性及其乳酸菌分離鑒定[J].中國釀造,2021,40(11):98-103.
[9]全昌彬,姚玉仙.貴州黔南地區泡制酸菜中酵母菌的分離與鑒定[J].食品安全質量檢測學報,2022,13(13):4273-4281.
[10]吳茂釗,王斌,杜江,等.苗族白酸湯中優勢乳酸菌及酵母菌的篩選與應用[J].食品工業科技,2023,44(3):163-171.
[11]胡悅,劉娜,秦禮康,等.分料發酵紅酸湯乳酸菌和酵母菌的分離鑒定及應用[J].食品與發酵工業,2024,50(5):116-123.
[12]肖甜甜,馮子娟,邱樹毅,等.苗家白酸湯中微生物群落多樣性研究及其優勢微生物的篩選[J].食品與發酵科技,2021,57(1):1-11.
[13]宮路路,李曉然,陳芳勇,等.凱里紅酸湯細菌群落多樣性分析及其優勢乳酸菌篩選[J].中國調味品,2022,47(10):67-72.
[14]Lin L J,Zeng J,Tian Q M,et al.Effect of the bacterial community on the volatile flavour profile of a Chinese fermented condiment–Red sour soup–During fermentation[J].Food Research International,2022,155:111059.
[15]李娟,田亞,王曉宇,等.基于GC-IMS技術對多菌系復合發酵特色米酸湯的風味特征研究[J].食品與發酵科技,2022,58(1):72-79.
[16]楊裕民,王雪酈,徐智虎,等.凱里紅酸湯微膠囊制備及其工藝優化[J].中國釀造,2022,41(2):149-155.
[17]劉國華,謝小林,李永霞,等.電感耦合等離子體發射光譜(ICP-OES)法測定傳統發酵白酸湯中礦物質元素及主要營養成分分析[J].中國無機分析化學,2023,13(11):1248-1254.
[18]Liu N,Li X,Hu Y,et al.Effects of Lentilactobacillus buchneri and Kazachstania bulderi on the quality and flavor of Guizhou fermented red sour soup[J].Foods,2023,12(20):3753.
[19]陸敏,王雪雅,孫小靜,等.貴州南部紅酸湯理化指標與菌群結構的相關性分析[J].中國釀造,2023,42(9):109-114.
[20]Zhou Q, Qu Z, Wang N,et al.Miao sour soup influences serum lipid via regulation of high-fat diet-induced intestinal flora in obese rats.[J].Food Science amp; Nutrition,2023,11(5):2232-2242.
[21]Hu G,Jiang H,Zong Y,et al.Characterization of lactic acid-producing bacteria isolated from rumen: growth, acid and bile salt tolerance, and antimicrobial function[J].Fermentation,2022,8(8):385.
[22]巴尼特,佩恩,亞羅,等.酵母菌的特征與鑒定手冊[M].胡瑞卿,譯.青島:青島海洋大學出版社,1991.
[23]劉飛,姜蕾,丁真真,等.發酵驢乳中酵母菌的分離鑒定及發酵特性研究[J].中國調味品,2023,48(12):75-78.
[24]熊瑛,尋思穎,孫棣,等.高效液相色譜法測定酸湯中的有機酸[J].中國調味品,2012,37(7):71-73.
[25]湯慶莉,楊占南,吳天祥.貴州省苗族發酵型酸湯中特征性成分的初步研究[J].食品工業科技,2005(9):165-166.
[26]萬寧威,雷幫星,李彪,等.白酸湯發酵過程中微生物多樣性及有機酸動態變化研究[J].食品與發酵工業,2022,48(9):65-70.
[27]ZHOU X,LIU Z,XIE L,et al.The Correlation mechanism between dominant bacteria and primary metabolites during fermentation of red sour soup[J].Foods,2022,11(3):341.
[28]Li D ,Duan F x,Tian Q,et al.Physiochemical, microbiological and flavor characteristics of traditional Chinese fermented food Kaili Red Sour Soup[J].LWT,2021,142:110933.
基金項目:黔科合成果[2022]重點002號;黔科中引地[2022]4020;黔科合服企[2023]012。
作者簡介:潘宇(1997—),男,土家族,貴州沿河人,碩士,研究實習員。研究方向:食品微生物、發酵工程。
通信作者:楊熟英(1988—),女,苗族,貴州黃平人,碩士,高級工程師。研究方向:藥學及食品科學。E-mail: alei8879@163.com。

