基于單細胞測序數據的拉克羅斯病毒感染神經系統細胞基因表達差異分析

摘要:目的" 分析受拉克羅斯病毒(LACV)感染的人腦類器官細胞不同亞群相關基因表達差異,揭示不同亞群之間的轉錄組特性。方法" 選擇GEO數據庫中編號為GSE131434的單細胞轉錄組數據,包含2個樣本,1個為模擬感染COs的作為陰性對照組,1個為受LACV感染的COs。采用R語言“seurat”包對數據進行過濾、歸一化、主成分分析、UMAP聚類分析,尋找COs亞群。通過“SingleR”包進行基因注釋,“iTALK”包分析細胞通訊。通過“clusterProfile”包對差異基因進行富集分析,后構建PPI網絡篩選關鍵基因。結果" 單細胞測序數據分析表明,受感染的COs能夠分成7個細胞亞群,3種細胞類型,分別為漿細胞樣樹突狀細胞、祖細胞、髓樣樹突狀細胞,其中細胞通訊主要發生在祖細胞和漿細胞樣樹突狀細胞之間,尤其是APOE-LDLR這對配體和受體中。樣本的差異基因主要富集于翻譯起始、mRNA和RNA分解過程、核糖體等過程中,與冠狀病毒感染、帕金森等疾病的信號通路相關。進一步獲得的4個關鍵基因為RPS27A、UBA52、RPLP0、RPL13A。結論" 拉克羅斯病毒感染對人腦類器官細胞的關鍵基因表達差異以及涉及APOE-LDLR的細胞通訊可能在感染過程中發揮關鍵作用,為未來的研究提供了重要線索。
關鍵詞:克羅斯病毒;單細胞測序;人腦類器官
中圖分類號:R741" " " " " " " " " " " " " " " " " " 文獻標識碼:A" " " " " " nbsp; " " " " " " " " "DOI:10.3969/j.issn.1006-1959.2024.17.006
文章編號:1006-1959(2024)17-0011-06
Differential Analysis of Gene Expression in Nervous System Cells Infected with La Cross Virus
Based on Single Cell Sequencing Data
PEI Xiao-xian,WU Ya-juan
(Department of Psychiatry,the Fourth People’s Hospital of Zhangjiagang,Zhangjiagang 215600,Jiangsu,China)
Abstract:Objective" To analyze the expression differences of related genes in different subsets of human brain organoid cells infected by La Cross virus (LACV), and to reveal the transcriptome characteristics between different subsets.Methods" The single-cell transcriptome data numbered GSE131434 in the GEO database was selected, including two samples, one for simulated COs infection as a negative control group, and one for COs infected by LACV. The R language \"seurat\" package was used to filter, normalize, principal component analysis, and UMAP cluster analysis of the data to find COs subsets. Gene annotation was performed by the \"SingleR\" package, and cell communication was analyzed by the \"iTALK\" package. Enrichment analysis of differential genes was performed by \"clusterProfile\" package, and then PPI network was constructed to screen key genes.Results" Single-cell sequencing data analysis showed that infected COs could be divided into 7 cell subsets and 3 cell types, including plasmacytoid dendritic cells, progenitor cells, and myeloid dendritic cells. Cell communication mainly occurs between progenitor cells and plasmacytoid dendritic cells, especially in APOE-LDLR ligands and receptors. The differential genes of the samples were mainly enriched in the processes of translation initiation, mRNA and RNA decomposition, ribosome, etc., which were related to the signaling pathways of coronavirus infection, Parkinson's disease and other diseases. The four key genes were RPS27A, UBA52, RPLP0 and RPL13A.Conclusion" The differential expression of key genes in human brain organoid cells infected with La Cross virus and the cell communication involving APOE-LDLR may play a key role in the infection process, which provides important clues for future research.
Key words:La Crosse virus;Single cell sequencing;Human cerebral organoids
拉克羅斯病毒(La Crosse virus, LACV)是兒童病毒性腦炎的病因之一。腦炎可導致患者學習和記憶障礙。這可能是由于細胞受到感染發生凋亡所致,但目前對LACV感染大腦的原發細胞如何應對感染的反應卻知之甚少[1]。目前,常規的測序方法獲得的只是無數細胞混合的DNA樣本,而其中每個細胞的獨有特性往往被忽視。單細胞轉錄組測序技術對組織中每個細胞的轉錄組進行測序,能夠更好的了解樣本間和樣本中細胞的異質性[2]。人類多能干細胞衍生的類器官可以模擬人類流行病原體引起的疾病,如寨卡病毒,流腦病毒等[3,4]。通過模擬病毒對大腦類器官(human cerebral organoids, COs)的影響,結合單細胞測序技術,可進一步探索機體應對感染的機制。本研究對人腦類器官組織中2個樣本(模擬感染和LACV感染)表達數據進行單細胞分析,將不同的細胞聚類為不同的亞組,并對其進行注釋,得到不同種類的亞群細胞的標記基因,并對細胞與細胞之間的由配體與受體的表達作用構建的通訊進行分析。比較兩個樣本間差異基因,進行基因本體論(gene ontology,GO)和京都基因與基因組百科全書(kyoto encyclopedia of genes and genomes, KEGG)富集分析,以及構建蛋白-蛋白互作(protein-protein interaction, PPI)網絡尋找關鍵基因。通過模擬病毒感染,結合單細胞測序技術,旨在更深入地理解LACV感染對大腦功能的潛在影響,為改進兒童病毒性腦炎的預防和治療策略提供科學依據。
1資料與方法
1.1數據來源和質控" 登錄GEO數據庫(https://www.ncbi.nlm.nih.gov/geo/),下載GSE131434數據集中的數據[5]。使用R語言、Rstudio軟件及相關R包進行分析。從2個樣本組織中提取了1566個獨立細胞(模擬感染的人腦類器官中有1042個細胞,LACV感染的有524個細胞),包含33 694個基因。質控標準:測定基因數目為最小為300,最大為4000,線粒體基因百分率小于10%的細胞。紅細胞比率不做設置。過濾以后剩余1395個細胞。隨后,對數據進行去中心化,并將不同細胞之間2000個高變基因挑選出進行后續分析。
1.2降維聚類分析" 采用主成分分析(principal component analysis, PCA)挑選維度,選取15個主成分進行統一流形逼近與投影(uniform manifold approximation and projection, UMAP)聚類展示。此分析過程均是在R語言中使用Seurat[6]分析包獲得。
1.3不同亞群細胞的注釋" 對于以上分析獲得7個亞群細胞,在R語言中,通過“SingleR”[7]包,使用Monaco免疫參考數據庫鑒定注釋各亞群細胞所對應的細胞類型,并計算各亞群在不同樣本間的比率。
1.4細胞通訊分析" 在R語言中,利用“iTALK”[8]R包比較不同樣品組的細胞在各細胞類型之間的配體與受體基因表達差異。
1.5 GO功能富集分析和 KEGG 信號通路富集分析" 比較不同樣本之間的差異基因表達,采用R包“cluster Profiler”[9]對這些差異基因進行GO功能富集和KEGG信號通路富集分析,了解這些差異基因可能參與的生物學過程、分子功能、細胞定位及信號通路等。
1.6篩選PPI網絡中的關鍵基因" 利用STRING數據庫(http: //string-db.org)構建蛋白互作網絡,導出結果數據至CytoScape軟件,后利用Cytohubba插件依據連接度篩選出排名前4關鍵基因,并繪制關鍵基因在不同樣本間的表達圖。
2結果
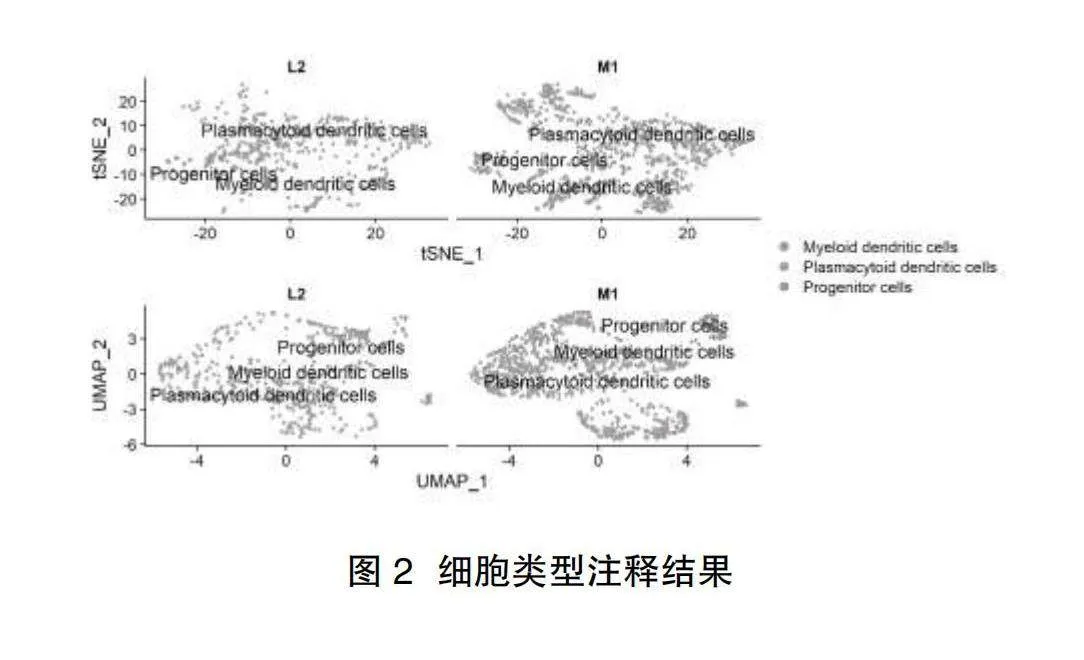
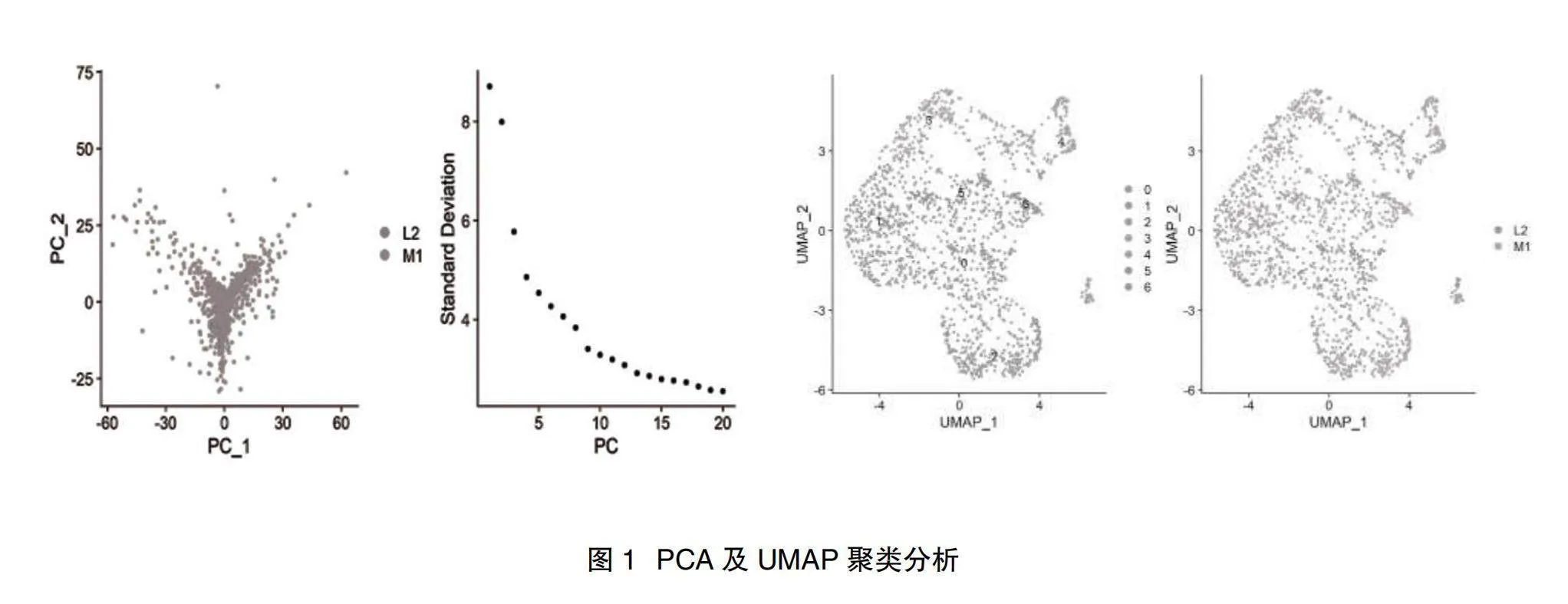
2.1聚類分析結果" PCA對1395個細胞降維后選取前15的主成分,進行UMAP和t-SNE聚類分析,獲得7個聚類的細胞群,不同類的細胞群標記為不同的數字,M1代表模擬感染的樣品細胞,L2代表受LACV感染的細胞,見圖1。
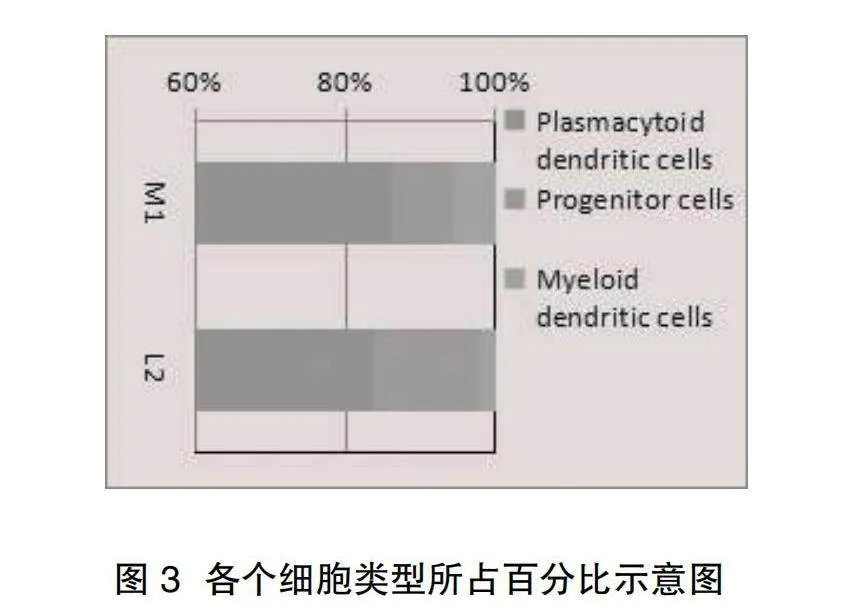
2.2細胞亞群的注釋結果" 7個細胞亞群被注釋為3種細胞類型,分別為漿細胞樣樹突狀細胞、祖細胞、髓樣樹突狀細胞,見圖2。937個對照組樣本細胞中含有808個漿細胞樣樹突狀細胞、77個祖細胞、52個髓樣樹突狀細胞。458個LACV感染細胞中含有384個漿細胞樣樹突狀細胞、64個祖細胞、10個髓樣樹突狀細胞,百分比圖見圖3。
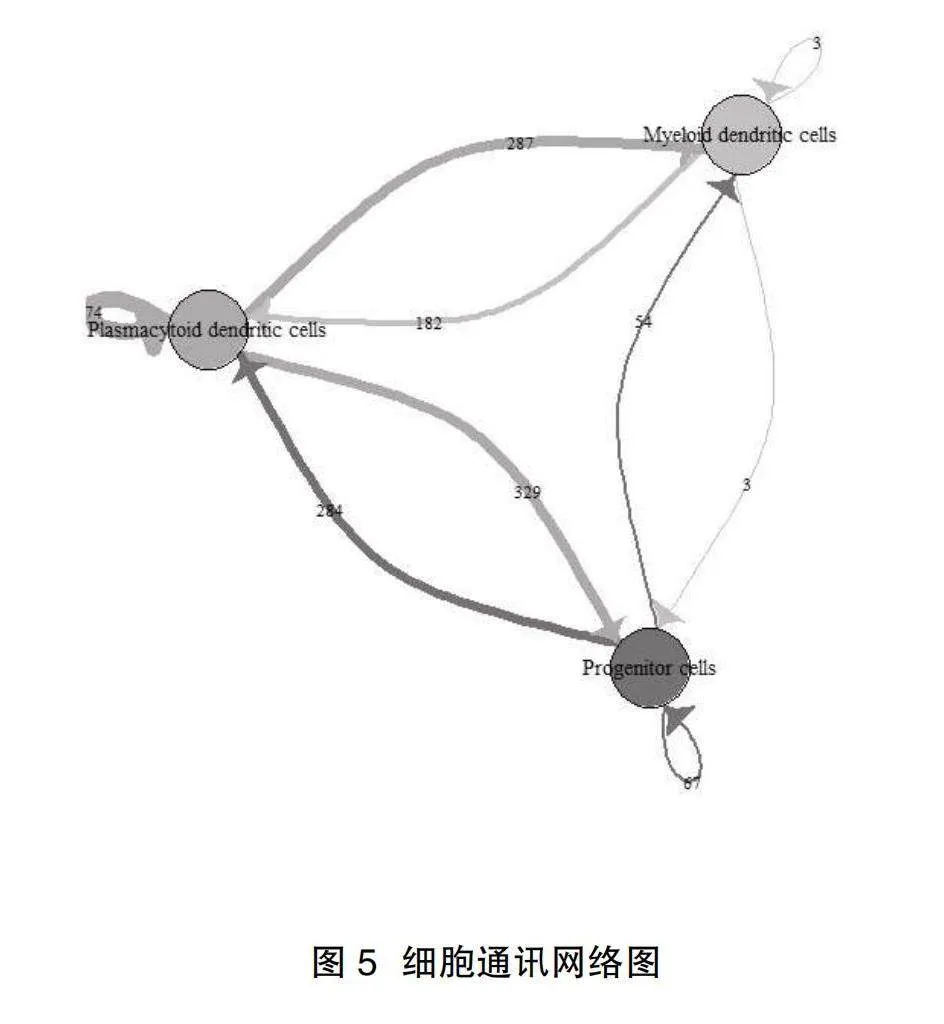
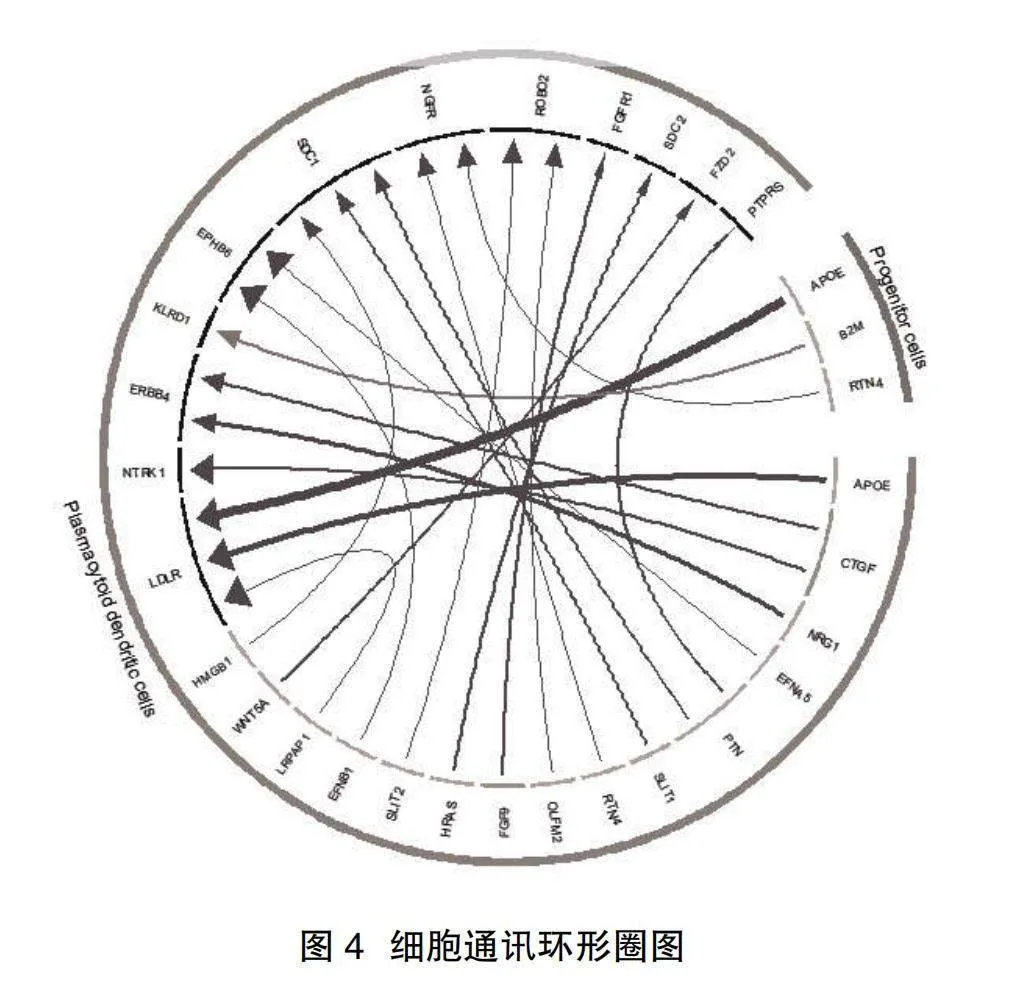
2.3細胞通訊分析結果" 細胞間的交流主要發生在祖細胞和漿細胞樣樹突狀細胞之間。祖細胞上的配體和漿細胞樣樹突狀細胞的受體結合有284對,漿細胞樣樹突狀細胞的配體和祖細胞上的受體結合有329對,漿細胞樣樹突狀細胞的配體和髓樣樹突狀細胞的受體結合有287對,同類型細胞也可通過多種配體和受體發生相互作用,其中祖細胞上的APOE配體和漿細胞樣樹突狀細胞的LDLR受體發生作用的程度比較明顯,見圖4、圖5。
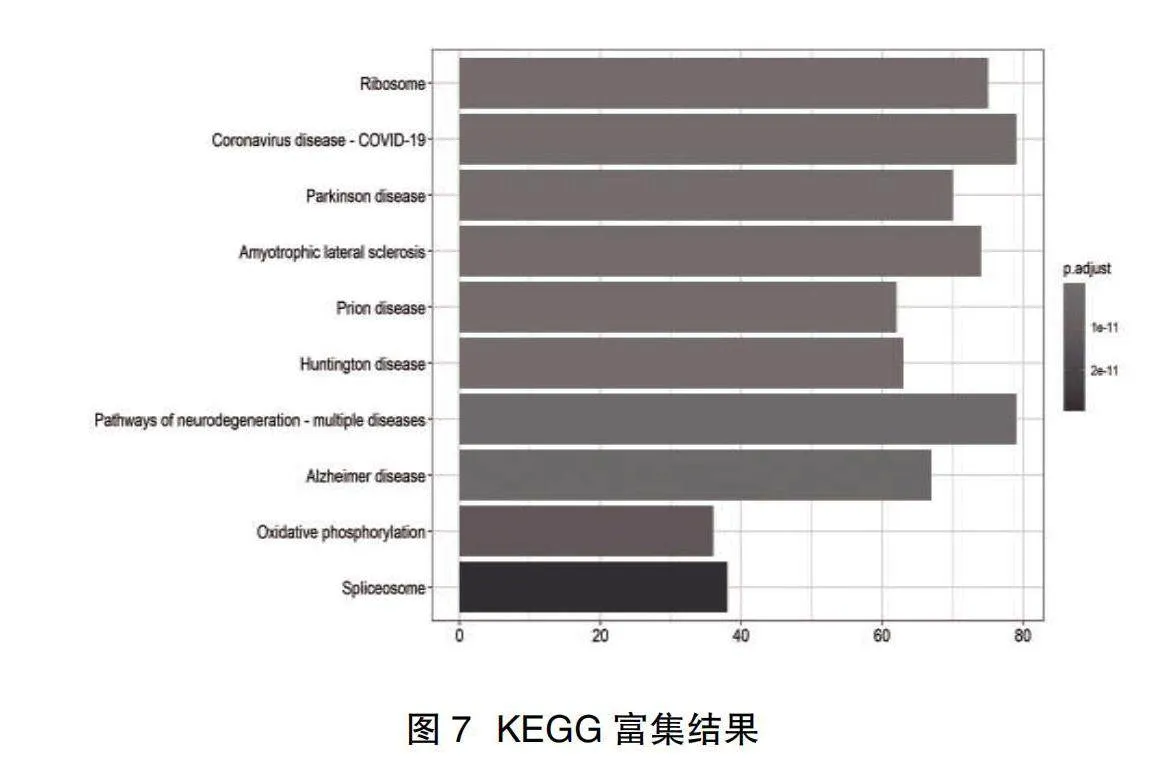
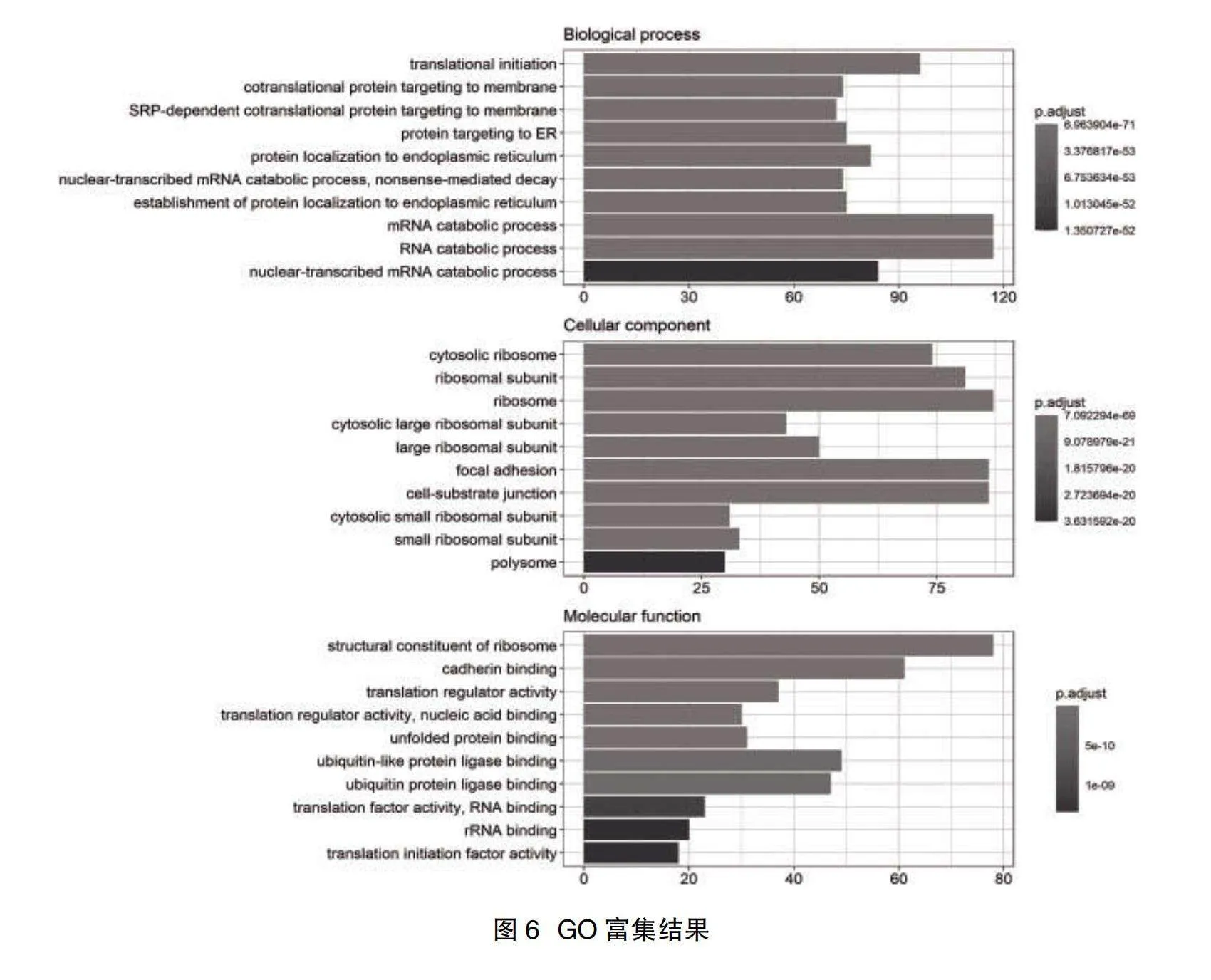
2.4富集分析結果" 在模擬感染和受LACV感染細胞的差異基因在生物學功能方面,主要富集于翻譯起始、mRNA和RNA分解過程、靶向膜的協同翻譯蛋白等;在細胞組分方面,主要富集于核糖體、局灶性粘連,細胞-底物連接之中;在分子功能方面,主要富集于核糖體結構組成、鈣黏素結合等,見圖6。KEGG富集分析顯示,差異基因主要富集于核糖體、冠狀病毒感染、帕金森、肌萎縮性側索硬化等疾病的信號通路中,見圖7。
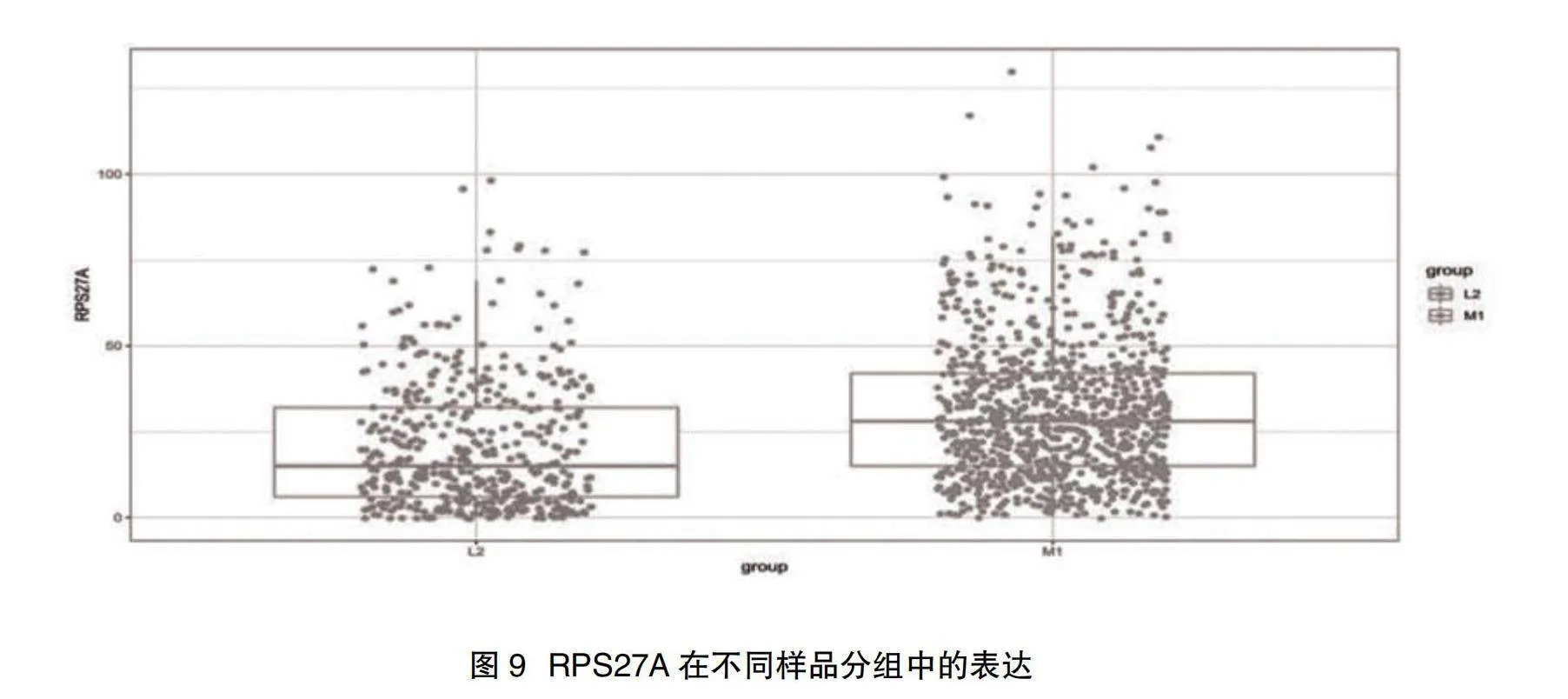
2.5 PPI網絡鑒定關鍵基因結果" 取PPI網絡中節點前4的關鍵基因,分別為RPS27A、UBA52、RPLP0、RPL13A,見圖8;并展示其中的關鍵基因RPS27A在不同樣本間的表達情況,見圖9。
3討論
本研究發現,在類器官受到LACV感染后,分化的3種免疫細胞與對照組比較比率有所不同。髓樣樹突狀細胞減少,祖細胞增多。這提示髓樣樹突狀細胞在抵抗病毒感染的免疫反應中發揮重要作用。與Taylor KG等[10]的研究結果一致。髓樣樹突狀細胞是T細胞經典的抗原提呈細胞,在對流感病毒的研究中證明,宿主對流感病毒感染的反應是通過啟動循環單核細胞快速分化為能夠產生干擾素的髓樣樹突狀細胞,分化的髓樣樹突狀細胞可上調干擾素刺激基因,分泌Ⅰ型干擾素抗感染,強化固有的抗病毒免疫反應[11]。既往的研究于受人類呼吸道合胞病毒感染的細胞發現幼年動物對病毒感染產生的Ⅰ型干擾素反應明顯比成年動物程度更輕[12],這可能提示機體對不同的病毒感染有著類似的抵御機制,如調節Ⅰ型干擾素反應。
此次研究還發現祖細胞上高表達APOE和漿細胞樣樹突狀細胞的LDLR發生作用,并且漿細胞樣樹突狀細胞自身可通過表達APOE-LDLR進行交流通話指導下游的信號通路。既往的研究發現,E型載脂蛋白(APOE)是阿茲海默病(Alzheimer's disease, AD)的危險因素[13],說明在引起記憶障礙和癡呆等表現中,LACV感染和AD有著類似的病理發生機制。降低APOE的表達或阻斷APOE-LDLR這一信號通路是否能逆轉病毒所致學習和記憶障礙在將來或許可做進一步研究。
在發現的關鍵基因模塊中,主要為兩類基因:一類是泛素基因(RPS27A、UBA52);一類為核糖體基因(RPLP0、RPL13A)。泛素化是一種關鍵的蛋白質后修飾過程,涉及將泛素分子連接到目標蛋白質上,從而調控其穩定性和功能[14]。在病毒感染的背景下,泛素化過程可能受到擾動,從而影響宿主細胞的抗病毒反應。有研究表明[15],人乳頭瘤病毒可以通過促進TRIM21介導的降解和IFI16炎癥小體的泛素化過程來逃避宿主的免疫監視。特別是泛素基因在某些病毒感染的細胞中的低表達可能是病毒為了抑制細胞的天然免疫反應而采取的策略[16]。這種機制可能為病毒提供了一個有利的環境,使其能夠在宿主細胞中有效地復制和傳播。此外,研究表明泛素基因還可以參與形成核糖體蛋白復合體[17],而核糖體基因的表達缺失可以促使炎癥的發生[18]。在病毒感染的情況下,包括編碼核糖體蛋白的基因在內的細胞核糖體蛋白基因表達水平會有明顯的變化[19,20]。這種現象被認為是宿主細胞對病毒復制的一種防御機制的一部分,旨在限制病毒借助核糖體進行自我復制。此外,有研究這提出這種變化可能是由病毒侵入引發的細胞應激反應的一部分,例如干擾素途徑的激活[21]。本研究表明了在受LACV感染的細胞中,泛素基因和核糖體基因呈現低表達水平,提示病毒阻礙了相關核糖體蛋白的正常合成與表達。富集結果也表明病毒主要參與核糖體蛋白的翻譯和降解過程,突顯了病毒與宿主細胞之間錯綜復雜的相互作用。另外差異基因還富集于帕金森、肌萎縮性側索硬化等疾病的信號通路中。已經有研究發現[22],LACV感染會引發神經炎癥反應。而在多發性硬化癥和帕金森病這類神經系統疾病的病理機制中,免疫炎癥反應往往參與其中[23,24]。因此,LACV感染可能通過免疫介導的機制影響神經系統健康。
綜上所述,本研究對LACV感染的人腦類器官轉錄組數據進行單細胞分析,發現了病毒感染所致的免疫細胞亞型及其比例,以及亞型之間主要的通訊方式,并發現病毒可導致泛素基因和核糖體基因的低表達,進而影響核蛋白翻譯和降解,為進一步闡明病毒的作用機制和選擇干預靶點提供了一定的理論基礎。
參考文獻:
[1]Harding S,Greig J,Mascarenhas M,et al.La Crosse virus: A scoping review of the global evidence[J].Epidemiology amp; Infection,2019,147:e66.
[2]Tian L,Dong X,Freytag S,et al.Benchmarking single cell RNA-sequencing analysis pipelines using mixture control experiments[J].Nature Methods,2019,16(6):479-487.
[3]Qian X,Nguyen HN,Song MM,et al.Brain-region-specific organoids using mini-bioreactors for modeling ZIKV exposure[J].Cell,2016,165(5):1238-1254.
[4]Zhang B,He Y,Xu Y,et al.Differential antiviral immunity to Japanese encephalitis virus in developing cortical organoids[J].Cell Death amp; Disease,2018,9(7):719.
[5]Winkler CW,Woods TA,Groveman BR,et al.Neuronal maturation reduces the type I IFN response to orthobunyavirus infection and leads to increased apoptosis of human neurons[J].Journal of Neuro Inflammation,2019,16(1):1-16.
[6]Stuart T,Butler A,Hoffman P,et al.Comprehensive integration of single-cell data[J].Cell,2019,177(7):1888-1902.e21.
[7]Aran D,Looney AP,Liu L,et al.Reference-based analysis of lung single-cell sequencing reveals a transitional profibrotic macrophage[J].Nature Immunology,2019,20(2):163-172.
[8]Wang Y,Wang R,Zhang S,et al.iTALK: an R package to characterize and illustrate intercellular communication[J].Bio Rxiv,2019:507871.
[9]Yu G,Wang LG,Han Y,et al.clusterProfiler: an R package for comparing biological themes among gene clusters[J].Omics,2012,16(5):284-287.
[10]Taylor KG,Woods TA,Winkler CW,et al.Age-dependent myeloid dendritic cell responses mediate resistance to la crosse virus-induced neurological disease[J].J Virol,2014,88(19):11070-11079.
[11]Assil S,Coléon S,Dong C,et al.Plasmacytoid dendritic cells and infected cells form an interferogenic synapse required for antiviral responses[J].Cell Host amp; Microbe,2019,25(5):730-745.e6.
[12]Heinonen S,Velazquez VM,Ye F,et al.Immune profiles provide insights into respiratory syncytial virus disease severity in young children[J].Science Translational Medicine,2020,12(540):eaaw0268.
[13]Zhao J,Fu Y,Yamazaki Y,et al.APOE4 exacerbates synapse loss and neurodegeneration in Alzheimer's disease patient iPSC-derived cerebral organoids[J].Nature Communications,2020,11(1):5540.
[14]Roberts JZ,Crawford N,Longley DB.The role of ubiquitination in apoptosis and necroptosis[J].Cell Death amp; Differentiation,2022,29(2):272-284.
[15]Song Y,Wu X,Xu Y,et al.HPV E7 inhibits cell pyroptosis by promoting TRIM21-mediated degradation and ubiquitination of the IFI16 inflammasome[J].International Journal of Biological Sciences,2020,16(15):2924.
[16]Li HC,Yang CH,Lo SY.Strategies of Influenza A Virus to Ensure the Translation of Viral mRNAs[J]. Pathogens,2022,11(12):1521.
[17]Dougherty SE,Maduka AO,Inada T,et al.Expanding role of ubiquitin in translational control[J]. International Journal of Molecular Sciences,2020,21(3):1151.
[18]Kour R,Komar AA,Mazumder B.Mutually exclusive amino acid residues of L13a are responsible for its ribosomal incorporation and translational silencing leading to resolution of inflammation[J].RNA,2019,25(10):1377-1392.
[19]Guan J,Han S,Wu J,et al.Ribosomal protein L13 participates in innate immune response induced by foot-and-mouth disease virus[J].Frontiers in Immunology,2021,12:616402.
[20]Duan Z,Tang H,Wang Y,et al.The association of ribosomal protein L18 with Newcastle disease virus matrix protein enhances viral translation and replication[J].Avian Pathology,2022,51(2):129-140.
[21]Sarry M,Vitour D,Zientara S,et al.Foot-and-mouth disease virus: molecular interplays with IFN response and the importance of the model[J].Viruses,2022,14(10):2129.
[22]Ojha D,Winkler CW,Leung JM,et al.Rottlerin inhibits La Crosse virus-induced encephalitis in mice and blocks release of replicating virus from the Golgi body in neurons[J].Nature Microbiology,2021,6(11):1398-1409.
[23]Rodríguez Murúa S,Farez MF,Quintana FJ.The immune response in multiple sclerosis[J]. Annual Review of Pathology: Mechanisms of Disease,2022,17:121-139.
[24]Tan EK,Chao YX,West A,et al.Parkinson disease and the immune system-associations, mechanisms and therapeutics[J].Nature Reviews Neurology,2020,16(6):303-318.
收稿日期:2023-09-15;修回日期:2023-09-25
編輯/肖婷婷

