人工智能結合PET/CT與高分辨CT對肺部炎性肉芽腫結節定性分析的臨床研究


【摘要】 目的 研究人工智能實現正電子發射斷層/計算機斷層顯像(positron emission tomography/computed tomography,PET/CT)結合高分辨CT進行肺部炎性肉芽腫結節多參數定性診斷的價值。方法 選取2020年1月1日—2023年4月30日贛州市人民醫院存儲的肺結節PET/CT圖像、高分辨率CT圖像及數據,基于3D CNN網絡模型和XGboost分類器建立雙通道聯合模型,通道1輸入結構化的結節特征信息和患者基本信息,通道2輸入圖像數據,以2020年1月1日—2022年9月30日肺結節圖像及數據材料作為訓練樣本,以2022年10月1日—2023年4月30日的肺結節圖像及數據材料作為測試樣本,進行20×20×20、30×30×30、40×40×40 3種體素尺度圖像的模型性能實驗。結果 雙通道聯合模型下,30×30×30體素尺度下診斷準確率為0.964 3±0.017 7,靈敏度為0.961 4±0.019 5,特異度為0.964 4±0.019 9,曲線下面積(area under curve,AUC)為0.979 9±0.011 5,顯著優于20×20×20、40×40×40 2種體素尺度,差異有統計學意義(Plt;0.05);醫師盲審診斷準確率為0.798 4±0.058 9,靈敏度為0.765 3±0.067 8,特異度為0.843 9±0.042 1,AUC為0.823 1±0.051 9,顯著低于模型診斷表現,差異有統計學意義(Plt;0.05);與單純輸入圖像數據采用3D CNN網絡進行人工智能輔助診斷相比,3種體素尺度下引入結節特征參數和患者信息的診斷表現明顯更優,差異有統計學意義(Plt;0.05)。結論 采用雙通道聯合模型,引入結節特征信息和患者基本信息,進行人工智能結合PET/CT與高分辨CT圖像的聯合診斷,可有效提高肺部炎性肉芽腫結節的良惡性定性診斷準確率,為醫師提供更有價值的輔助診斷信息,具有較高的應用價值。
【關鍵詞】 正電子發射斷層/計算機斷層顯像;高分辨CT;肺部炎性肉芽腫結節;人工智能
文章編號:1672-1721(2024)27-0009-05" " "文獻標志碼:A" " "中國圖書分類號:R734.2
肺部炎性肉芽腫結節是一種慢性炎癥刺激引起的肺部結節疾病,多因感染引起肺部慢性炎癥所致,導致局部纖維組織增生形成局部炎性肉芽結節,也有因異物導致炎癥形成結節狀病變現象,患者可表現為咳嗽、咳痰、胸痛、發熱等臨床癥狀,影像學檢查可見肺部多個大小不一的結節狀陰影[1-2]。在臨床上,影像學檢查是肺結節檢測和識別的重要手段,但由于肺部炎性肉芽腫結節特點多樣,形態和大小各異,與肺癌、轉移瘤等有一定相似之處,加上醫生診療水平、認知經驗等方面的影響,診斷結果具有一定的主觀性和不穩定性,存在一定誤診為惡性病灶的可能,急需更為客觀的影像學評價,以提高診斷準確率[3]。目前,人工智能技術在肺結節影像診斷方面的研究較多,取得了大量的研究成果,但多集中于傳統的CT圖像上,PET/CT結合高分辨CT影像的人工智能綜合輔助診斷方面的研究較少[4]。基于此,本研究采用深度學習方法,提取肺部炎性肉芽腫結節的幾何學、亮度、梯度等影像學特征參數,采用非結構化圖像數據、結構化特征參數雙通道輸入的方式構建基于3D CNN網絡和XGBoost算法的聯合模型,研究PET/CT結合高分辨CT影像的人工智能診斷定性分析技術的可行性,為肺部炎性肉芽腫結節的臨床診斷提供更多有價值的參考,報告如下。
1 資料與方法
1.1 研究材料
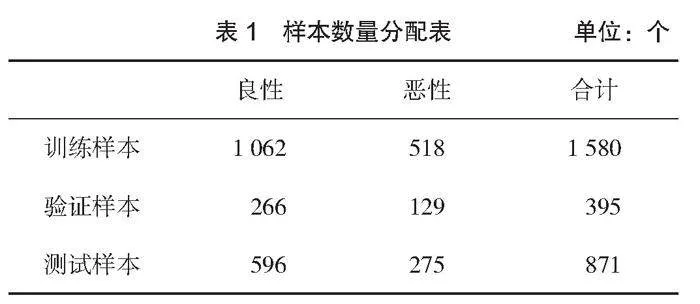
選取2020年1月1日—2023年4月30日贛州市人民醫院存儲的肺結節PET/CT圖像、高分辨率CT圖像及數據,按圖像清晰、結節結構清晰、病理報告完整為標準共篩選出1 472例病例,共有肺部炎性肉芽腫結節2 846個,其中良性結節1 924個、惡性結節922個。以2020年1月1日—2022年9月30日的肺結節圖像及數據材料作為訓練驗證樣本,用于人工智能模型的學習訓練和驗證,采用隨機分類的方法,80%作為模型訓練樣本,20%作為模型驗證樣本;以2022年10月1日—2023年4月30日的肺結節圖像及數據材料作為測試樣本,用于最終模型性能的測試。結節性質及數量如表1所示。
1.2 圖像處理
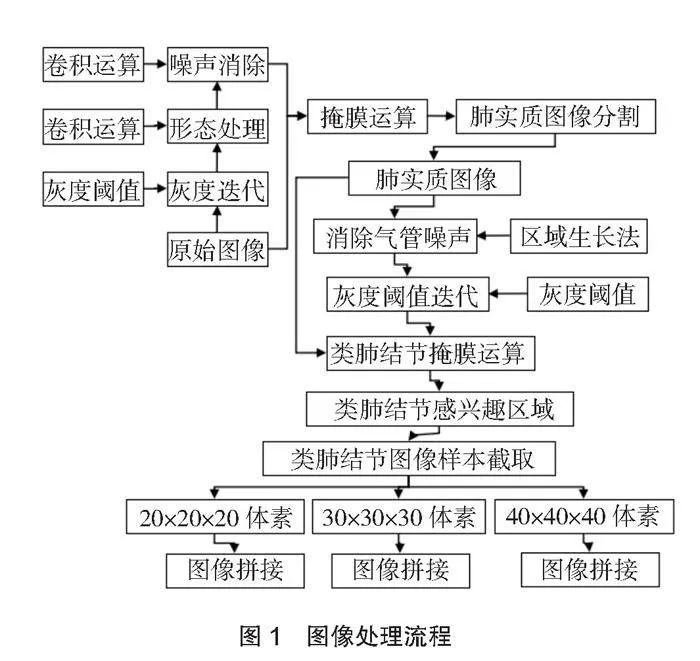
根據圖像特征設置灰度閾值,運用迭代閾值算法[5]對CT圖像進行二值化處理,分離肺實質區域和胸腔輪廓區域,運用卷積運算消除不符合肺部及結節的結構元素,消除血管等噪聲點,進行去噪處理。消除噪聲點獲得更為清晰連續的圖像后,進行掩膜運算獲得肺實質感興趣區域,分割出肺實質圖像。運用區域生長法,探索肺實質圖像中的氣管部分,再以灰度閾值迭代運算后進行掩摸操作,獲得肺結節感興趣區域。
對于2D圖像數據,直接以獲得的肺結節感興趣區域中心點為坐標,截取中心點坐標周圍20×20×20、30×30×30、40×40×40體素(1×1×1 mm3/voxel)3種尺度的結節2D圖像樣本,將PET/CT圖像和高分辨CT圖像拼接為一張2D圖像。對于3D圖像據,采用2D多視圖融合(2D multi-view fusion,2D MVF)技術,即不對3D圖像進行展開操作,只取3D結節中心點坐標點4張2D圖像拼接為2D MVF圖像,以保留更多的結節信息,并在截取的圖像中減少干擾性組織的影響。同樣以感興趣中心點坐標截取周圍20×20×20、30×30×30、40×40×40體素構建3種尺度的2D FVF視圖,將PET/CT圖像和高分辨CT圖像拼接。具體流程如圖1所示。
1.3 肺部炎性肉芽腫結節特征參數
運用人工智能技術通過深度學習,對PET/CT結合高分辨率CT影像數據進行人工智能輔助診斷[6-8]。設計肺部炎性肉芽腫結節特征參數,包括結節性質、標準化攝取值最大值、病灶大小、病灶數量、密度特征、鈣化程度、球形度、邊緣特征、分葉特征、毛刺特征、紋理特征。其中,結節性質根據病理報告確定,標準化攝取值最大值根據PET/CT診斷結果確定,病灶大小根據PET/CT、CT診斷結果確定,其余特征參數由4名放射科醫師根據圖像進行人工標注。具體參數設置見表2。
1.4 其他結構化特征參數
除結節結構化特征參數外,增加患者信息數據作為結構化參數,包括吸煙史、肺癌家族史、疾病史等,具體參數設計見表3。
1.5 人工智能模型構建
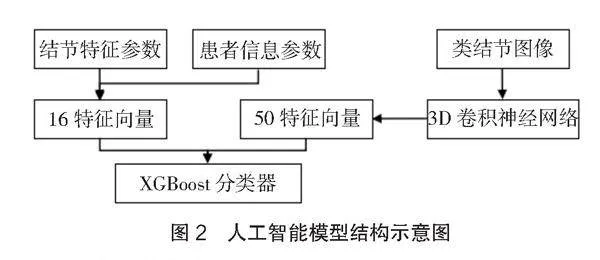
采用3D卷積神經網絡和XGBoost算法聯合建模,構建雙通道輸入模型,用于PET/CT結合高辨率CT的肺部炎性肉芽腫結節的人工智能定性診斷。該模型采用2個輸入通道,第1個通道輸入1.3、1.4中設計的結構化數據,共16個參數轉化為長度16的特征向量;第2個通道用于圖像特征向量的提取,截取后的類結節圖像數據通過第2個通道,采用3D卷積神經網絡提取出長度為50的特征向量,合成66個特征向量輸入到XGBoost分類器中進行分類。通過10次5倍交叉驗證后,以共計50次的驗證結果均值作為最終定性評價結果,將結節分為“良性”“惡性”。模型結構如圖2所示。
1.6 統計學方法
采用準確率、靈敏度、特異度、AUC值來評估模型的診斷能力。其中,準確率為正確診斷肺部炎性肉芽腫結節性質占總樣本的比例,靈敏度為正確識別惡性結節占全部惡性結節樣本數量的比例,特異度為正確識別良性結節占全部良性結節樣本數量的比例,AUC值為受試者工作特征(receiver operating characteristic,ROC)曲線下方面積。采用SPSS 21.0統計學軟件進行統計分析,符合正態分布的計量數據以x±s表示,采用獨立樣本t檢驗和單因素方差分析F檢驗。對3種體素尺度下模型的性能進行對比,并與超聲科醫生的臨床診斷結果進行對比、與采用傳統3D CNN模型僅輸入結節圖像診斷性能進行對比。Plt;0.05為差異有統計學意義。
2 結果
2.1 3種體素尺度下模型診斷表現
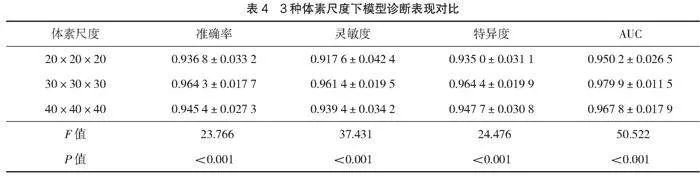
將3種體素尺度下的結節圖像及結構化特征分別輸入模型進行訓練后,得到不同體素尺度下的訓練完成的模型,對測試數據進行診斷測試,共進行50次測試驗證,模型預測值以0.5為分界點,預測值≥0.5為惡性,lt;0.5為良性,以病理報告組織病理學檢查結果為金標準,診斷表現見表4。3種體素尺度的診斷準確率、診斷靈敏度、診斷特異度、AUC值比較,差異有統計學意義(Plt;0.05)。
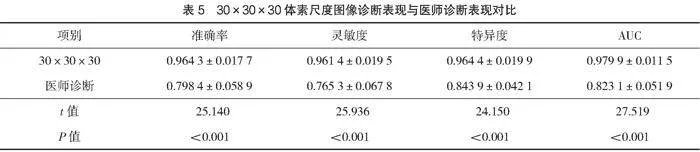
2.2 模型診斷表現與醫師診斷對比
選擇模型診斷表現最為優秀的30×30×30體素尺度診斷表現與醫師診斷表現進行獨立樣本t檢驗,檢驗結果見表5。30×30×30體素尺度圖形模型診斷與醫師診斷準確率、診斷靈敏度、診斷特異度、AUC值比較,差異有統計學意義(Plt;0.05)。
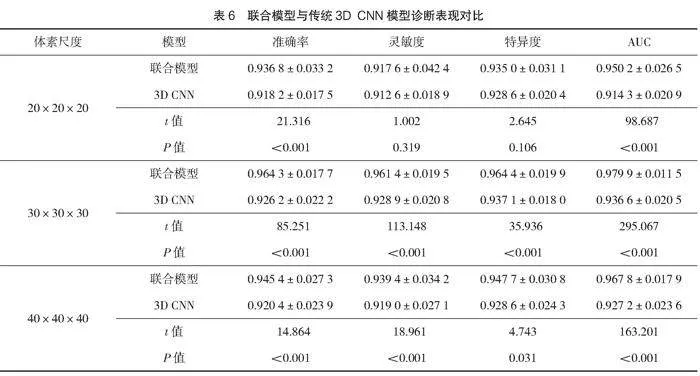
2.3 聯合模型診斷與傳統3D CNN模型診斷對比
以傳統的3D卷積神經網絡模型,僅輸入結節圖像進行診斷,診斷結果與本研究建立的3種體素尺度聯合模型圖像診斷結果進行對比,結果見表6。輸入20×20×20體素尺度圖像,聯合模型與單純3D CNN模型診斷準確率、AUC值比較,差異有統計學意義(Plt;0.05);輸入20×20×20體素尺度圖像,聯合模型與單純3D CNN模型診斷靈敏度、特異度比較,差異無統計學意義(Pgt;0.05)。輸入30×30×30體素尺度圖像,聯合模型與單純3D CNN模型診斷準確率、靈敏度、特異度、AUC值比較,差異有統計學意義(Plt;0.05)。輸入40×40×40體素尺度圖像,聯合模型與單純3D CNN模型診斷準確率、靈敏度、特異度、AUC值比較,差異有統計學意義(Plt;0.05)。
3 討論
PET/CT利用腫瘤細胞代謝比正常細胞更高的特點,以正電子核素為示蹤劑,可快速獲得多層面斷層影像和定量結果,觀察病灶功能和代謝信息,利于腫瘤的早期診斷和鑒別,已經被廣泛應用于肺結節良惡性鑒別診斷之中[9]。PET/CT的定量分析主要以核素的標準攝取值作為依據。除腫瘤具有高代謝特征外,巨噬細胞、粒細胞、活動期肺結核等同樣具有代謝旺盛的現象,表現出高攝取特征,因此PET/CT診斷惡性肺結節具有較高的假陽性率。有研究顯示,PET/CT診斷惡性肺結節的假陽性率高達11%,存在較大的誤診可能[10-13]。當腫瘤病灶太小或代謝不旺盛時,PET/CT難以發現病灶,造成假陰性現象,出現漏診[14]。在PET/CT檢查中,身體成分和造影劑的注射劑量也會對圖像造成影響,造成偽影和圖像模糊現象,不利于病變性質和范圍的確定[15]。因此,在肺部結節性疾病的診斷中,不能單純依靠PET/CT檢查,通常還需要結合高分辨率CT來診斷。
受診療水平、認知經驗等方面的影響,醫生在PET/CT結合高分辨CT進行肺結節診斷中存在較強的主觀性和不穩定性,依然有較大的誤診、漏診可能[16]。目前,已有大量運用人工智能輔助診斷肺結節方面的研究,但多集中在圖像識別領域。借助深度學習方法和神經網絡構建多種模型,如Dou等提出的ConvNets模型、Rajpurkar提出的CheXNet模型,在肺結節的輔助診斷中具有較高的準確率和靈敏度,能為醫師診斷提供更多的輔助信息[17]。從相關研究結果來看,僅依靠從圖像中提取特征信息進行肺結節的輔助診斷有所不足,多數研究準確率在92%以下,部分研究診斷準確率僅85%左右[6,18]。本研究采用PET/CT結合高分辨CT融合診斷的方式,引入更多的結構化參數,包括結節圖像特征參數和患者基礎信息參數,建立非結構化的圖像數據和結構化的信息參數聯合診斷模型,采用3D卷積神經網絡進行圖像數據特征的識別提取,與結構化的信息參數進行融合后,利用XGBoost分類器進行計算識別分類,進行肺結節的定性診斷,設置3種體素尺度的結節圖像,與醫師診斷和常用的3D CNN單純圖像識別診斷進行比較。
本研究結果顯示,不同體素尺度的結節聯合模型圖像下診斷準確率、靈敏度、特異度、AUC比較,差異有統計學意義(Plt;0.05);30×30×30體素尺度下利用本研究建立的雙通道聯合模型進行肺部炎性肉芽腫結節的定性診斷,準確率可達96.43%,靈敏度可達96.14%,特異度可達94.44%,AUC可達97.99%,表現最為優秀,20×20×20、40×40×40 2種體素尺度下的診斷表現稍差。分析原因,本研究雖然在雙通道聯合模型下引入了結構化的圖像特征參數和患者基本信息,但非結構化的圖像數據依然是學習訓練的主要數據和輔助診斷的重要基礎。小體素尺度下圖像所保留的信息相對較少,會浪費不少結節信息,而體素尺度過大雖然會保留更多的結節信息,卻會引入大量無關的非結節組織,給圖像識別診斷帶來一定的干擾。因此20×20×20和40×40×40 2種體素尺度下的圖像診斷表現弱于30×30×30體素尺度。
本研究進一步以表現最優秀的30×30×30體素尺度下聯合模型診斷表現與醫師盲審診斷進行對比發現,聯合模型的診斷表現明顯優于醫師盲審診斷表現。分析原因,醫師在對肺結節進行診斷時,更傾向于關注PET/CT檢查提供的信息,對圖像的識別分析有較大的主觀性,從而導致診斷表現較差。在聯合模型各體素尺度下與單純利用圖像通過3D CNN進行輔助診斷的診斷表現進行對比發現,雙通道聯合模型在各體素尺度下的診斷表現均優于3D CNN模型。分析原因,3D CNN模型僅通過圖像數據進行診斷識別,而本研究建立的雙通道聯合模型引入了結構化的結節特征參數和患者信息參數,納入了更多利于結節定性診斷的信息,從而提高了診斷的準確率和靈敏度。
由于肺部炎性肉芽腫結節也可表現出一定的高代謝特征,單純依靠PET/CT檢查會一定程度出現假陽性診斷結果,造成不必要的外科手術和治療。利用人工智能技術進行圖像識別輔助診斷肺結節能為臨床提供更多的信息,幫助醫師作出較為準確的診斷,但依然有所不足。利用PET/CT結合高分辨CT,納入PET/CT檢查提供的標準攝取值等結節信息和患者信息,將PET/CT圖像與高分辨CT圖像拼接,通過雙通道分別輸出圖像和特征參數,利用3D CNN提取圖像特征信息,利用XGBoost進行診斷定性分類,在肺部炎性肉芽腫結節定性診斷上的準確率、靈敏度、特異度、AUC均有較好的表現,能為醫師的診斷提供更佳的輔助信息,在臨床上有一定的應用價值。
4 結論
采用雙通道聯合模型,引入結節特征信息和患者基本信息,與CT圖像數據結合,進行PET/CT結合高分辨CT圖像的聯合診斷,可有效提高肺部炎性肉芽腫結節的良惡性定性診斷準確率,為醫師提供更有價值的輔助診斷信息,具有較高的應用價值。
參考文獻
[1] 劉浩雷,李文韜,曹偉云,等.良性肺結節誤診為惡性肺結節臨床分析[J].臨床誤診誤治,2022,35(8):1-3.
[2] 張升雄,時國朝.手術后病理證實為良性肺結節288例臨床病例分析[J].中華結核和呼吸雜志,2021,44(5):456-461.
[3] 賴嬋,李儒瓊,張嘉瑜,等.最大徑≤1 cm肺小結節螺旋CT靶掃描及重建的良惡性判斷分析[J].中國CT和MRI雜志,2020,18(6):41-42,58,153.
[4] 張濤,張登國,李建,等.人工智能影像系統在肺部結節診斷中的真實世界數據分析[J].四川醫學,2021,42(2):193-196.
[5] 王娟,唐麗麗,于明川,等.基于深度學習的肺結節檢測算法對不同大小肺結節的檢出效果[J].中國醫學影像技術,2019,35(12):1771-1774.
[6] 陳疆紅,鐘朝輝,江桂蓮,等.人工智能肺結節輔助診斷系統預測亞實性肺結節惡性概率[J].中國醫學影像技術,2020,36(4):535-539.
[7] 李娟娟,劉敏,楊斌,等.人工智能輔助肺結節篩查及定性診斷的應用研究[J].實用臨床醫藥雜志,2022,26(8):8-12.
[8] 曹孟昆,姜杰,朱曉雷,等.人工智能肺部結節輔助診療系統預測肺結節的良惡性及浸潤情況[J].中國胸心血管外科臨床雜志,2021,28(3):283-287.
[9] 孫希剛,趙芳,田旭,等.18F-FDG PET/CT定量參數與非小細胞肺癌患者腫瘤標志物水平的分析[J].臨床和實驗醫學雜志,2022,21(16):1766-1770.
[10] 符海杰,雷學斌,張曦,等.硬化性肺細胞瘤的MSCT與18F-FDG PET/CT表現及誤診分析[J].海南醫學院學報,2019,25(24):1902-1906.
[11] 盧靜,劉志軍,謝麗璇,等.結節病18F-氟代脫氧葡萄糖PET/CT的影像診斷及誤診分析[J].華南國防醫學雜志,2021,35(2):112-115.
[12] 趙斌,郭彬威,黃斌,等.18F-FDG PET/CT不同重建算法對肺結節SUV的影響[J].中華核醫學與分子影像雜志,2020,40(4):224-230.
[13] 王鵬遠,辛軍.原發性肺黏液腺癌18F-FDG PET/CT影像表現的初步研究[J].實用放射學雜志,2021,37(5):749-752.
[14] 馬圓,王風,韓勇,等.基于深度信念網絡檢測PET/CT圖像肺結節良惡性[J].中國醫學影像技術,2020,36(1):77-80.
[15] 許穎.PET/CT掃描在孤立性肺結節良惡性鑒別診斷中的應用價值及準確性分析[J].檢驗醫學與臨床,2021,18(7):984-986.
[16] 譚等泰,李世超,常文文,等.多特征融合的行為識別模型[J].中國圖象圖形學報,2020,25(12):2541-2552.
[17] 王風,王磊,李囡,等.基于三維卷積神經網絡深度學習的肺結節良惡性的鑒別診斷[J].中國醫學影像學雜志,2019,27(10):779-782,787.
[18] 王娟,唐麗麗,于明川,等.基于深度學習的肺結節檢測算法對不同大小肺結節的檢出效果[J].中國醫學影像技術,2019,35(12):1771-1774.
(編輯:徐亞麗)
基金項目:贛州市科技計劃項目(GZ2021ZSF179)
作者簡介:郭 佳(1980—),女,江蘇連云港人,本科,副主任醫師,主要從事PET/CT聯合核磁共振檢查對腫瘤的早期診斷方面的研究。