基于蛋白組學研究醋酸棉酚治療子宮肌瘤的作用機制
關鍵詞醋酸棉酚;子宮肌瘤;蛋白組學;生物信息學;作用機制
子宮肌瘤(uterinefibroid,UF)是女性子宮平滑肌形成的良性腫瘤,在育齡婦女中的發病率為20%~50%[1],其致病因素復雜,受年齡、種族、激素、生活方式、家族史、遺傳因素等影響[2]。相比手術的有創性,藥物保守治療是大多數UF患者更傾向的治療方式,常用治療藥物包括激素和中藥,但是激素只能暫時緩解癥狀,一旦停藥,肌瘤可能會再次生長,且長期使用激素可能會引起一系列的副作用;中藥治療效果因人而異,且需要較長時間的治療才能看到明顯的效果[3]。因此,選擇安全有效的治療藥物對UF具有重要意義。
醋酸棉酚(gossypolaceticacid,GAA)是一種多元酚醛類化合物,也是復方醋酸棉酚片的主要藥效成分。相關研究顯示,復方醋酸棉酚片在治療UF、子宮內膜異位癥等方面具有較好的效果[4―5],但關于GAA在UF中的調控作用及機制尚不清楚。蛋白組學能夠從細胞水平對蛋白質的組成進行分析,明確整個過程的變化規律及特征,可用于全面、定量描述蛋白質的表達及其在疾病或藥物治療影響下的變化[6]。基于此,本研究通過體外細胞實驗,觀察GAA對人UF細胞SK-UT-1增殖的調控作用,然后結合四維數據非依賴型采集(4D-DIA)蛋白組學技術挖掘差異蛋白并進行驗證,以期為闡明GAA治療UF的作用機制提供參考。
1 主要材料
1.1 主要儀器
本研究所用主要儀器有CKX53型倒置顯微鏡(日本Olympus公司),DYY-7C型電泳儀、DYCZ-24DN型垂直電泳槽、DYCZ-40型電轉儀(北京六一生物科技有限公司),ChemiDocTMXRS+型凝膠成像系統(美國Bio-Rad公司),ViiA7型實時熒光定量聚合酶鏈式反應儀(美國ABI公司),MultiskanFC型酶標儀、EASY-nLC1200型質譜系統、OrbitrapExploris480型高效液相色譜儀(美國ThermoFisherScientific公司)。
1.2 主要藥品與試劑
CCK-8檢測試劑盒(貨號CK04)購自日本同仁化學研究所;GAA(純度≥98.0%,貨號A506218-0001)購自生工生物工程(上海)股份有限公司;米非司酮(貨號HY-13683,純度99.83%)購自美國MCE公司;RIPA裂解液、BCA蛋白濃度測定試劑盒(貨號分別為P0013B、P0010)均購自上海碧云天生物技術股份有限公司;兔源N-myc下游調節基因1(N-mycdownstreamregulatedgene1,NDRG1)抗體、兔源表皮生長因子受體反饋抑制劑1(epidermalgrowthfactorreceptorfeedbackinhibitor1,ERRFI1)抗體、鼠源GAPDH抗體(貨號分別為26902-1-AP、11630-1-AP、60004-1-Ig)均購自美國Proteintech公司;兔源CXC趨化因子配體3(CXCchemokineligand3,CXCL3)抗體(貨號DF8554)購自美國Affinity公司;辣根過氧化物酶標記的山羊抗兔免疫球蛋白G、山羊抗鼠免疫球蛋白G二抗(貨號分別為111-035-003、115-035-003)購自美國Jackson公司。
1.3 細胞
人UF細胞SK-UT-1(貨號CTCC-007-0320)購自浙江美森細胞科技有限公司;人子宮內膜細胞EEC(貨號QS-H011)購自旗賽生物科技(武漢)有限公司。
2 方法
2.1 細胞增殖活性考察
取正常培養的SK-UT-1細胞,吸去原培養液,加入磷酸鹽緩沖液(PBS)洗后加入胰蛋白酶消化3min后終止消化,以1000r/min離心5min,細胞沉淀用培養基重懸;取20μL細胞懸液加入20μL臺盼藍進行計數,以8000個/孔進行鋪板(96孔板),細胞體積100μL;然后分為不同質量濃度(5、10、20、40、80、160μmol/L,濃度根據文獻[7]設置)GAA組、對照組(含有細胞)和空白組(不含細胞),每組設置3個復孔,于5%CO2、37℃條件下培養24h。各孔加入10μLCCK8繼續培養3h,采用酶標儀測定各孔光密度(opticaldensity,OD)值,并計算細胞存活率,細胞存活率(%)=(給藥組OD值-空白組OD值)/(對照組OD值-空白組OD值)×100%。
2.2 4D-DIA蛋白組學分析
“2.1”項下實驗結束后,向對照組、GAA組(80μmol/L)中加入含1mmol/LRIPA裂解緩沖液,冰上孵育5min;超聲5min,以15000r/min離心10min,收集上清液,采用BCA法測定總蛋白濃度。取上述蛋白溶液,在37℃下用10mmol/L二硫蘇糖醇還原45min,用50mmol/L碘乙酰胺烷基化15min;加入4倍體積的預冷丙酮,在-20℃下沉淀2h,離心,在37℃下用胰蛋白酶消化過夜。終止消化后,將樣品在C18色譜柱上脫鹽,真空濃縮后,用0.1%甲酸溶解,待上機檢測。
采用液相色譜串聯質譜(LC-MS/MS)法檢測。將上述待測樣品上樣到分析柱IonOpticksAustralia(25cm×75μm,1.6μm)中進行分離;流動相A相為0.1%甲酸溶液,B相為乙腈溶液(含0.1%甲酸),梯度洗脫(0~25min,2%B→22%B;25~30min,22%B→35%B;30~35min,35%B→80%B;35~40min,80%B);柱溫為50℃,上樣量為200ng,流速為300nL/min。分離后的餾分真空離心濃縮后,采用質譜儀進行分析,檢測方式為正離子模式,母離子掃描范圍為m/z100~1700,毛細管電壓為1500V,干燥氣體速度為3L/min,干燥溫度為180℃;利用ddaPASEF模式采集質譜數據,然后采用DIA-NN(v1.8.1)搜庫軟件,以Library-free方法搜庫,預測譜圖庫,并利用該譜圖庫進行蛋白質分析以及質控評價(包括肽段長度分布、肽段數分布、肽段漏切位點數分布、主成分分析等,以保證結果符合要求)[6],然后將相應數據過濾后用于后續的生物信息學分析。
2.3 生物信息學分析
基于“2.2”項下結果,以差異倍數(foldchange,FC)≥1.5或FC≤0.6667,且P值≤0.05篩選差異蛋白,并繪制差異蛋白統計柱狀圖;然后將每個差異蛋白的FC以2為底數取對數,P值以10為底數取對數的絕對值,繪制火山圖[8]。另外,使用WoLFPSORT軟件對差異蛋白進行亞細胞定位,并繪制餅圖,然后對差異蛋白進行基因本體(geneontology,GO)分析和京都基因與基因組百科全書(KyotoEncyclopediaofGenesandGenomes,KEGG)信號通路分析。
2.4 差異蛋白表達驗證實驗
為了進一步驗證GAA在分子層面對UF的調控作用,選取FC排前3名的差異蛋白進行驗證。將細胞分為正常組(用EEC細胞)、模型組(用SK-UT-1細胞)、陽性對照組(米非司酮,10μmol/L[9],用SK-UT-1細胞)和GAA高、中、低濃度組(80、40、20μmol/L,濃度根據“2.1”項下結果設置,用SK-UT-1細胞),細胞密度為8000個/孔,每組設3個復孔。培養24h后,將細胞裂解、離心、定量后,進行十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳,轉膜,以5%TBST封閉液室溫封閉2h,加入NDRG1、ERRFI1、CXCL3、GAPDH蛋白一抗(稀釋度均為1∶1000)于4℃條件下孵育過夜;以TBST洗膜,加入相應二抗(稀釋度均為1∶10000)室溫孵育2h;以TBST洗膜,經顯色后,采用凝膠成像系統進行觀察,然后以ImageJ軟件進行分析,以GAPDH蛋白為內參,計算各目的蛋白的表達水平。
2.5 統計學方法
利用SPSS25.0軟件進行數據處理,計量資料以x±s表示,多組間比較采用單因素方差分析,進一步兩兩比較采用LSD-t檢驗。檢驗水準α=0.05。
3 結果
3.1 GAA對SK-UT-1細胞增殖活性的影響
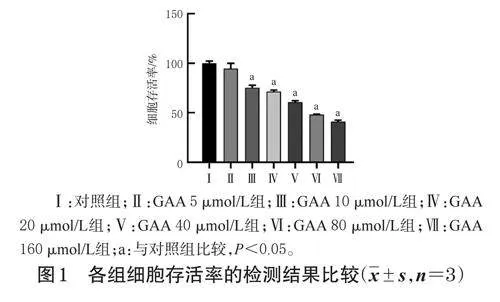
由圖1可知,與對照組比較,10~160μmol/LGAA組SK-UT-1細胞存活率均顯著降低(P<0.05);GAA濃度大于80μmol/L時,細胞存活率均小于50%。因此,后續研究選擇80、40、20μmol/L作為GAA的干預濃度。
3.2 4D-DIA蛋白組學分析和生物信息學分析結果
3.2.1 蛋白質量評估結果
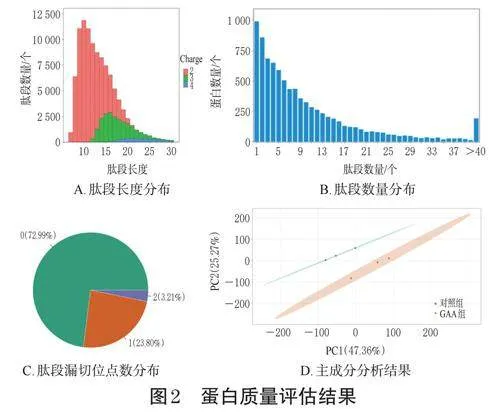
肽段長度(圖2A)結果顯示,大部分肽段有7~20個氨基酸,符合基于酶解和質譜碎裂方式的一般規律,質譜鑒定到的肽段長度也符合質控要求。肽段數量分布和漏切位點數分布(圖2B、2C)結果顯示,肽段數量較多且漏切位點數為0的肽段占比較高(為72.99%),符合質控要求(肽段數量越多,表示該蛋白越可信;肽段漏切位點數為0的肽段越多,表示酶切越徹底,鑒定結果越可信)。主成分分析(圖2D)結果顯示,各組樣本之間的蛋白差異明顯,組內樣本之間相關性明顯,符合質譜上機標準。
3.2.2 差異蛋白分析結果
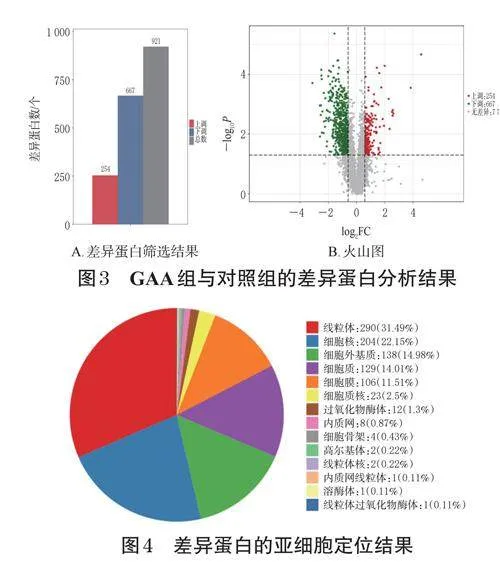
由圖3A、3B可知,GAA組與對照組共獲取了921個差異蛋白,其中上調蛋白254個、下調蛋白667個。
3.2.3 差異蛋白的亞細胞定位結果
結果顯示,差異蛋白主要分布在線粒體、細胞核、細胞外基質、細胞質和細胞膜,具體見圖4。
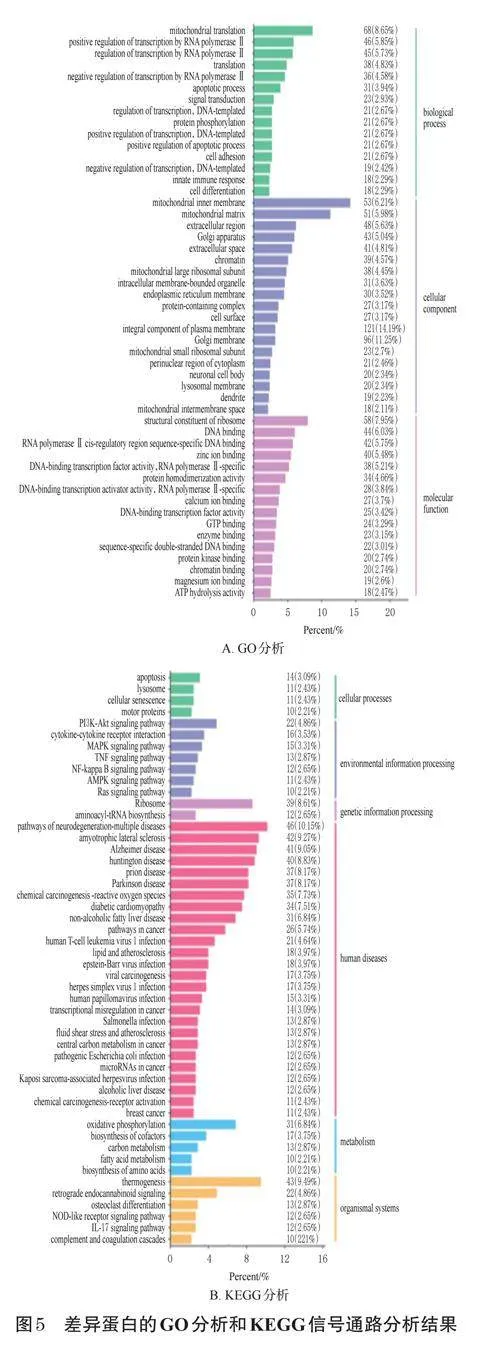
3.2.4 差異蛋白的GO分析和KEGG信號通路分析結果
選取GO分析中P值排前50名的條目繪制富集條目柱形圖(見圖5A),由圖5A可知,生物過程主要集中在線粒體蛋白翻譯、RNA聚合酶Ⅱ對轉錄的調控、蛋白翻譯、凋亡、細胞粘連及分化;細胞組分主要集中在線粒體膜、基質、染色質、細胞膜;分子功能主要集中在核糖體的構建、轉錄因子與DNA的結合等。選取排前50名的KEGG信號通路繪制富集條目柱形圖(見圖5B),由圖5B可知,信號通路主要為PI3K/AKT(phosphoinositide3-kinase/proteinkinaseB,磷脂酰肌醇3激酶/蛋白激酶B)、MAPK(mitogen-activatedproteinkinase,促分裂原活化的蛋白質激酶)、TNF(tumornecrosisfactor,腫瘤壞死因子)、NF-κB(nuclearfactorκB,NF-κB)、AMPK(AMPactivatedproteinkinase,AMP活化的蛋白質激酶)、Ras信號通路,主要涉及細胞凋亡、衰老、運動等細胞過程。
3.3 GAA對差異蛋白表達的影響結果
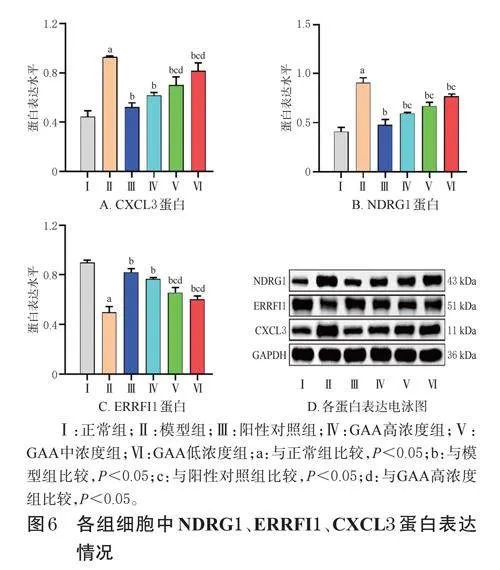
選取FC排前3名的蛋白NDRG1、ERRFI1、CXCL3進行驗證。與正常組比較,模型組細胞中NDRG1、CXCL3蛋白表達水平均顯著升高,ERRFI1蛋白表達水平顯著降低(P<0.05);與模型組比較,陽性對照組和GAA各濃度組細胞中NDRG1、CXCL3蛋白表達水平均顯著降低(P<0.05),ERRFI1蛋白表達水平均顯著升高(P<0.05)。與陽性對照組和GAA高濃度組比較,GAA中、低濃度組細胞中CXCL3蛋白表達水平均顯著升高,ERRFI1蛋白表達水平顯著降低(P<0.05)。與陽性對照組比較,GAA高、中、低濃度組細胞中NDRG1蛋白表達水平均顯著升高(P<0.05)。結果見圖6。
4 討論
GAA作為復方醋酸棉酚片的主要藥效成分,在臨床上對UF具有良好干預作用。本研究結果證實,GAA對人UF細胞SK-UT-1具有顯著的抑制作用;進一步基于蛋白組學進行差異蛋白、KEGG信號通路、GO分析,結果顯示,GAA組和對照組的差異蛋白較多,主要集中于細胞線粒體。線粒體是動物細胞除細胞核外唯一具有DNA的細胞器,線粒體功能異常是腫瘤發生、發展和轉移的重要原因[10]。差異蛋白的GO分析結果顯示,細胞過程主要為凋亡和衰老。相關研究發現,細胞凋亡、衰老與線粒體功能障礙密切相關[11]。KEGG信號通路分析結果顯示,醋酸棉酚影響的信號通路主要有PI3K/AKT信號通路、MAPK信號通路、TNF信號通路、NF-κB信號通路、AMPK信號通路、Ras信號通路,這些信號通路也與線粒體之間存在密切關系,可能在UF的發生、發展過程中發揮重要作用,如阻斷Ras信號通路的激活,可抑制UF細胞的增殖和血管生成[12―15]。
進一步對GAA組與對照組的差異蛋白進行篩選,明確FC排前3名的蛋白為NDRG1、ERRFI1、CXCL3,這3個蛋白可能是GAA調控細胞增殖、凋亡的重要靶點。NDRG1是N-myc下游調節基因,在細胞核、細胞膜及線粒體中廣泛存在,可參與細胞增殖、凋亡、脂質生物合成、應激反應、免疫調節、DNA修復、線粒體分裂等細胞過程;在腫瘤領域,NDRG1存在明顯的組織特異性和功能多效性,在不同腫瘤中發揮促癌作用[16]。ERRFI1主要作用于表皮生長因子受體信號通路,其不僅可以直接與表皮生長因子受體結合,抑制表皮生長因子受體激酶活性,還可以抑制表皮生長因子受體信號通路下游的Ras/MAPK和PI3K/AKT信號通路的激活[17]。ERRFI1作為一種腫瘤抑制基因,其表達減少以及蛋白功能的喪失有助于癌癥的發展[18]。CXCL3是CXC趨化因子亞家族的成員之一,在炎癥反應、血管生成、腫瘤轉移、免疫調節方面具有重要作用[19],其表達水平升高會促進腫瘤細胞增殖,抑制腫瘤細胞凋亡[20]。本研究結果顯示,相較于正常的子宮內膜細胞,SK-UT-1細胞中NDRG1、CXCL3蛋白表達水平均升高,ERRFI1蛋白表達水平降低;而經GAA干預后,上述蛋白表達水平均逆轉。這提示GAA可能通過下調NDRG1、CXCL3蛋白表達,上調ERRFI1蛋白表達,抑制UF細胞的增殖、存活和侵襲。
綜上所述,GAA對UF的改善作用可能涉及PI3K/AKT、MAPK、TNF等信號通路;其可通過下調NDRG1、CXCL3蛋白的表達,上調ERRFI1蛋白的表達,影響UF細胞的增殖和凋亡,從而改善UF的發生發展。本研究仍存在一些不足:蛋白組學雖然能夠提供大量關于蛋白表達變化的信息,但單純依賴蛋白組學可能無法全面揭示GAA治療UF的復雜機制。未來的研究需要綜合運用多種研究方法驗證結果,深入揭示GAA的治療機制,為UF的臨床治療提供更有效的方法。

