大鼠腦挫傷后HIF-1α表達規律的實驗性研究1)
陳國蕾,梁新華,焦 炎
低氧誘導因子(HIF-1)是近年發現的一種重要的缺氧感受因子,由α、β兩個亞基組成,其中α既是調節亞基,又是活性亞基。常氧條件下,哺乳動物的中樞神經系統、心 肺、胎盤、骨骼肌和腎等組織內均有HIF-1α的表達,但含量很低,難以檢測,但當細胞缺血缺氧時,HIF-1α表達就開始增高,作為轉錄調節因子,其介導多種效應基因的表達,在缺血缺氧反應過程發揮重要作用[1,2]。本實驗旨在通過對腦挫傷后不同時間段HIF-1α的表達進行檢測,建立HIF-1α的表達與腦挫傷經過時間的關系,為法醫學腦挫傷經過時間的推斷提供依據。
1 材料與方法
1.1 動物分組 健康成年SD大鼠64只(山西醫科大學實驗動物中心提供),體重(250±10)g,雌雄不限,隨機分為8組,分別為對照組和挫傷后1 h組、4 h組、12 h組、48 h組、72 h組、7 d組、14 d組,每組 8只。
1.2 腦挫傷模型的建立及取材 參照Feeney法建立大鼠閉合性腦挫傷模型。大鼠稱重后,3%的戊巴比妥鈉(30 mg/kg)腹腔麻醉,大鼠腦立體定位儀固定大鼠頭部,沿正中線切開頭頂部皮膚,在人字縫前方3 mm、顱骨中線旁3 mm處,鉆直徑5 mm的圓形骨窗。保持硬腦膜完整,在硬腦膜上放置墊片,采用自由落體打擊裝置,以50 g重錘從20 cm高處垂直下落打擊一次,縫合皮膚,術后常規進飲食。分別于傷后1 h、4 h、12 h、48 h、72 h、7 d、14 d頸椎脫臼處死動物,開顱,以腦挫傷灶為中心旁開1 mm行大鼠腦冠狀切面取材,置于4%多聚甲醛PBS液中固定,對照組動物直接處死,相同部位取材。
1.3 方法 甲醛中取出組織,常規酒精梯度脫水,石蠟包埋,切片(厚度4 μ m),石蠟切片脫蠟至水,常規行 HE染色,免疫組化SABC法操作步驟參照試劑盒說明書進行,3%H2O2滅活內源性酶,PBS沖洗;微波抗原修復,PBS沖洗;5%小牛血清封閉,一抗稀釋度為 1∶100,4℃,過夜,PBS沖洗;二抗37℃,45 min;PBS沖洗;滴加SABC,0.5 h,PBS沖洗;DAB鏡下控制顯色,水洗,蘇木素復染細胞核,脫水,透明,封片。用PBS取代一抗作陰性對照,以細胞核或胞漿出現棕黃色產物為陽性結果。兔HIF-1α IgG多克隆抗體、即用型SABC免疫組化試劑盒、DAB顯色試劑盒購自武漢博士德公司,其他試劑均為國產分析純。運用BI-2000圖像分析系統,在腦挫傷區周圍隨機選取5個高倍視野(×200),以損傷部位周圍出現棕黃色顆粒為陽性反應,進行陽性細胞計數。
1.4 統計學處理 采用SPSS 13.0統計軟件進行分析。計量資料用均數±標準差(±s)表示,組間差異比較采用t檢驗和方差分析。
2 結 果
2.1 HE染色結果 對照組神經元細胞形態結構正常,核染色較淡、圓形,核仁清楚;損傷組可見腦實質散在出血,蛛網膜下腔、側腦室出血。所選切面各部位均可見程度不一的神經元細胞核深染、固縮,神經元細胞水腫,周圍出現空隙,逐漸發展為胞核破碎溶解,神經元壞死消失,周圍膠質細胞增生。
2.2 HIF-1α免疫組織化學染色 傷后1 h即可觀察到陽性反應細胞,呈散在少量分布,陽性產物呈棕黃色,主要位于神經細胞胞核及胞漿內。對照組神經細胞偶見HIF-1α表達。傷后12 h可見表達HIF-1α的神經細胞數增多,表達強度增強,差異有統計學意義(P<0.05);48 h后達高峰,陽性細胞聚集成簇,周圍可見大量棕黃色產物。隨后陽性反應細胞逐漸減少,7 d后仍見少量表達,14 d后基本恢復正常。詳見表1。組別 n 陽性細胞數
表1 腦挫傷后不同時間段HIF-1α陽性細胞計數(±s)個
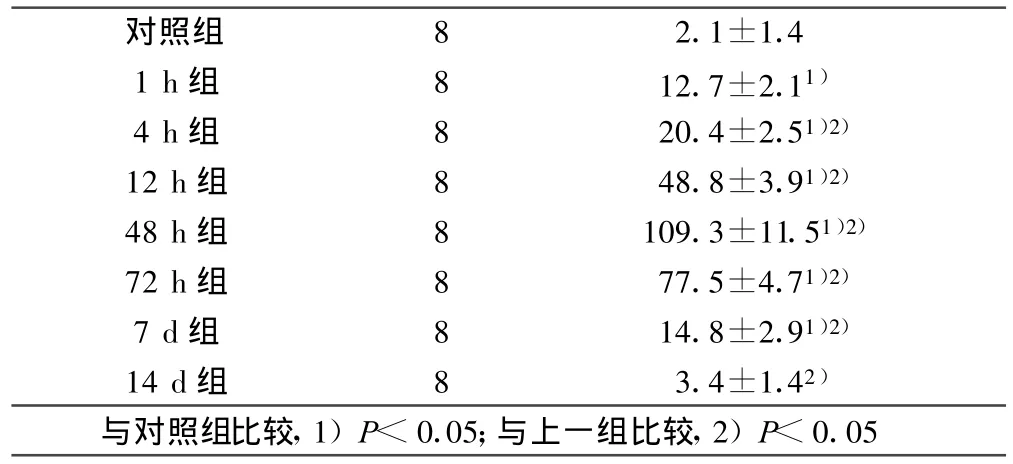
表1 腦挫傷后不同時間段HIF-1α陽性細胞計數(±s)個
對照組 8 2.1±1.4 1 h組 8 12.7±2.11)4 h組 8 20.4±2.51)2)12 h組 8 48.8±3.91)2)48 h組 8 109.3±11.51)2)72 h組 8 77.5±4.71)2)7 d組 8 14.8±2.91)2)14 d組 8 3.4±1.42)與對照組比較,1)P<0.05;與上一組比較,2)P<0.05
3 討 論
腦組織細胞對缺血缺氧極為敏感,腦挫傷常會損傷血管神經,破壞腦血循環的調節功能,造成血流變慢,組織缺氧,細胞壞死,引發各種功能障礙。對腦挫傷的調節機制進行研究,發現多種酶、神經遞質、細胞因子及相關蛋白在腦挫傷的發展過程中發揮重要作用[3-5]。HIF-1作為一種隨氧濃度變化而調節基因表達的轉錄因子,HIF-1α表達增加是缺血缺氧早期首發的分子水平的適應性反應,它作為調節基因蛋白,可以促進許多效應基因的表達,介導與缺氧有關的各種應激反應[6-8]。國內外很多學者對HIF-1α在腦挫傷的表達機制及調節機制做了深入研究,發現HIF-1α可以誘導其靶基因如促紅細胞生成素、糖酵解酶、誘導型一氧化氮合酶和血管內皮生長因子等激活,從而參與氧氣運輸、能量代謝、血管構建和細胞分化等機體的自我保護反應[9-11]。
本實驗通過模擬人的閉合性腦挫傷模型,采用免疫組化的方法對HIF-1α蛋白表達進行觀測,結果顯示HIF-1α表達主要分布于皮層、海馬和腦干,可能與這些部位對缺氧更為敏感有關,在腦挫傷后1 h即可檢測到少量 HIF-1α蛋白表達,到 4 h時,HIF-1α蛋白表達開始增強,至48 h達高峰,7 d后仍有少量表達,14 d后恢復正常。蘇莉等[12]通過制作彌漫性腦損傷模型對HIF-1α的變化規律進行研究,免疫組化結果發現彌漫性腦損傷后1 h~2 h可在皮質、丘腦和腦干等部位觀察到HIF-1α增多,12h達高峰,24h減弱。這與本實驗研究結果有一定差異,可能是由于實驗方法的不同,形成的損傷程度不同造成的。但兩者都表現出先逐漸升高,達到峰值后又逐漸下降的趨勢。本次實驗結果分析原因可能為:腦挫傷早期,腦組織缺血缺氧所致的氧化應激可以誘導HIF-1α的表達升高,但是由于基因的表達需要經過轉錄、翻譯等過程,所以早期HIF-1α的表達不明顯,隨著時間的延長,HIF-1α的降解途徑阻斷以及基因表達持續增加,所以在48 h時達到一個高峰,隨后由于組織細胞自我修復以及對缺血缺氧的耐受,HIF-1α的表達逐漸下降直至恢復正常。綜上所述,HIF-1α的表達有一定的時間規律性,但是由于損傷程度的差異,單純通過對其表達量的檢測來推斷損傷時間是不可靠的,應結合其他的形態學改變,以期得到更為可信的結果。
[1]Chun YS,Kim MS,Park JW.Oxygen-dependent and-independent regulation of HIF-1alpha[J].J Korean M ed Sci,2002,17(5):581-588.
[2]Bergeron M,Yu AY,Solway KE,et al.Induction of hypoxia-inducible factor-1(HIF-1)and its target genes following focal ischaemia in rat brain[J].Eur J Neurosci,1999,11(12):4159-4170.
[3]Ikematau K,Tsuda R,Kondo T,et al.The expression of excitatory amino acid transporter 2 in traumatic brain injury[J].Forensic Science International,2002,130(23):83-89.
[4]Dressler J,Hanisch U,Kuhlisch E,et al.Neuronal and glial apoptosis in human traumatic brain injury[J].Legal Med,2007,121(5):365-375.
[5]Marion N,Markus S.Transcriptional regulation of neurogenesis:Mechanisms in cerebral ischemia[J].M ol M ed,2007,85:577-588.
[6]Anan M,Abe T,Shimotaka K,et al.Induction of collateral circulation by hy poxia-inducible factor 1alpha decreased cerebral infarction in the rat[J].Neurol Res,2009,31(9):917-922.
[7]Maxwell PH.Hy poxia-inducible factor as a physiological regulator[J].Exp Physiol,2005(90):791-797.
[8]Suzuki H,Tomida A,Tsuruo T.Dephospho rylated hypoxia induced factor Ia as a mediator of P53 dependent apoptosis during hypoxia[J].Oncogene,2001,20:5779-5788.
[9]Hellwig-Burgel T,Stiehl DP,Wagner AE,et al.Review:Hypoxia-inducible factor-1(HIF-1):A novel transcription factor in immune reactions[J].J Interferon Cytokine Res,2005,25(6):297-310.
[10]Sememza G.HIF-1 and mechanisms of hypoxia sensing[J].Cell Regulation,2001,13:167-171.
[11]Fedele AO,Whitelaw M L,Peet DJ.Regulation of gene ex pression by the hypoxia-inducible factors[J].Mol Interv,2002,2:229-243.
[12]蘇莉,朱旭陽,汪靜宇,等.大鼠彌漫性腦損傷后腦組織HIF-1α的變化規律[J].法醫學雜志,2005,21(4):244-245.

