制藥企業實施藥品生產質量管理規范中存在的問題與對策
江映珠,李霞,李志偉,陳家潤
(1;廣東省食品藥品監督管理局審評認證中心,廣東廣州510080;2;重慶市藥品檢驗所,重慶401121)
制藥企業實施藥品生產質量管理規范中存在的問題與對策
江映珠1,李霞2,李志偉1,陳家潤1
(1;廣東省食品藥品監督管理局審評認證中心,廣東廣州510080;2;重慶市藥品檢驗所,重慶401121)
目的分析制藥企業實施生產質量管理規范(GMP)認證中存在的薄弱環節,為提高GMP實施水平提出建議。方法按照受理號排列順序分別抽取廣東省2008年及2009年度295家企業的認證資料,并對認證缺陷進行統計分析。結果與結論制藥企業在實施GMP過程中,對質量管理、生產管理、人員培訓、驗證管理等方面仍需不斷改進,提升管理水平。
藥品生產質量管理規范;認證;缺陷
藥品生產質量管理規范(GMP)是藥品生產管理和質量控制的基本要求,它能確保持續穩定地生產出適用于預定用途、符合注冊批準或規定要求和質量標準的藥品,能最大限度地減少藥品生產過程中污染、交叉污染以及混淆、差錯的風險,是目前許多國家、制藥企業和專家一致公認的,制藥企業進行藥品生產管理和管理行之有效的制度。1988年國家衛生部頒布了我國第一部《藥品生產質量管理規范》,1995年開始實施認證,標志著制藥企業實施藥品GMP正式納入法制軌道。目前執行的藥品GMP是1998年修訂版,為了便于認證檢查的執行,國家食品藥品監督管理局制定了《藥品生產質量管理規范認證檢查評定標準》(以下簡稱《檢查評定標準》),2007年10月對《檢查評定標準》進行了修訂,于2008年1月1日正式實行新的《檢查評定標準》。該標準制定的依據還是1998年版《藥品生產質量管理規范》,但條款更加細化、嚴格,不僅取消了限期整改,進一步提高和完善了人員、質量、生產、物料和文件管理的檢查項目,還強調GMP應與藥品注冊文件要求相匹配,要求原料藥和制劑必須按注冊批準的工藝生產[1]。根據國家對藥品GMP認證的總體部署,目前我國的藥品制劑、原料藥、中藥飲片、醫用氣體均已在GMP的條件下生產,藥品的生產質量有了更高保障。但制藥企業在實施GMP中仍然有很多薄弱環節,亟需引起重視。現就廣東省2008年和2009年295家認證企業的缺陷項目進行統計,分析制藥企業實施GMP中存在的問題。
1 問題分析
1.1 統計結果
結果見表1和表2。
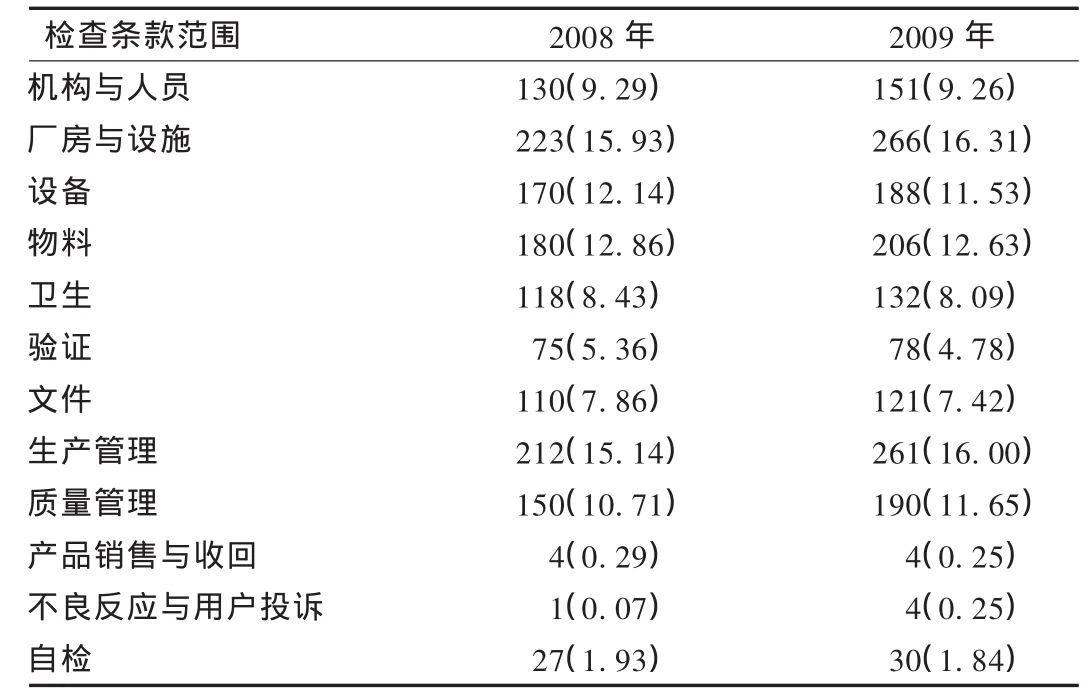
表1 2008年和2009年藥品GMP認證檢查發現的缺陷項目分布[家(%)]
1.2 存在的問題
質量管理問題尤為突出:在兩年認證檢查中,超過一半的企業存在質量管理缺陷,主要表現為質量管理部門未嚴格履行留樣觀察職責,對部分項目的檢驗和記錄不規范,未嚴格履行儀器、試劑、滴定液、培養基的管理職責等。
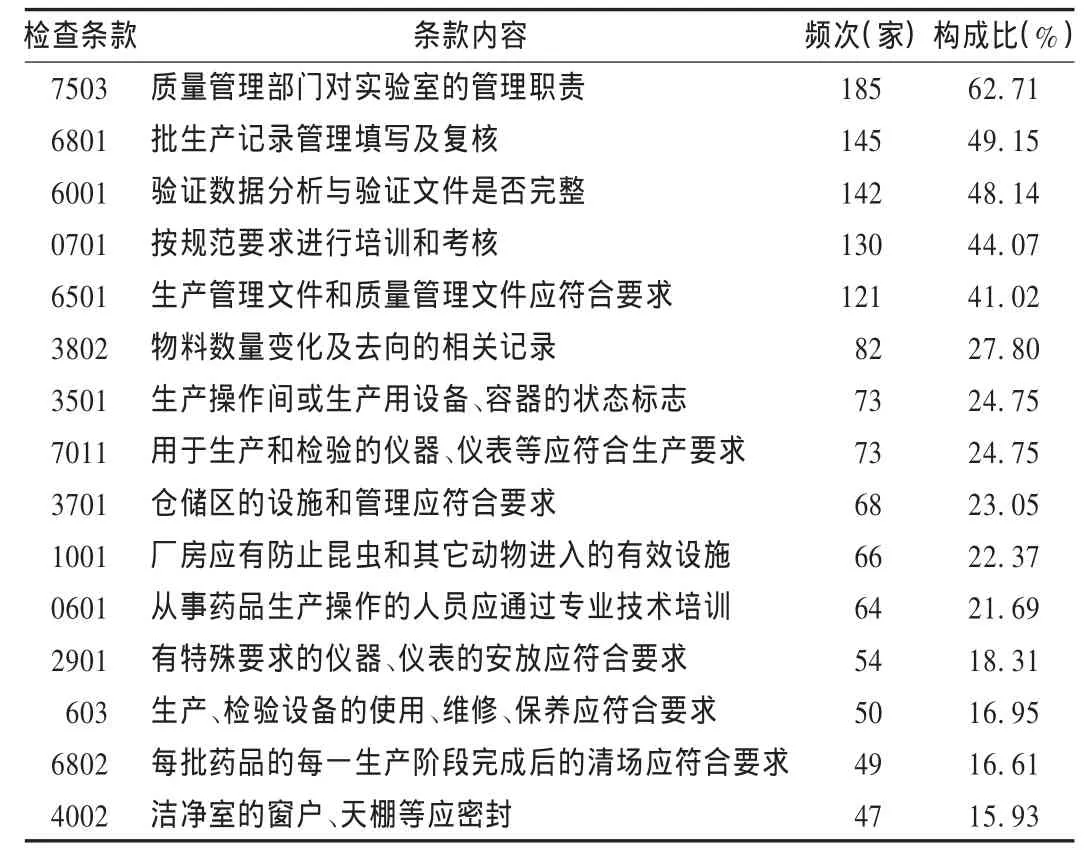
表2 2008年和2009年藥品GMP認證檢查中出現頻次最高的15條缺陷項目企業分布
生產管理不完善:在兩年認證檢查中,2項生產管理方面的缺陷(6801項及6802項)構成比超過了60%,主要表現為批生產記錄內容不完整、數據更改不符合規定,生產過程的物料衡算不正確。
驗證工作經驗不足:在兩年認證檢查中,驗證管理方面缺陷(6001項)出現的企業接近一半,主要表現為驗證的數據歸檔不全,驗證過程的重要參數未納入驗證內容,驗證機構不完善,缺少規劃性和完整性等。
人員GMP培訓不足:在兩年認證檢查中,人員方面缺陷共2項(0701項及0601項),出現頻次均較高,主要表現為缺乏對新法規及對新員工的培訓,對崗位標準操作規程(SOP)培訓不到位,培訓的內容缺乏針對性等。
文件管理較差:在兩年認證檢查中,文件管理方面缺陷(6501項)構成比超過了40%,主要表現為文件的可操作性較差,文件的描述與實際不符,文件管理混亂、隨意變更等。
2 對策
2.1 建立完善的質量保障體系
制藥企業質量管理的核心是藥品生產過程控制,一個優質產品是生產出來的,而不是檢驗出來的,應根據每個產品的生產工藝確定質量監控點。因此,企業必須建立以GMP為核心的質量管理體系。質量保障的體系離不開質量保證(QA)和質量控制(QC),QA是質量管理的核心,QC是QA的基礎,兩者形成了一個有明確任務、職能、權限以及互相協調、互助促進的有機整體,把質量管理由原來的單純檢驗工作發展成為從物料采購開始,包括生產質量管理直至成品銷售后的一整套質量管理系統。藥品GMP中,保證產品質量的概念已從單純符合藥品標準的狹義質量,發展為貫穿于產品的開發、設計、工藝流程、物料管理、檢驗、銷售及售后管理等各個環節的廣義質量,實施GMP是一個全面質量的管理過程,必須名副其實地達到GMP要求的水平[2]。
2.2 不斷完善生產管理系統
藥品的質量是制造出來的,藥品的生產過程是決定藥品質量最關鍵、最復雜的環節之一[2]。因此,藥品的生產首先必須按藥品注冊要求建立完整的、可操作性強的工藝規程,并根據工藝規程和生產規模,配備相應的生產設施設備,建立完善的崗位操作規程,建立完整的批生產記錄主控文件,生產操作人員經培訓考核上崗,并嚴格按生產操作如實記錄生產過程的每個數據。生產管理人員應建立生產控制的評價體系,會同質量管理部門不斷地改進生產技術,確保產品的質量符合注冊要求和預定的質量用途。
2.3 規范GMP驗證工作的程序和內容
驗證系指能證實任何程序、生產過程、設備、物料、活動或系統確實能導致預期結果的有文件證明的行為。與1992年版GMP相比,新修訂的1998年版GMP最大的變化和最顯著的特征是增加了設備驗證且將驗證的內容作為一章單獨列出,可見其在生產質量管理中的重要意義[3]。驗證工作沒做好,可能會導致生產工藝與實際不符,甚至生產出不合格的產品。企業應成立專職的驗證機構;完善所有的驗證文件,至少應包括驗證總計劃、驗證工作階段實施方案、驗證報告、驗證工作總結,其中驗證報告中應包含安裝確認方案最初和最終批準文件、安裝確認方案、運行確認方案、產品驗證、清洗驗證、檢驗驗證和驗證合格證書等諸多內容,以及上述文件的起草、審核、批準、實施的具體細節、步驟和分工,再驗證的周期等;所有的文件整體應歸檔,使之具有可追溯性。
2.4 完善文件管理體系
文件的質量反映一個企業的管理水平,且文件管理涉及到GMP的各個方面。文件管理的目的是界定管理系統,減少語言傳遞可能發生的錯誤,保證所有執行人員均能獲得有關工藝的詳細指令并遵照執行,而且能夠對有缺陷或疑有缺陷產品的歷史進行追查。GMP要求的各種文件包括標簽、規格標準和檢驗方法、主處方、生產指令、包裝指令、批生產記錄、批包裝記錄、標準操作規程等。因此,文件是貫穿整個生產過程的重要管理體系。
2.5 健全人員培訓管理體系
人是質量管理的主體,人員的素質對質量管理體系的運行具有極為重要的影響[2]。人員培訓是實施GMP的首要要素之一,人員培訓應落實到生產、質量、物料、維護等所有崗位的管理人員和操作人員。制藥企業應健全人員培訓管理體系,根據不同崗位需求,制訂切實可行的培訓內容、培訓計劃,建立培訓制度,培訓的效果應經過考核評估,符合要求才能正式上崗。同時,管理層應提供充足的資源和資金,并監督培訓的效果。
3 結語
在廣大制藥企業和藥品監督管理部門共同努力下,我國的藥品均在通過GMP認證的條件下生產,產品的質量有了飛躍性提高。但我國制藥企業GMP實施中仍有不少問題亟需解決,特別在新版GMP即將發布之際,必須學習先進質量管理理念,應用有效的質量管理手段,不斷提升自身的生產質量管理水平,提高實施GMP的水平,有效保證產品的質量。
[1]劉正午;GMP新標準:嚴重缺陷不予通過[N];醫藥經濟報,2007-11-14(001);
[2]鄧海根;制藥企業GMP管理實用指南[M];北京:中國升量出版社,2000:50-81;
[3]吳俊;如何過好GMP設備驗證關[N];中國醫藥報,2003-01-21 (003);
R954
A
1006-4931(2010)18-0009-02
江映珠(1968-),本科,副主任藥師,研究方向為藥品GMP認證管理,(電子信箱)jiangyingzhu@gdda;gov;cn。
2010-06-28)