C3胞外酶抑制緩激肽誘導的血腫瘤屏障通透性的增加
馬騰,劉嘯白,薛一雪
(中國醫科大學 1.基礎醫學院神經生物學教研室;2.第96期臨床醫學7年制,沈陽 110001)
C3胞外酶抑制緩激肽誘導的血腫瘤屏障通透性的增加
馬騰1,劉嘯白2,薛一雪1
(中國醫科大學 1.基礎醫學院神經生物學教研室;2.第96期臨床醫學7年制,沈陽 110001)
目的研究Ras基因家族成員A(RhoA)的特異性抑制劑C3胞外酶(exoenzyme)對緩激肽誘導的血腫瘤屏障通透性的作用。方法 應用C3exoenzyme預處理大鼠原代腦微血管內皮細胞后,測量跨內皮阻抗值(TEER)、辣根過氧化物酶(HRP)流量,分析血腫瘤屏障的通透性的改變;應用Western blot檢測緊密連接相關蛋白(ZO-1)的表達;應用免疫熒光法觀察原代大鼠腦微血管內皮細胞緊密連接相關蛋白ZO-1和絲狀肌動蛋白(F-actin)結構和分布的改變。結果 C3exoenzyme顯著抑制緩激肽誘導TEER值的降低、HRP流量的升高及ZO-1的表達,抑制ZO-1由內皮細胞的邊緣向細胞質轉移,抑制絲狀肌動蛋白由細胞膜邊緣向細胞中央區分布,分布于細胞邊緣的F-actin明顯增加,應力纖維形成明顯減少。結論RhoA能夠介導緩激肽開放血腫瘤屏障。
RhoA;緩激肽;血腫瘤屏障;緊密連接;ZO-1;肌動蛋白重排
治療藥物進入腦組織發揮作用必須通過由緊密連接(tight junction,TJ)為主要構成成分的血腦屏障(blood-brain barrier,BBB)[1]。雖然腫瘤血管與正常血管相比有不同的結構和功能特征,但同樣存在血腫瘤屏障(blood-tumor barrier,BTB),能阻止大部分抗癌藥物通過BTB進入腫瘤組織[2]。研究顯示,如果腫瘤組織的藥物濃度提高2倍,其治療效應則增加10倍[3]。因此增強藥物的轉運,提高到達治療部位的藥物濃度是提高治療效果的關鍵因素。我們的前期工作證明了緩激肽(bradykinine,BK)可以選擇性開放BTB[4],但其具體機制仍不十分清楚。
研究顯示,在凝血酶介導內皮細胞屏障功能損壞的過程中,伴隨著環腺苷酸(cyclic adenosine monophosphate,cAMP)表達的快速下降和Ras基因家族成員A(Rashomolog gene family member A,RhoA)激活[5]。同樣,我們的前期工作證實了cAMP和蛋白激酶A(protein kinase A,PKA)催化亞單位(PKAcs)在BK開放BTB過程中呈低表達[6],提示低表達PKA有助于RhoA的激活[7]。有學者認為,RhoA高表達使內皮細胞中絲狀肌動蛋白(filamentous actin,F-actin)聚集成束,變成應力纖維,且其分布由原來的細胞膜邊緣區域變成細胞質的中央區域,并使血管內皮細胞鈣黏蛋白(VE-cadherin)和緊密連接相關蛋白occludin重分布,造成內皮間的通透性升高[8]。因此我們推測RhoA可能參與BK開放BTB調節過程,擬通過本研究探討RhoA的特異性抑制劑C3胞外酶(exoenzyme)對緩激肽誘導的血腫瘤屏障通透性的作用。
1 材料與方法
1.1 材料
NU血清(BD Biosciences公司);FBS(杭州四季青公司);DMEM細胞培養基(Gibco公司);zonula occludens-1(ZO-1)抗體(Zymed公司);抗 β-actin抗體(Santa Cruz公司);羊抗兔辣根過氧化物酶標記的IgG二抗(北京中山生物技術公司);phalloidin-TRITC熒光抗體,RhoA特異性抑制劑肉毒梭菌C3胞外酶,緩激肽,辣根過氧化物酶(horseradish peroxidase,HRP)(Sigma公司)。
1.2 方法
1.2.1 腦微血管內皮細胞的培養和體外BTB模型的制作:用CO2吸入法處死<1周的胎大鼠,開顱取全腦,去除腦膜。提取大鼠腦微血管內皮細胞(rat brain microvascular endothelial cells,RBMECs) 及建立體外BTB模型的方法參照文獻[6]。首先,大鼠C6膠質瘤細胞經胰酶消化后,將106個細胞種植在膠原包被的Transwell小室的下層,并加入適宜的培養基。2h后翻轉小室,加入新鮮培養基。當細胞融合至80%時,將RBMECs接種至Transwell小室的上室(大約105個細胞)。細胞在共培養7~10d后融合。從此,每2d更換1次培養基。在共培養7~10d后,加入藥物進行后續實驗。
1.2.2 BK及抑制劑的作用和分組:我們的前期研究發現,BK(1μmol/L)處理 RBMECs 15min 時,BTB的通透性達到峰值,以后逐漸恢復。緊密連接相關蛋白ZO-1是RhoA的下游分子,因此我們將RBMECs隨機分為7組(每組8例,每組BK終濃度為1μmol/L):BK 0min 組、5min 組、10min 組、15min組、30min組和15min+C3exoenzyme組、對照組(無C6細胞共培養的RBMECs單層,加入等量的1μmol/L無菌生理鹽水作用15min)。取C3exoenzyme(50μg/ml)加入 BK 15min 組 Transwell小室的上室培養基中,作用4h后移去上室的所有培養基,加 BK(1μmol/L)至上室。
1.2.3 HRP流量測定:將Transwell中與C6細胞共培養的和單獨培養的RBMECs分別轉移至1個新的24孔板中。將含有0.5μmol/L HRP的無血清DMEM培養基加入Transwell小室的上室中。在經過BK作用后的特定時間點上,收集下室的培養基,通過色度法測量樣品中HRP的含量。HRP流量用通過每平方厘米表面積的皮摩爾數(pmol/cm2)表示。
1.2.4 Western blot檢測緊密連接相關蛋白的表達和分布:當Transwell小室的上室的細胞生長至融合時,用含有0.1mmol/L EDTA(不含鈣、鎂離子)的PBS沖洗,細胞鏟小心刮取細胞,倒入1ml裂解液A (2mmol/L EDTA,10mmol/L EGTA,0.4%NaF,20mmol/L Tris-HCl,protease inhibitor cocktail,PMSF,1%Triton X-100,pH 7.5),4℃勻漿,離心,上清液為蛋白樣品液。加入抗ZO-1抗體(1︰500),抗β-actin抗體(1︰800),4℃孵育過夜,在羊抗兔辣根過氧化物酶標記的IgG二抗中室溫孵育1h,ECL化學發光,X線片曝光、顯像,所得膠片用Chemi Imager 5500V2.0軟件掃描,通過Fluor Chen 2.0軟件進行定量分析,測得光密度值(integrated density value,IDV)。
1.2.5 免疫熒光法觀察緊密連接相關蛋白和細胞骨架蛋白的表達和分布:將生長在蓋玻片上RBMECs單層用4%多聚甲醛固定,0.5%TritonX-100透化,5%BSA封閉。間接免疫熒光技術步驟進行操作,ZO-1抗體稀釋濃度1︰150,陰性對照用0.01mol/L PBS代替一抗,應用FITC標記的熒光二抗 (1︰150),避光條件下染色,甘油封片,熒光顯微鏡觀察,采集圖像。直接免疫熒光技術步驟進行操作,phalloidin-TRITC熒光抗體(1︰200)孵育2h,熒光顯微鏡觀察。
1.3 統計學分析
2 結果
2.1 C3exoenzyme抑制BK介導BTB通透性的增加
HRP流量測定結果顯示,BK以時間依賴性方式顯著增加HRP流量,BK 15min組HRP流量顯著高于對照組和BK 0min組(P<0.05),但BK 15min+C3exoenzyme組HRP流量較BK 15min組顯著降低(P<0.05)。見圖 1。
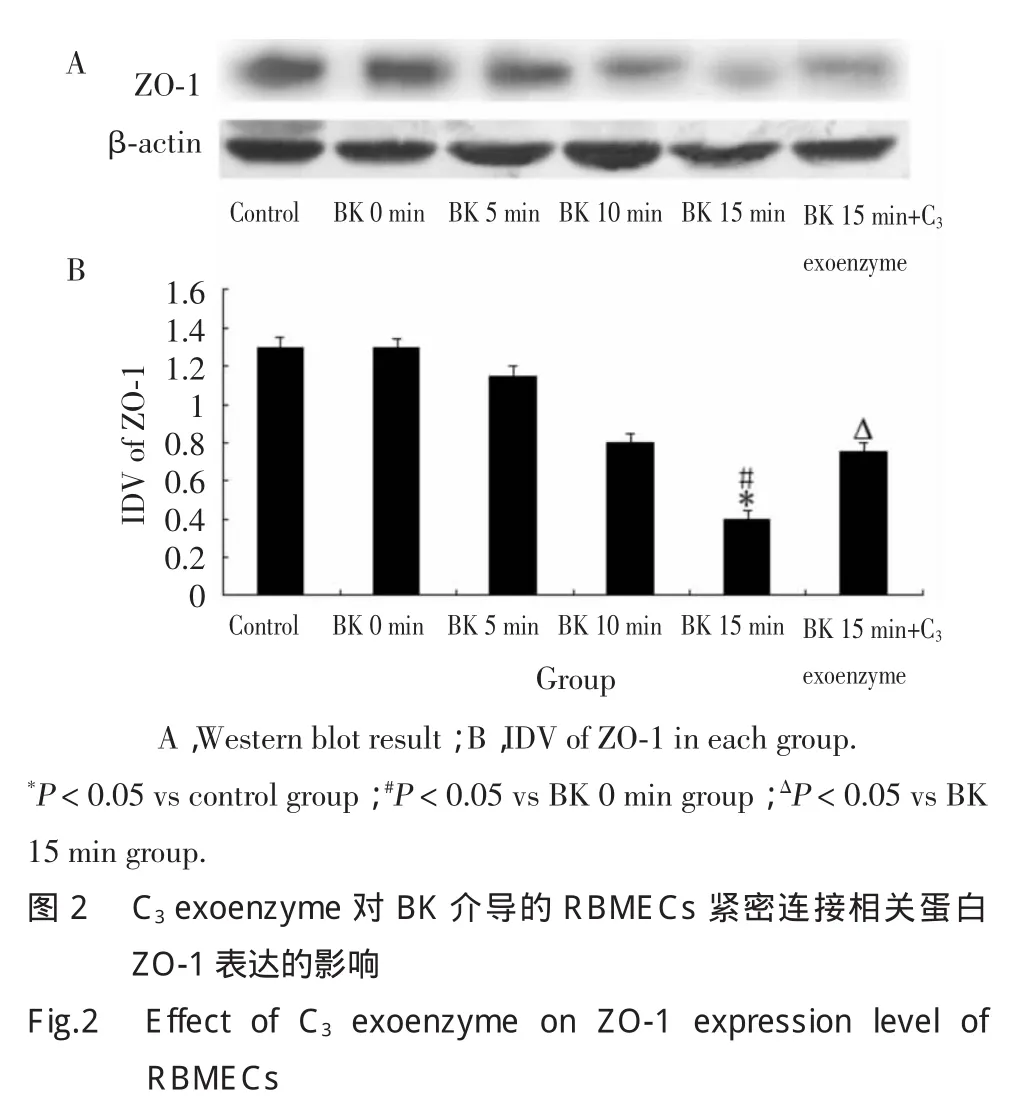
2.2 C3exoenzyme抑制BK介導RBMECs的緊密連接相關蛋白ZO-1表達減少

Western blot結果顯示,BK作用5min開始,ZO-1表達逐漸降低。BK 15min組ZO-1表達量顯著低于對照組和BK 0min組(P<0.05),但BK 15min+C3exoenzyme組ZO-1表達量較BK 15min組ZO-1表達量顯著升高(P<0.05)。見圖2。
2.3 C3exoenzyme抑制BK介導的RBMECs緊密連接相關蛋白ZO-1的重分布及細胞骨架F-actin的重排
免疫熒光分析顯示,在未處理的細胞中,ZO-1位于內皮細胞邊緣,呈連續分布,ZO-1在細胞核中有表達(圖3A)。BK處理后,ZO-1的分布由連續狀態變為不連續,由內皮細胞的邊緣向細胞質轉移(圖3B)。C3exoenzyme預處理后,ZO-1部分恢復連續分布狀態,ZO-1由內皮細胞邊緣向細胞質的轉移明顯減少(圖3C)。BK作用前,F-actin呈環狀連續分布于RBMECs的邊緣,未見應力纖維(圖3D)。BK作用后,分布于細胞邊緣的F-actin減少,應力纖維形成增加,且分布在細胞中央區(圖3E)。C3exoenzyme預處理后,分布于細胞邊緣的F-actin明顯增加,應力纖維形成明顯減少(圖3F)。

3 討論
本研究中,HRP流量實驗結果顯示,BK作用后HRP流量顯著增加,與Easton等[9]的研究結果一致。本研究進一步發現,應用RhoA特異性抑制劑C3exoenzyme預處理后,BTB的通透性顯著升高,證明RhoA信號通路參與調節BK介導的BTB通透性增加的過程。
胞質附著蛋白Zonula occludens家族中的ZO-1同樣是構成TJ的一個主要蛋白[10]。作為連接跨膜蛋白occludin和claudin-5與細胞骨架蛋白F-actin的橋梁蛋白,ZO-1的分布和表達的變化同樣影響TJ的結構和功能[11]。本研究發現,BK作用后,ZO-1表達顯著下降,C3exoenzyme預處理后,ZO-1表達量則顯著升高,說明RhoA信號通路參與BK介導的TJ開放。
最近的研究顯示,F-actin在緊密連接復合物的結構支撐和功能調節方面都發揮著重要的作用[12]。為了進一步明確RhoA信號通路,與細胞骨架重排、緊密連接相關蛋白重分布、BTB通透性增高的關系,我們采用C3exoenzyme預處理后,應用免疫熒光技術觀察細胞骨架重排,緊密連接相關蛋白重分布的變化,明確RhoA信號通路與細胞骨架重排、緊密連接相關蛋白重分布的關系。細胞骨架有絲狀肌動蛋白、中間纖維和微管3種組成成分,其中F-actin與內皮細胞的通透性的關系最為密切,在某些生理和病理條件下,F-actin聚集成束,變成應力纖維,使細胞收縮。Birukova等[13]研究證實,RhoA具有激發應力纖維形成,引起內皮細胞通透性增高的作用。本研究發現,BK作用后,ZO-1重新分布,由細胞膜及細胞邊緣向細胞質轉移,同時F-actin由環狀連續分布于RBMECs的邊緣向細胞質中發生分布轉移,同時伴有大量應力纖維形成。應力纖維收縮,牽拉ZO-1蛋白,使細胞膜上跨膜蛋白重分布,緊密連接結構變化,使BTB通透性升高。C3exoenzyme抑制了ZO-1的重分布、F-actin的重排和應力纖維的形成。說明RhoA信號通路參與了BK介導的細胞骨架重排,緊密連接相關蛋白重分布,BTB通透性增高的過程。
[1]Siegal T,Zylber-Katz E.Strategies for increasing drug delivery to the brain:focus on brain lymphoma [J].Clin Pharmacokinet,2002,41(3):171-186.
[2]Erdlenbruch B,Schinkhof C,Kugler W,et al.Intracarotid administration of short-chain alkylglycerols for increased delivery of methotrexate to the rat brain [J].Br J Pharmacol,2003,139(4):685-694.
[3]Samoto K,Perng GC,Ehtesham M,et al.A herpes simplex virus type 1mutant deleted for gamma 34.5and LAT kills glioma cells in vitro and is inhibited for in vivo reactivation [J].Cancer Gene Ther,2001,8(4):269-277.
[4]劉麗波,薛一雪,王萍.緩激肽對腦膠質瘤大鼠occludin和ZO-1mRNA 的調節和機制[J].中國醫科大學學報,2010,39(7):497-500.
[5]Baumer Y,Spindler V,Werthmann RC,et al.Role of Rac 1and cAMP in endothelial barrier stabilization and thrombin-induced barrier breakdown[J].J Cell Physiol,2009,220(3):716-726.
[6]Liu LB,Xue YX,Liu YH,et al.Bradykinin increases blood-tumor barrier permeability by down-regulating the expression levels of ZO-1,occludin,and claudin-5and rearranging actin cytoskeleton [J].J Neurosci Res,2008,86(5):1153-1168.
[7]Meiri D,Greeve MA,Brunet A,et al.Modulation of Rho guanine exchange factor Lfc activity by protein kinase A-mediated phosphorylation[J].Mol Cell Biol,2009,29(21):5963-5973.
[8]Li B,Zhao WD,Tan ZM,et al.Involvement of Rho/ROCK signalling in small cell lung cancer migration through human brain microvascular endothelial cells[J].FEBS Lett,2006,580(17):4252-4260.
[9]Easton AS,Abbott NJ.Bradykinin increases permeability by calcium and 5-lipoxygenase in the ECV304/C6cell culture model of the blood-brain barrier[J].Brain Res,2002,953(1-2):157-169.
[10]Nakagawa S,Deli MA,Kawaguchi H,et al.A new blood-brain barrier model using primary rat brain endothelial cells,pericytes and astrocytes[J].Neurochem Int,2009,54(3-4):253-263.
[11]Hopkins AM,Walsh SV,Verkade P,et al.Constitutive activation of
Rho proteins by CNF-1influences tight junction structure and ep
ithelial barrier function[J].J Cell Sci,2003,116(Pt 4):725-742.[12]Dudek SM,Garcia JG.Cytoskeletal regulation of pulmonary vascular permeability[J].J Appl Physiol,2001,91(4):1487-1500.
[13]Birukova AA,Smurova K,Birukov KG,et al.Role of Rho GTPases in thrombin-induced lung vascular endothelial cells barrier dysfunction[J].Microvasc Res,2004,67(1):64-77.
(編輯王又冬,英文編輯王又冬)
C3Exoenzyme Inhibits Bradykinin-induced Selective Increase of the Permeability of Blood-tumor Barrier
MA Teng1,LIU Xiao-bai2,XUE Yi-xue1
(1.Department of Neurobiology,College of Basic Medical Sciences,China Medical University,Shenyang 110001,China;2.The 96th Class,7-year Program,Clinical Medicine,China Medical University,Shenyang 110001,China)
ObjectiveTo investigate the effect of C3exoenzyme,a specificRashomolog gene family member A (RhoA)inhibitor,on bradykinin(BK)-induced increase in blood-tumor barrier (BTB)permeability.MethodsRat brain microvascular endothelail cells(RBMECs)were pretreated with C3exoenzyme and then treated with BK for 15minutes.Horseradish peroxidase (HRP)flux and TEER assays were employed to reveal BTB permeability.The protein expression level of ZO-1was observed by Western blot.The stress fiber formation and distribution of filamentous actin (F-actin)and ZO-1were assessed by immunofluorescence microscopy.ResultsC3exoenzyme could partially inhibit endothelial leakage and restored normal TEER values in RBMECs.The expression level of ZO-1protein decreased significantly and it was prevented by C3exoenzyme.C3exoenzyme inhibited BK-induced relocation of ZO-1from cellular borders into the cytoplasm as well as stress fiber formation in RBMECs.ConclusionRhoA plays a key role in BK-induced openning of blood-tumor barrier.
RhoA;bradykinin;blood-tumor barrier;tight junction;ZO-1;actin rearrangement
R338.2
A
0258-4646(2011)02-0097-04
doiCNKI:21-1227/R.20110212.0957.029
國家自然科學基金資助項目(30872656,30670723,30973079);高等學校博士學科點專項科研基金資助項目(20092104110015);沈陽市科學技術計劃項目(1072033-1-00,1081266-9-00)
馬騰(1976-),男,講師,博士.
薛一雪,E-mail:xueyxiue888@yahoo.com.cn
2010-11-11

