雙抗體夾心ELISA檢測人胎兒血紅蛋白體系的建立
李雪麗,文李艷,馮善偉,鐘 梅,劉艷君*,富 寧
(1.南方醫科大學基礎醫學院 免疫教研室,廣東 廣州 510515;2.廣州市人口和計劃生育科學研究所,廣東 廣州 510410;3.南方醫科大學 南方醫院,廣東 廣州 510515)
胎兒血紅蛋白(Fetal Hemoglobin,Hb F)由2條α鏈和2條γ鏈組成,出生時約占血紅蛋白總量的70%,然后快速減少,6-12個月后濃度小于2%,到成年時降至血紅蛋白總量的1%以下。在許多血液系統疾病尤其是β地中海貧血的篩查中,檢測Hb F是一項不可或缺的指標[1]。在某些惡性腫瘤中,Hb F可作為腫瘤標記物預示腫瘤的發生發展[2]。在產科疾病中,檢測HbF可以快速判定胎兒向母體出血等疾病[3]。目前檢測Hb F多采用蛋白質電泳、抗酸染色和堿變性法,這些方法靈敏度比較低,而靈敏度和準確度較高的高效液相色譜法價格昂貴,不適合大規模篩查[4]。本研究利用自制的抗人Hb F單克隆抗體和兔抗人Hb F多克隆抗體,建立了HbF的單多抗夾心ELISA檢測體系。
1 材料與方法
1.1 材料
1.1.1 主要試劑 抗人HbF單抗2C8、多抗均由本室自制[5],HRP-羊抗兔IgG為北京鼎國生物公司產品;BSA購自廣州斯佳生物技術公司。自行配制以下試劑:紅細胞裂解液(Tris-NH4Cl)包被液系0.05 M 碳酸鹽緩沖液(CB,p H9.6)、ELISA 封閉液(5%脫脂奶粉,用洗液配制)、洗液(50m MTris,0.14 M NaCl,0.1%Tween-20,p H8.0)、樣品稀釋液(50 m M Tris,0.14 M NaCl,1%BSA,0.05%Tween-20,p H8.0)、TMB底物液(臨用前 A、B液等體積混勻)、2M H2SO4終止液均自行配制。
1.1.2 主要儀器 多功能酶標儀Perkin Elmer wallac1420;自動洗板機購自美國BIO-RAD公司;37℃數顯三用恒溫水浴箱,購自金壇市醫療儀器廠。
1.1.3 血液樣本 臍帶血取自南方醫院產前診斷中心,標準品為本實驗室工作人員的全血標本;100份血標本取自廣州市人口和計劃生育科學研究所,以上標本均用高效液相色譜法測定其 含量,于-70℃保存。
1.2 方法
1.2.1 樣品及標準品的制備 用本室工作人員的全血標本作為標準品,對該份標本用高效液相色譜法測定Hb F的含量(百分比),五分類血球儀測定總血紅蛋白(Hb),分裝并保存于-20℃。取一定體積的標準品或待測血樣品,加入9倍體積的Tris-NH4Cl裂解,37℃水浴30 min,加入10×樣品稀釋液,8 000 rpm離心5 min,取裂解液上清用樣品稀釋液稀釋一定的比例。
1.2.2 檢測HbF雙抗體夾心ELISA方法的建立用0.05 M CB(p H 9.6)稀釋捕獲抗體2C8至10 μg/ml,每孔100μl包被,4℃過夜;次日洗液洗滌3遍后,每孔加入5%脫脂奶粉封閉液300μl,37℃2 h;洗滌5遍后,每孔加入100μl標準品及待測樣品,于37℃孵育30 min;洗滌5遍后,加入兔抗人Hb F多抗10μg/ml,100μl/孔,37℃30 min;洗滌5遍后每孔加入100μl HRP-羊抗兔IgG(1∶5000),37℃30 min;充分洗滌后加入TMB底物液,常規顯色,2MH2SO4終止反應,以波長450 nm測定OD值。以Hb F濃度作為自變量,OD450作為應變量,進行曲線擬合,繪制標準曲線。
1.2.3 100份血標本的檢測 用自行建立的Hb F檢測體系測定100份全血標本的HbF濃度,每份血標本設立雙復孔測定。結果用SPSS13.0進行統計分析。
2 結果
2.1 標準品測定 經測定標準品Hb為137 g/L,Hb F含量為1%。將其裂解后分別稀釋為24.66、4.932、0.986、0.197、0.039μg/ml,作為本檢測體系標準曲線的五個測定點。
2.2 確定捕獲抗體2C8的最佳工作濃度 在檢測抗體濃度為5μg/ml時,用不同濃度的2C8抗體包被,進行夾心ELISA檢測臍血中Hb F的濃度。結果如圖1,當單抗的包被濃度為10μg/ml時,ELISA測定的吸光度值最高,因此,單抗的包被濃度選擇為10μg/ml。
2.3 確定檢測抗體的最佳工作濃度 在單抗包被濃度為10μg/ml的條件下,用不同濃度的兔抗Hb F多抗檢測臍血中Hb F的濃度,比較其檢測效果。結果如圖2,當多抗濃度為10μg/ml,吸光度值較高且與15μg/ml效果相仿,因此,檢測抗體的濃度選擇為10μg/ml。

圖1 抗HbF單抗2C8不同包被濃度的檢測效果比較

圖2 兔抗HbF多抗不同濃度檢測效果的比較
2.4 標準曲線的建立 標準品裂解后稀釋至相應濃度,進行ELISA測定。通過抗原濃度的自然對數Ln(X)與OD450值繪制標準曲線圖。結果如圖3,標準曲線的回歸方程Y=0.1017Ln(X)+0.5472,r2=0.9986.線性范圍在0.039-24.66μg/m之間,能夠滿足臨床血標本檢測的需要。

圖3 HbF濃度的自然對數Ln(X)與OD450值關系圖
2.5 可重復性測定
2.5.1 標準曲線的可重復性 分別比較6次實驗中標準曲線Y軸90%、50%、10%各點所代表的Hb F濃度,其變異系數見表1。結果可見,3個OD450點所代表的濃度值的變異系數均小于15%,說明標準曲線的可重復性較好。

表1 標準曲線的可重復性測定(n=6)
2.5.2 批內、批間差異測定 取3份含不同Hb F濃度的全血標本,與標準曲線同時測定,每次實驗每種濃度進行6次重復測定(每次測定設立2復孔,取其平均值為一個實驗數據,即每種濃度同時做12孔),反復進行6次重復實驗,計算批間批內變異系數,結果見表2、3。本體系批內平均變異系數6.6%,批間平均變異系數6.4%,說明本檢測體系的可重復性好。

表2 HbF檢測實驗批內可重復性測定(n=6)

表3 HbF檢測實驗批間可重復性測定(n=6)
2.6 100份血標本的HbF含量檢測結果 100份血標本的ELISA結果與高效液相色譜法結果比較如表4,以HbF占總血紅蛋白的1%作為臨界值,ELISA結果與高效液相色譜法符合率為89%,經χ2檢驗,兩種檢驗方法之間無統計學差異(χ2=0.216,P>0.05)。
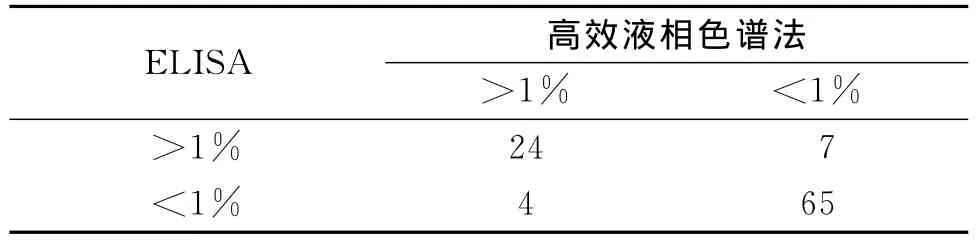
表4 100份血標本測定的卡方檢驗表格
3 討論
本研究利用自行制備的抗人HbF單抗和多抗成功地建立了人Hb F檢測體系。在前期單抗的制備和鑒定中,我們用ELISA、Western blot證明了包被抗體2C8只與Hb F發生特異性結合,與其他兩種血紅蛋白(Hb A、Hb A2)無交叉反應[5],本體系采用單抗作為捕獲抗體,保證了檢測的特異性。在包被單抗已特異地捕獲抗原的基礎上,多抗與抗原結合的位點和機會都大于單抗,因此,以多抗作為檢測抗體,又能保證檢測的靈敏度[6]。由于血標本中Hb F的含量并不會很低,因此本體系更偏重于考慮標準曲線的線性關系和檢測的特異性,同時,略低的靈敏度也可避免樣品稀釋倍數過高而造成的誤差和不便。本研究結果顯示,Hb F的檢測靈敏度為0.039μg/ml,標準曲線的擬合系數達到0.9986,線性關系好,批內變異系數小于10%,批間變異系數小于15%,重復性較好。
Hb F的γ鏈有兩種類型:Gγ和Aγ,二者的差別僅為一個氨基酸不同,Gγ136位為甘氨酸,Aγ為丙氨酸。胎兒出生時Hb F含量為總血紅蛋白的80%,Gγ占 Hb F的比例為70%,Aγ占30%[7]。至兒童和成人,Gγ占Hb F的比例下降至40-60%。本科室制備的抗Hb F抗體,是用臍血免疫的,前期工作中嘗試過以臍血作為標準品,但由于臍血中兩種γ鏈比例與成人不同[8],臍血與正常人血檢測結果存在一定差異。因預期臨床樣本均來自兒童或成人,為使標準品與檢測標本一致,我們選擇正常人全血標本作為標準品。在檢測Hb F的方法中,高效液相色譜法的準確性最高[4],因此,標準品的定值采用的是高效液相色譜法。在實驗中,我們發現血液標本的凍融次數對于紅細胞裂解有一定影響。為保證結果的一致性,標準品和檢測標本的凍融次數盡量一致,而在裂解之后加入10×樣品緩沖液,既能終止Tris-NH4Cl的裂解,又可使各個濃度梯度的樣品處于相同的緩沖條件中。
應用自行建立的ELISA檢測了100份血標本,所測值與高效液相色譜法的結果比較,以HbF 1%作為臨界值,發現兩種方法的符合率約為89%,雖然比較兩種方法測定的絕對值,符合率只有40%,但這種差異對于臨床以1%為臨界值判斷Hb F的病理水平并無影響,因此,本ELISA方法可在一定程度上代替高效液相色譜法,更廣譜、低廉地應用于臨床和基礎研究。
Hb F在許多血液系統疾病中都表現為升高,包括地中海貧血、鐮刀型細胞貧血、遺傳性Hb F持續增多癥、骨髓異常增生等疾病[9]。而早在上世紀七十年代人們就開始注意到惡性腫瘤Hb F表達量的增加,現已證明許多惡性腫瘤尤其是胚胎惡性腫瘤,血液系統腫瘤和大腸癌,其 表達量呈明顯增加[10]。因此,Hb F的定量檢測對于這些疾病的診斷和預防發揮著越來越大的作用。目前,國外商品化試劑盒多采用雙多抗夾心ELISA,特異性稍差,且為進口試劑盒,價格昂貴[4]。本實驗所建立的單多抗ELISA檢測體系特異性強,重復性好,有望應用于以后的臨床檢測和基礎研究。
[1]Jerusalem,Israel.Flow cytometric analysis of fetal hemoglobin in erythroid precursors of b-thalassemia[J].Clin Lab Haem,2004,26:187.
[2]M Wolk,JE Martin and M Nowicki.Foetal haemoglobin-blood cells(F-cells)as a feature of embryonic tumours(blastomas)[J].British Journal of Cancer,2007,97,412.
[3]Pelle G,Lindqvist,Peter Gren.An easy-to-use method for detecting fetal hemoglobin-A test to identify bleeding from vasa previa[J].European Journal of Obstetrics & Gynecology and Reproductive Biology,2007,131(2):151.
[4]程 偉,富 寧.人胎兒血紅蛋白的檢測及其臨床意義[J].中國實驗診斷學,2009,(10).
[5]程 偉,劉艷君,陳遠東,鐘 梅,富 寧.抗胎兒血紅蛋白單克隆抗體的制備及特性鑒定[J].中國實驗診斷學,2009,(02).
[6]江海燕,劉艷君,朱 平,韓強濤,富 寧.人可溶性CD14檢測體系的建立[J].中國實驗診斷學,2004,(01).
[7]Wajcman H,Galactéros F,Hanichi A,Yapo A,Préhu C.Hb F in the adult:could its composition discriminate normal from abnormal foetal globin gene expression?[J].C R Acad SciⅢ,2000 Nov;323(11):975.
[8]Urszula Wojda,Pierre Noel and Jeffery L.Miller.Fetal and adult hemoglobin production during adult erythropoiesis:coordinate expression correlates with cell proliferation[J].Blood,2002,99:3005.
[9]Atweh GF,Desimone J,Saunthararajha Y,Fathallah H,Weinberg RS,Nagel RL,Farby ME,Adams RJ.Hemoglobinopathies[J].Hematology(Am Soc Hematol Educ Program),2003,14.
[10]Wolk M,Martin JE.Fetal haemoglobin(Hb F)as an immunohistochemical tumour marker in bone marrow and spleen.J Clin Pathol.2011 Jul;64(7):645.

