真菌殼聚糖的研究進展
王偉平,陳德容,杜予民
(1.湖北工業大學 發酵工程省部共建教育部重點實驗室,湖北 武漢 430068;2.武漢大學資源與環境科學學院,湖北 武漢 430072)
殼聚糖(Chitosan)是甲殼素的部分脫乙酰產物,也天然存在于一些真菌的細胞壁中,是自然界唯一大量存在的堿性多糖,具有陽離子聚電解質性和多功能基團反應性,易于化學修飾,安全無毒,具生物相容性和生物降解性[1,2],在工業、醫學、生物學等領域得到了深入的研究和廣泛的應用[3~8]。隨著人們對殼聚糖及其衍生物應用研究的逐漸深入,對殼聚糖及其制品的需求大幅度增長。
市售殼聚糖是由甲殼素經強堿熱解法脫乙酰制備,而甲殼素利用蝦、蟹等的外殼采用化學法生產,這種生產方法原料來源受限制、產品性能不穩定、環境污染嚴重。因此,人們對采用真菌培養法直接生產殼聚糖進行了系列研究。作者在此綜述了國內外真菌殼聚糖的合成機理、菌種選育、發酵工藝優化及提取方法等方面的研究進展。
1 合成機理
殼聚糖在真菌體內的生物合成與其它多糖一樣,是一個相當復雜的生物化學過程。Davis 等[9]在研究魯氏毛霉(Mucorrouxii)合成殼聚糖的機理時發現,該菌中存在著甲殼素合成酶(CS)和甲殼素脫乙酰酶(CDA),首先通過CS催化細胞中存在的氨基糖核苷酸即尿苷二磷酸-N-乙酰-D-葡糖胺(UDP-GlcNAc)轉變成N-乙酰-D-葡糖胺即甲殼素,甲殼素通過CDA脫去乙酰基,形成殼聚糖。此類菌體中不僅存在甲殼素,也存在殼聚糖,真菌殼聚糖由兩種酶——CS和CDA縱向作用才能合成,二者缺一不可,CS和CDA的活性強弱決定著殼聚糖合成量的多少,UDP-GlcNAc是甲殼素和殼聚糖合成的共同底物;合成速率不單由菌體內源庫大小決定,添加外源物如N-乙基-D-葡糖胺可改變合成速率、自由N-乙酰-D-葡糖胺和蛋白酶能促進合成,該合成必需Mg2+或Mn2+存在,但受多氧菌素D抑制。Gamow等[10]報道,甲殼素最初的脫乙酰作用是在一種特殊的酶促進下,甲殼素鏈更易和胞外的脫乙酰酶作用。對此,Kafeotzopoulos等[11]認為:甲殼素分子剛形成時,分子間未完全鍵合,CDA易接近新生甲殼素分子的乙酰基團而起作用;一旦甲殼素結晶成微纖維狀,CDA難進入分子內部,故難以脫除乙酰基。CDA對未成熟的剛形成的甲殼素有脫乙酰作用,對已形成的甲殼素(無論是膠質還是粉末)的活性則很低,因此殼聚糖能被散布在細胞表面的甲殼素合成酶在甲殼素鏈結晶化以前優先合成,細胞壁中殼聚糖和甲殼素的比例由到達細胞表面的CS的多少決定。
Domek等[12]研究表明Mucorracemosus有酵母態和菌絲態兩種形態,二者化學成分相似,但菌絲態甲殼素和殼聚糖產量是酵母態的3倍。呈菌絲態時,幾丁質和殼聚糖處于絲狀真菌細胞壁最內層,臨近質膜,呈放射狀,是真菌菌絲尖端延長部位的主要組分,幾丁質與殼聚糖的生成與真菌菌絲的生長關系密切,絲狀真菌生長在菌絲體頂端動態延伸[13],這被認為是由于合成胞囊的合成酶包含在頂端細胞原生質膜上的細胞壁內所導致的[14]。呈酵母態時,細胞壁化合物在整個細胞壁外均勻分布,導致球體形態。據推測,酵母態細胞原生質膜合成胞囊不像菌絲態受特殊位點的限制。Duran等[15]認為,在酵母態,甲殼素合成酶以不活躍酶原形式均勻存在于原生質膜中,由蛋白酶將受限制的酶原帶到胞囊的特殊位點導致甲殼素沉積。因此,可以通過提高菌絲態菌絲體的產量或菌絲體中殼聚糖的產率來實現殼聚糖產量的增長[16]。
2 菌種選育
2.1 菌種篩選
不同菌綱真菌細胞壁多糖的主要成分不一樣,具體見表1。
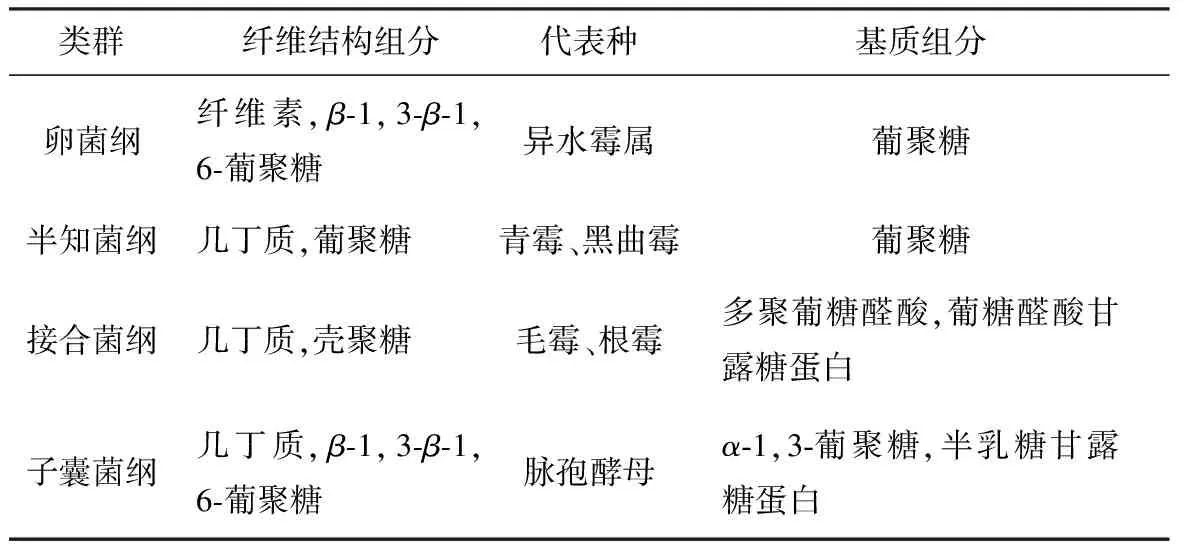
表1 真菌細胞壁多糖的主要成分
由表1可知,接合菌綱真菌是細胞壁含有甲殼素和殼聚糖的典型。其中毛霉目包含種類最多、形態最多樣化,代表種為毛霉屬(Mucor)、根霉屬(Rhizopus)和犁頭霉屬(Absidia)。真菌殼聚糖的研究主要集中在這三種菌。也有報道從半知菌綱黑曲霉和青霉菌絲體中提取殼聚糖,但黑曲霉和青霉細胞壁只含甲殼素、不含殼聚糖,所得殼聚糖仍由甲殼素經強堿或酶法[17]脫乙酰得到。
不同真菌殼聚糖的菌產量和產率不同,分子量和脫乙酰度等理化特性差異也很大。Wu等[18]利用酵母膏蛋白胨葡萄糖(YPD)培養基液態發酵比較了黑曲霉(Aspergillusniger)和魯氏毛霉(Mucorrouxii)產殼聚糖的能力,證實Aspergillusniger不產殼聚糖,Mucorrouxii的殼聚糖產率為12.49%,乙酰化程度為19.5%,結晶度比蝦殼殼聚糖低。Amorim等[19]利用YPD培養基液態發酵比較了Mucorracemosus和Cunninghamellaelegans產殼聚糖的能力,發現M.racemosus的殼聚糖產量比C.elegans高40%;培養100 h,菌體干重分別達到25 g·L-1和15 g·L-1,殼聚糖產率分別為3.5%和2.0%,DD分別為51%和80%。Miyoshi等[20]從5株不同種類菌體中篩選殼聚糖生產菌株,發現Absidiacoerulea產率最高,達10.4%,乙酰化程度最低,分子量為100~450 kDa,比化學法殼聚糖的分子量(120~1500 kDa)低。Davoust等[21]利用發酵罐培養對15株Absidia菌進行篩選,發現Absidiarepens殼聚糖產率最高,產量為2.8 g·L-1。Hu等[22]對33株真菌進行篩選,發現Absidiaglauca殼聚糖產率最高,為7.4%,產量最高為0.646 g·L-1,該菌吸附Cu2+能力最強,吸附能力比蟹殼殼聚糖高。Shimahara等[23]利用復合培養基從32株Rhizopus菌株中提取殼聚糖,產量為0.330~0.645 g·L-1。Suntornsuk 等[24]利用大豆和綠豆豆粕培養4株真菌,在大豆豆粕培養基上培養Rhizopusoryzae時殼聚糖產量最高,為4.3 g·(kg大豆豆粕)-1。Tan等[25]對接合菌綱的13株真菌進行篩選,發現Gongronellabutleri殼聚糖產率最高,為7.0%,產量為0.47 g·L-1。
2.2 菌種誘變
由于缺乏好的殼聚糖高產菌株的平板篩選方法,菌種誘變的相關報道不多。Maw等[26]利用紫外誘變Gongronellabutleri、應用酶聯免疫反應篩選高產菌,具體是通過篩選出甲殼素脫乙酰酶酶活高的菌株而完成的。高產菌株的殼聚糖產量和甲殼素脫乙酰酶酶活均提高2倍。
3 發酵工藝優化
3.1 固、液態發酵方法比較
Crestini 等[27]利用Lentinusedodes分別進行液態和固態發酵產殼聚糖,液態發酵產量為0.12 g·L-1,DD隨著培養時間的延長而增大,為5.5%~12.5%;固態發酵產量為6.18 g·(kg小麥稈培養基)-1,為目前資料顯示固態發酵殼聚糖產量最高值,DD隨著培養時間的延長基本沒有變化,為10.1%~12.5%。Nwe等[28]利用土豆或土豆浸出物為培養基主要成分并添加不同的氮源,分別進行固態和液態發酵Gongronellabutleri產殼聚糖,液態發酵產量為0.6 g·L-1[相當于6 g·(kg發酵培養基)-1],分子量為(0.7~1.2)×105Da,DD為94%~96%;固態發酵產量為3.7 g·(kg發酵培養基)-1,固態發酵利于產生低分子殼聚糖,分子量為(0.25~0.38)×105Da,DD為92%~96%。Wang等[29,30]分別利用固態發酵和液態發酵培養Absidiacoerulea,均得到5~10 kDa的低分子量殼聚糖,固態發酵所得殼聚糖產量為6.12 g·(kg土豆片培養基)-1,利用YPD培養基液態搖瓶發酵所得殼聚糖產量在0.6 g·L-1左右。
3.2 碳源、氮源
微生物生產殼聚糖要和化學法競爭,必須使用更便宜的碳源、氮源。
Amorim等[31]利用甜甘蔗汁或糖蜜為廉價碳源發酵Syncephalastrumracemosum,氮源為0.3%酵母膏,當添加最佳碳源甜甘蔗汁(30 g蔗糖·L-1)時,搖瓶殼聚糖得率為30 mg·(g蔗糖)-1,5 L發酵罐殼聚糖得率為50 mg·(g蔗糖)-1(即1.5 g·L-1)。G?ksungur[32]利用處理和未處理的甜菜糖蜜作碳源搖瓶培養Rhizopusoryzae,發現加未處理甜菜糖蜜、糖濃度40 g·dm-3的殼聚糖產量最高,達0.961 g·L-1;利用未處理的甜菜糖蜜作碳源的合成培養基發酵罐培養,在起始糖濃度為45.37 g·dm-3、通氣速度為2.10 vvm、攪拌速度為338.93 r·min-1的條件下,殼聚糖產量最高,為1.1 g·L-1,殼聚糖菌絲體產率均為8%~10%。
McGahren等[33]利用10~400 L的不同發酵容器發酵Absidiacoerulea產殼聚糖,結果表明,葡萄糖、糖蜜等都是好的碳源,培養基需要添加高濃度的胺鹽、微量元素和酵母膏,利用氨氣流加維持pH值4.5,菌絲體干重最高可達25 g·L-1,菌體為米粒樣小球,易收集和過濾。
Chatterjee等[34]利用糖蜜鹽、PDB和YPG等不同培養基三角瓶液態發酵Mucorrouxii產殼聚糖,產量分別為0.61 g·L-1、0.51 g·L-1和0.57 g·L-1。Nitar等[35]利用GongronellabutleriUSDB 0201甜土豆片和不同濃度的尿素在26 ℃培養7 d,結果表明,尿素加量為7.2 g·(kg底物)-1、起始pH值為5.5時,菌絲體產量最高,為38 g·(kg底物)-1,殼聚糖產率為10.5 g·(100 g菌絲體)-1,DD為89%;和Arcidiacono等[36]液態發酵研究結果一致。
有機廢水也可作為真菌殼聚糖的培養基。Yokoi等[37]研究表明,蒸餾廢水是培養Absidiaatrospra和Gongronellabutleri產殼聚糖的良好營養源,甜土豆蒸餾廢水培養Gongronellabutleri,殼聚糖產量達0.73 g·L-1。
3.3 添加劑
Jaworska等[16]考察了添加Fe2+、Mn2+、Cu2+、胰蛋白酶和甲殼素對Absidiaorchidis產殼聚糖的影響。結果表明,添加Fe2+、Mn2+利于菌絲體增長,26 ℃培養48 h的殼聚糖產量分別從0.40 g·L-1增長到1.28 g·L-1和1.84 g·L-1;添加Fe2+、Mn2+降低了甲殼素脫乙酰酶的活性,對殼聚糖產率影響不大;添加Cu2+抑制菌體生長;添加胰蛋白酶和甲殼素對Absidiaorchidis產殼聚糖沒有影響。有報道表明,培養中加入洋地黃苷,殼聚糖會提高產量3倍,洋地黃苷通過分裂甲殼素合成酶,將甲殼素鏈分解開,在結晶成微晶體前被脫乙酰酶作用[9]。
Chatterjee等[38]添加植物生長激素如赤霉素、吲哚乙酸、吲哚丁酸和激動素到糖蜜-鹽培養基中,可提高Mucorrouxii菌絲體和殼聚糖的產量,分別從12%提高到17.4%、從34%提高到69%,其中添加赤霉素效果最好,1 L培養基中添加3 mg赤霉素可提高殼聚糖產量69%,DD不變,但分子量由于激素的添加增大了50%。Chatterjee等[39]還發現,乳清培養基中添加植物生長激素能促進Rhizopusoryzae產殼聚糖,菌體產量提高19%~32%,但殼聚糖產率增長相對較小(1.7%~14.3%),其中添加赤霉素時菌體和殼聚糖產量提高最大,1 L乳清培養基中添加0.1 mg·L-1赤霉素可提高殼聚糖產量50%。殼聚糖產量提高的原因可能是添加激素提高了甲殼素脫乙酰酶的活性。Yoshihara等[40]認為培養基中添加5~12 g·L-1D-阿洛酮糖利于Rhizopusoryzae細胞壁中殼聚糖的合成。
3.4 接種量、溶氧
Davoust等[21]在10 L發酵罐中培養Absidiarepens產殼聚糖。結果發現,高產殼聚糖的最好方法是保證真菌快速生長和提高菌絲體產量。菌體的生長速度與發酵時的菌體形態密切相關,對于藍色犁頭霉,接種孢子的數量越多,起始生長速度越快,但菌體會提前達到生長平衡,從而導致最終菌體產率降低。液態發酵攪拌速度太低以及接種濃度過高均會嚴重影響菌體生長。進一步研究菌體形態對殼聚糖產量的影響發現,利用大的攪拌槳葉輪加快轉速時,會形成直徑更小、更結實的小球,同時避免漿狀體的出現,漿狀體的菌體產率比小球產率低。溶氧量在轉速200 r·min-1時下降迅速,菌體長成漿狀;但轉速升至350 r·min-1時,菌體變為2~3 mm小球。漿狀和2~3 mm小球均抑制菌體生長,而0.5 mm小球利于菌體生長。在對數期,無論形態如何,菌體中殼聚糖的產率穩定;在穩定期,產率從18%持續提高至23%,即產量2.8 g·L-1。并對分批培養和連續培養進行比較,發現連續培養會由于缺乏新的生長點而導致產率較低。
Wu等[41]研究發現,藍色犁頭霉培養過程中對溶氧的需求很高,且對剪切力的強度敏感。利用改進的有2個通信內網管的改良氣升式發酵罐液態培養產生的菌絲體的產量比傳統的氣泡塔式及600 r·min-1攪拌式發酵罐的高2倍,殼聚糖最高產量為3.16 g·L-1,比300 r·min-1攪拌式發酵罐的產量高55%,是目前資料顯示液態發酵殼聚糖產量最高值。
3.5 培養時間
不同生長階段真菌的幾丁質和殼聚糖含量不同,通常對數生長期含量較高[9,23,25,33,42]。對數生長期過后,菌體量仍然繼續增長,但殼聚糖量逐漸減少。這可能是由于,殼聚糖由新生成的甲殼素經脫乙酰酶作用而得到,在對數生長期,由于菌體積極生長,游離的殼聚糖相當高;到穩定期后,真菌細胞壁發生了生理學改變,殼聚糖被甲殼素和其它多糖所綁定,與其它細胞壁物質結合得更加牢固,使提取變得困難。因此,對數生長末期的殼聚糖產量最高,盡管穩定期菌絲體產量最高,但獲得的殼聚糖較少,應在對數期收獲菌絲體,以對數生長末期作為菌種篩選的培養期。Amorim等[19]則認為更多的殼聚糖在對數期早期,由脫乙酰酶作用產生,可能早期甲殼素結晶度不高,因而更易被酶作用。
3.6 pH值
Rane等[43]報道pH值對藍色犁頭霉產殼聚糖及殼聚糖的DD有影響,可能是因為脫乙酰酶在最適合pH值下轉化甲殼素為殼聚糖的效果更佳。Kafeotzopoulos等[11]研究發現,Mucorrouxii甲殼素脫乙酰酶作用的最適pH值為4.5,殼聚糖分子量隨著pH值的增加而增大,在pH值5.46和5.59時分別為251 kDa和317 kDa。
4 提取方法
與從蝦、蟹殼中提取的傳統方法相比,用絲狀真菌生產殼聚糖分離工藝簡便,絲狀真菌可利用其自身酶的催化作用得到殼聚糖,只需用稀堿和稀酸簡單處理就可以得到純度相當高的制品,大大簡化了提取工藝,降低了生產成本。
Domek等[12]用熱NaOH去除Mucorracemosus菌絲體中的蛋白質后,剩下的就是甲殼素和殼聚糖。Synowiecki等[44]利用Mucorrouxii液態發酵產殼聚糖,用2% NaOH提取菌絲體,90 ℃脫蛋白質2 h,10%乙酸60 ℃提取殼聚糖6 h,隨后將pH值調到9.0,得到殼聚糖,甲殼素和殼聚糖的產率分別為8.9% 和7.3%。
McGahren等[33]對3種不同提取方法進行了比較,結果發現,強酸利于殼聚糖的提取,但導致殼聚糖水解、粘度降低,培養91 h的菌體產量達23 g·L-1;1% HCl回流15 min,殼聚糖產率最高(達12.5%)、粘度最低(為5.3 cP)、純度為85%。Niederhofer等[45]認為水洗會洗去低分子殼聚糖,改用乙醇洗滌,利用藍色犁頭霉液態培養,得到重均分子量為4.5×104g·mol-1、數均分子量為1.7×104g·mol-1的殼低聚糖,殼低聚糖產率為2.9%。
Nwe等[46]研究發現選擇合適的提取方法對殼聚糖的產量影響很大。利用1 mol·L-1NaOH在45 ℃下提取13 h、0.35 mol·L-1乙酸在95 ℃下提取5 h殼聚糖,菌絲體基質沒有破壞,得到的是自由殼聚糖,Gongronellabutleri和Absidiacoerulea的殼聚糖產量分別為2 g·(100 g菌絲體)-1和6.5 g·(100 g菌絲體)-1;而將1 mol·L-1NaOH換作11 mol·L-1NaOH,得到產量8~9 g·(100 g菌絲體)-1的復合殼聚糖,其原因是在強堿的作用下,更多甲殼素脫乙酰變成了殼聚糖。
5 結語
已有的研究表明,根據合成途徑代謝調控,通過菌種選育,優化營養成分、培養條件或提取方法,可以進一步提高真菌殼聚糖的產量或產率,從而使真菌發酵法工業化生產殼聚糖成為可能,以替代現有的有生產缺陷的化學生產方法。
參考文獻:
[1] Onishi H,Machida Y.Biodegradation and distribution of water-soluble chitosan in mice[J].Biomaterials,1999,20(2):175-182.
[2] Mi F L,Tan Y C,Liang H F,et al.In vivo biocompatibility and degradability of a novel injectable-chitosan-based implant[J].Biomaterials,2002,23(1):181-191.
[3] 杜予民.甲殼素化學與應用的新進展[J].武漢大學學報(自然科學版),2000,46(2):181-186.
[4] Kim I Y,Seo S J,Moon H S,et al.Chitosan and its derivatives for tissue engineering applications[J].Biotechnology Advances,2008,26(1):1-21.
[5] Qin C Q,Du Y M,Xiao L.Moisture retention and antibacterial activity of modified chitosan by hydrogen peroxide[J].Journal of Applied Polymer Science,2002,86(7):1724-1730.
[6] Ai H,Wang F,Yang Q S,et al.Preparation and biological activities of chitosan from the larvae of houseflyMuscadomestica[J].Carbohydrate Polymers,2008,72(3):419-423.
[7] Dutta P K,Tripathi S,Mehrotra G K,et al.Perspectives for chitosan based antimicrobial films in food applications[J].Food Chemistry,2009,114(4):1173-1182.
[8] Jayakumar R,Prabaharan M,Nai S V,et al.Novel chitin and chitosan nanoflbers in biomedical applications[J].Biotechnology Advances,2010,28(1):142-150.
[9] Davis L L,Bartnickl-Gaacia S.Chitosan synthesis by the tandem action of chitin synthetase and chitin deacetylase fromMucorrouxii[J].Biochemistry,1984,23(6):1065-1073.
[10] Gamow R I,Ruiz-Herrera J,Fisher E P.The cell wall ofPhycomyces[M].In:E.Cerda-Olmedo and E.D.Lipson(eds.),Phycomyces.Cold Spring Harbor Laboratory,NY,1987:223-246.
[11] Kafeotzopoulos D,Martrinou A,Bouriotis V.Bioconversion of c-hitin to chitosan:Purification and characterization of chitin deacetylase fromMucorrouxii[J].Proceedings of the National Academy of Sciences of the United States of America,1993,90(7):2564-2568.
[12] Domek D B,Borgia P T.Changes in th rate of chitin-plus-chitosan synthesis accompany morphogenesis ofMucorracemosus[J].Journal of Bacteriology,1981,146(3):945-951.
[13] Hunsley D,Kay D.Wall structure of theNeurosporahyphal apex:Immunofluorescent localization of wall surface antigens[J].J Gen Microbiol,1976,95(2):233-248.
[14] Gooday G W,Trinci A J P.Wall structure and biosynthesis in fungi[J].Symp Soc Gen Microbiol,1980,30:207-251.
[15] Duran A,Cabib E,Bowers B.Chitin synthetase distribution on the yeast plasma membrane[J].Science,1979,203(4378):363-365.
[16] Jaworska M M,Konieczna E.The influence of supplemental components in nutrient medium on chitosan formation by the fungusAbsidiaorchidis[J].Appl Microbiol Biotechnol,2001,56(1-2):220-224.
[17] Cai J,Yang J H,Du Y M,et al. Enzymatic preparation of chitosan from the wasteAspergillusnigermycelium of citric acid production plant[J].Carbohydrate Polymers,2006,64(2):151-157.
[18] Wu T,Zivanovic S,Draughon F A,et al.Physicochemical properties and bioactivity of fungal chitin and chitosan[J].J Agric Food Chem,2005,53(10):3888-3894.
[19] Amorim R V S,Souza W,Fukushima K,et al.Faster chitosans production byMucoraleanstrains in submerged culture[J].Brazilian Journal of Microbiology,2001,32(1):20-23.
[20] Miyoshi H,Shimahara K,Watanabe K,et al.Characterisation of some fungal chitosans[J].Bioscience Biotechnology Biochemistry,1992,56:1901-1905.
[21] Davoust N,Hansson G.Idendifing the condiitons for development of beneficial mycelium morphology for chitosan-producingAbsidiaspp.in submersed cultures[J].Applied Microbiology Biotechnology,1992,36(5):618-620.
[22] Hu K J,Hu J L,Ho K P,et al.Screening of fungi for chitosan producers,and copper adsorption capacity of fungal chitosan and chitosanaceous materials[J].Carbohyd Polym,2004,58(1):45-52.
[23] Shimahara K,Takguchi Y,Kobayashi T,et al.Screening ofMucoraceaestrains suitable for chitosan production[M].In:Skjik-Brsk G,Anthonsen T,Sandford P(eds) Chitin and chitosan Elsevier,London,1989:171-178.
[24] Suntornsuk W,Pochanavanich P,Suntornsuk L.Fungal chitosan production on food processing by-products[J].Process Biochem,2002,37(7):727-729.
[25] Tan S C,Tan T K,Wong S M,et al.The chitosan yield ofZygomycetesat their optimum harvesting time[J].Carbohydrate Polymers,1996,30(4):239-242.
[26] Maw T,Tan T K,Khor E,et al.Selection ofGongronellabutleristrains for enhanced chitosan yield with UV mutagenesis[J].Journal of Biotechnology,2002,95(2):189-193.
[27] Crestini C,Kovac B,Giovannozzi-Sermanni G.Production and isolation of chitosan by submerged and solid-state fermentation fromLentinusedodes[J].Biotechnology and Bioengineering,1996,50(2):207-210.
[28] Nwe N,Chandrkrachang S,Stevens W F,et al.Production of fungal chitosan by solid state and submerged fermentation[J].Carbohydr Polym,2002,49(2):235-237.
[29] Wang W P,Du Y M,Qiu Y L,et al.A new green technology for direct production of low molecular weight chitosan[J].Carbohydrate Polymers,2008,74(1):127-132.
[30] Wang W P,Du Y M,Wang X Y.Physical properties of fungal chitosan[J].World J Microbiol Biotechnol,2008,24(11):2717-2720.
[31] Amorim R V S,Ledingham W M,Kennedy J F,et al.Chitosan fromSyncephalastrumracemosumusing sugar cane substrates as inexpensive carborn sources[J].Food Biotechnology,2006,20(1):43-53.
[32] G?ksungur Y.Optimization of the production of chitosan from beet molasses by response surface methodology[J].Journal of Chemical Technology & Biotechnology,2004,79(9):974-981.
[33] McGahren W J,Perkinson G A,Growich G A,et al.Chitosan by fermentation[J].Process Biochemistry,1984,19(3):88-90.
[34] Chatterjee S,Adhya M,Guha A K,et al.Chitosan fromMucorrouxii:Production and physico-chemical characterization[J].Process Biochem,2005,40(1):395-400.
[35] Nitar N,Willem F.Effect of urea on fungal chitosan production in solid substrate fermentation[J].Process Biochemistry,2004,39(1):1639-1642.
[36] Arcidiacono S,Kaplan D L.Molecular weight distribution of chitosan isolated fromMucorrouxiiunder different culture and processing conditions[J].Biotechnol Bioeng 1992,39(2):281-286.
[37] Yokoi H,Aratake T,Nishio S,et al.Chitosan production from shochu distillery wastewater by funguses[J].Journal of Fermentation and Bioengineering,1998,85(2):246-249.
[38] Chatterjee Sandipan,Chatterjee Sudipta,Chatterjee B P,et al.Influence of plant growth hormones on the growth ofMucorrouxiiand chitosan production[J].Microbiological Research,2009,164(3):347-351.
[39] Chatterjee Sudipta,Chatterjee Sandipan,Chatterjee B P,et al.Enhancement of growth and chitosan production byRhizopusoryzaein whey medium by plant growth hormones[J].International Journal of Biological Macromolecules,2008,42(2):120-126.
[40] Yoshihara K,Shinohara Y,Hirotsu T,et al.Chitosan productivity enhancement inRhizopusoryzaeYPF-61A by D-psicose[J].Journal of Bioscience and Bioengineering,2003,95(3):293-297.
[41] Wu W T,Huang T K,Wang P M,et al.Cultivation ofAbsidiacoeruleafrom chitosan production in a modified airlift reactor[J].J Chin Inst Chem Engrs,2001,32(3):235-240.
[42] Muzzarelli R A A,Ilari P,Tarsi P,et al.Chitosan fromAbsidiacoerulea[J].Carbohydr Polym,1994,25(1):45-50.
[43] Rane K D,Hoover D G.Production of chitosan by fungi[J].Food Biotechnology,1993,7(1):11-33.
[44] Synowiecki J,Nadia A A Q.Mycelia ofMucorrouxiias a source of chitin and chitosan[J].Food Chemistry,1997,60(4):605-610.
[45] Niederhofer A N,Müller B W.A method for direct preparation of chitosan with low molecular weight from fungi[J].European Journal of Pharmaceutics and Biopharmaceutics,2004,57(1):101-105.
[46] Nwe N,Stevens W F,Montet D,et al.Decomposition of myceliar matrix and extraction of chitosan fromGongronellabutleriUSDB 0201 andAbsidiacoeruleareakATCC 14076[J].International Journal of Biological Macromolecules,2008,43(1):2-7.

