調節性B細胞在炎癥免疫相關疾病的調控作用及機制
張玲玲,魏 偉
(安徽醫科大學臨床藥理研究所,抗炎免疫藥理學教育部重點實驗室,抗炎免疫藥物安徽省工程技術研究中心,安徽合肥 230032)
近年來,隨著對炎癥免疫相關疾病病理機制認識的不斷深入,負性調節性免疫細胞在炎癥免疫相關疾病中的調控作用越來越受到重視,如早期發現的調節性T細胞(regulatory T cell,Treg)和耐受性樹突細胞(tolerogenic dendritic cells,TDC)。這些負性調節性免疫細胞在自身免疫病中控制炎癥應答、抑制效應T細胞功能、降低炎癥細胞因子產生等方面發揮重要作用[1-3]。1974年B細胞抑制免疫應答被首次報道,豚鼠脾臟B細胞被發現可減弱遲發型超敏反應(delayed type hypersensitivity,DTH)[4]。提示機體也存在一個特殊功能的B細胞亞群,即調節性B細胞(regulatory B cell,Breg),直到近年來對Breg的研究才得以迅速發展。本文將對調節性免疫細胞概念的界定、Breg近年來在炎癥免疫相關疾病中調控作用及機制研究作一綜述。
1 調節性免疫細胞存在廣義和狹義兩種概念
調節性免疫細胞廣義上是指機體免疫系統存在的正性調節性免疫細胞和負性調節性免疫細胞。正性調節性免疫細胞上調機體免疫應答,如反應性B細胞通過呈遞抗原參與CD4+T細胞擴增、記憶形成和細胞因子產生,特異表達共刺激分子,活化T細胞等上調機體免疫應答。具有免疫原性成熟樹突細胞(dendritic cells,DCs)能夠激活初始T淋巴細胞,啟動、調控和維持免疫應答。狹義上,調節性免疫細胞是指具有負性調節作用的免疫細胞。該負性調節細胞參與了機體免疫應答下調,不僅在調節免疫應答和維持免疫系統穩態平衡起到關鍵作用,在自身免疫、腫瘤免疫、神經免疫和器官移植等中也發揮重要作用。如Treg通過產生抑制性細胞因子、抑制效應T細胞功能、降低炎癥細胞因子產生等機制控制自身免疫病炎癥應答[2]。調節性樹突細胞(regulatory dendritic cell,DCreg)又稱TDC,在維持免疫中樞和外周耐受中有重要作用。DCreg低表達或不表達共刺激分子,但表達吲哚胺 2,3-雙加氧酶(indoleamine 2,3-dioxygenase,IDO)和抑制性免疫球蛋白樣轉錄物(inhibitory immunoglobulinlike transcript,ILT),能促進CD4+CD25-T細胞分化為產生IL-10的Tregs,抑制自身反應性 T細胞的增殖[5-6]。DCreg通過分泌IL-10和TGF-β,消除抗原呈遞細胞(antigen-presenting cells,APC)抗原提呈功能,下調共刺激分子表達,抑制抗原特異性T細胞活化,從而誘導免疫耐受[7]。狹義上的Breg同樣通過產生抑制性細胞因子IL-10和TGF-β等機制參與調節免疫應答和介導免疫耐受。
2 Breg在控制炎癥免疫相關疾病免疫應答、介導免疫耐受中可能發揮重要作用
2.1IL-10和TGF-β是Breg發揮負性調節功能的重要細胞因子Breg是抑制性細胞因子IL-10和TGF-β來源的重要細胞[8],在調節免疫應答、介導免疫耐受中可能發揮重要作用[9]。多種B細胞亞群都具有Breg功能或產生IL-10的能力,包括CD5+B-1a、CD21+/CD23-邊緣區 B細胞或 IL-10 CD1d+/CD21+/CD23+T2-邊緣區前 B 細胞[10]。Breg在不同種屬可能存在不同表型,不同小鼠模型Breg也呈現不同的特征性表面標志分子。CD19+CD25+B細胞是第1個被發現有調節功能的Breg,不僅表達高水平共刺激分子,且分泌高水平 IL-10。小鼠脾臟 CD19+IL-10+CD1dhiCD5+CD21hiCD23+IgD+IgMhiB細胞被定義為Breg,此表型的Breg能夠通過誘導Foxp3+Treg擴增,預防和逆轉呼吸道過敏。CD25hiCD27hiCD86hiCD1dhiIL-10hiTGF-βhiB細胞被定義為人Breg,此表型的Breg能夠劑量依賴性降低CD4+T細胞增殖,通過細胞間接觸和分泌TGF-β提高Treg細胞表達Foxp3和CTLA-4[11]。
IL-10是Breg發揮調節功能所必需的,從IL-10敲除小鼠分離的B細胞則失去其保護功能。從關節炎小鼠脾細胞分離的B細胞體外用anti-IL-10/anti-IL-10R處理后,失去了阻止受體小鼠關節炎發展的作用[12]。在正常和自身免疫小鼠脾臟中,具有產生IL-10能力的CD1dhiCD5+CD19hiBreg,又稱為B10細胞,占成年小鼠脾臟 B細胞的1% ~3%。LPS、佛波醇-12-肉豆蔻酯-13-乙酯(phorbol 12-myristate 13-acetate,PMA)加上離子霉素(ionomycin)體外刺激5h可誘導B10表達IL-10。B10調節免疫應答多個細胞,通過IL-10,B10負性調節T細胞、巨噬細胞和DC活化,從而影響細胞免疫和體液免疫[13](圖1)。
2.2Breg負性調控炎癥免疫相關疾病的病理過程Breg的負性調控作用在一些炎癥免疫相關疾病小鼠模型中被證明,包括膠原性關節炎(collagen-induced arthritis,CIA)、實驗性變態反應性腦脊髓炎(experimental allergic encephalomyelitis,EAE)和系統性紅斑狼瘡(systemic lupus erythematosus,SLE)等。缺乏或丟失Breg,自身免疫病動物模型的癥狀加重[14]。人外周血Breg體外刺激5h后,可表達IL-10,并負性調節單核細胞因子產生[15]。在多發性硬化癥等自身免疫病中,Breg細胞比健康對照明顯減少,在病情惡化時,幼稚/記憶Breg比例降低[16]。內源或獲得轉移的B10直接可影響EAE病理過程。髓磷脂少突細胞糖蛋白敏感的B10過繼轉移到野生小鼠體內,可明顯降低EAE的發生,但不能阻止EAE的進程。B10在抑制異常T細胞應答中起到重要作用。體外分析,B10并不調節Treg增殖,但明顯改變CD4+T細胞IFN-γ和TNF-α的產生,且B10細胞下調DC細胞功能,而間接調節T細胞增殖[17]。在疾病進展期,中樞神經系統Treg數量明顯擴增,與晚期病程的負性調節平行,消除Treg可增強晚期病程。在疾病啟動階段預先消除B10可增強EAE病理過程,提示B細胞優先控制疾病的啟動,而Tregs主要是協同抑制疾病晚期階段[18]。
3 TLRs信號轉導在介導Breg負性調控中具有關鍵作用
3.1TLR信號轉導是連接天然免疫和適應性免疫的關鍵環節Toll樣受體(Toll-like receptors,TLRs)主要表達在B細胞、DCs和巨噬細胞等APC上,是天然免疫細胞識別病原體的一類重要的模式識別受體(Pattern recognition receptor,PRR)。目前已在哺乳類動物細胞發現了14個家族成員,每種TLRs在細胞結構中的分布也與它所識別的病原體相關分子模式(Pathogen associated molecular pattern,PAMP)相關聯。如TLR1、TLR2、TLR4、TLR5和TLR6通常表達在細胞表面,能識別暴露于細菌表面或是隱蔽于內環境中的肽聚糖、脂多糖、鞭毛蛋白等分子;而 TLR3、TLR7、TLR9等與抗病毒相關的TLRs則位于核內,識別病毒和細菌DNA[19-20]。
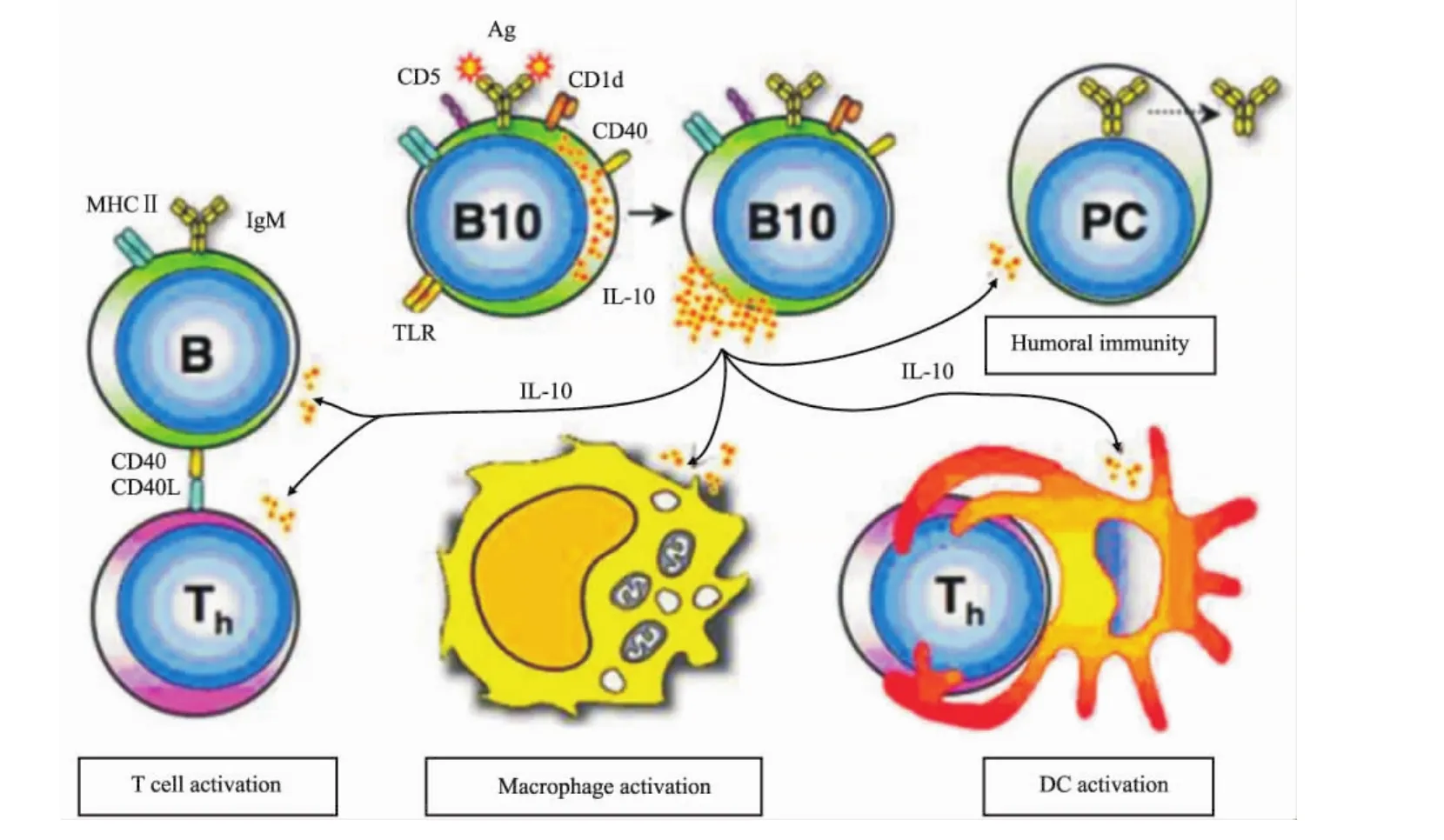
Fig 1 B10 negatively regulates T cell,macrophage and DC activation through secreting IL-10〔From Ann N Y Acad Sci,2010,1183(1):38-57〕
TLRs通過對PAMP進行識別,促進抗炎細胞因子釋放,并通過APC最終誘導T細胞的適應性免疫發生,是連接天然免疫和適應性免疫的關鍵環節。TLRs靶向活化兩條信號通路:一個是導致促炎癥細胞因子產生的髓樣分化抗原88(myeloid differentiation antigen 88,MyD88)依賴路徑;一個是與誘導IFN-I基因、上調DC表達MHC II和共刺激分子相關的MyD88非依賴路徑。MyD88是一個編輯蛋白,包含與TLRs同源結構域結合的羧基末端和死亡結構域(death domain)氨基末端兩個結構域。MyD88死亡結構域與IL-1受體相關激酶(IL-1R-associated kinase,IRAK)的死亡結構域相互作用引起IRAK的磷酸化。磷酸化的IRAK與腫瘤壞死因子受體相關因子6(TNF-α receptor association factor-6,TRAF6)形成復合物,進一步激活TGF-β活化激酶1(TGF-β activated kinase 1,TAK-1),TAK-1 在活化 NF-κB 路徑和絲裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)級聯反應中起到關鍵作用[21]。TLRs通過上述信號轉導通路調節著B細胞抗原呈遞、抗體應答、類別轉換和記憶應答[22]。隨著T細胞依賴的免疫應答觸發,TLR與BCR聯姻協同為固有免疫和適應性免疫提供了一個橋梁作用。
3.2TLR/MyD88信號轉導通路在炎癥免疫相關疾病炎癥發生發展中發揮重要作用TLR/MyD88信號轉導通路在炎癥免疫相關疾病炎癥發生發展中發揮重要作用。TLR激動劑刺激天然免疫和適應性免疫,結果打破了免疫耐受,而誘導炎癥免疫相關疾病,如 RA、SLE、EAE和糖尿病等[23]。TLR信號參與了RA的發病過程。RA滑膜組織高表達TLRs,通過TLR配體激活滑膜成纖維細胞,并趨化吸引免疫細胞。TLR4被認為是促進關節炎癥的一個突出的固有免疫受體。TLR4缺陷小鼠比較野生型小鼠CIA發病率低,關節炎的嚴重度輕,軟骨破壞減輕,炎癥細胞浸潤減少[24]。MyD88是參與狼瘡傾向小鼠自發SLE所必需的TLR信號分子,MYD88-依賴的信號轉導參與SLE自身抗體產生有兩個不同機制,第一,通過BCR和TLR二者共同活化介導細胞固有信號直接誘導自身抗體產生;第二,TLR和免疫復合物介導活化漿樹突細胞的間接作用。這些細胞活化產生高水平I型 IFN,參與 SLE的病理過程[25]。
3.3TLRs/MyD88信號轉導通路在介導Breg功能中起到關鍵作用BCR配體和或固有TLR刺激對B10細胞的活性具有關鍵調節作用,通過MyD88信號轉導依賴路徑促進B10細胞發育、分化和克隆擴增,誘導IL-10分泌。體外TLR9刺激小鼠脾細胞,可產生高水平IL-10。在小鼠脾臟邊緣區和邊緣區前B細胞中,TLR4或TLR9可觸發IL-10的產生。TLR4配體LPS誘導CD1dhiCD5+B細胞表達漿IL-10和克隆擴增[26]。
3.3.1某些TLR激動劑優先觸發了Breg細胞的抑制功能有些TLR對B細胞識別自身免疫病是需要的,而對疾病的啟動不是必需,提示TLR激動劑的類別優先觸發了Breg細胞的抑制功能,而限制了炎癥免疫相關疾病發生。Breg細胞識別的微生物產物通過TLR抑制T細胞介導的自身免疫疾病。體外,滅活的結核分枝桿菌刺激B細胞,可通過TLR-2/4-和MyD88-依賴方式產生IL-10。這樣Breg細胞中TLR/MyD88信號轉導拮抗其他細胞中促進Th17分化、誘導自身免疫病所需要的MyD88信號轉導。微生物產物通過TLR和MyD88活化誘導Breg細胞產生IL-10。體內,MyD88對B10細胞的發育和擴增并非必需,但對LPS刺激的產生和分泌一定量的IL-10是必需的,LPS刺激48h后,MyD88-/-B細胞中IL-10表達明顯低于野生型B細胞中的IL-10表達[27]。
3.3.2TLRs/MyD88活化的Breg細胞通過產生的IL-10可抑制T細胞活化及IFN-γ分泌B細胞分別用LPS或CpG寡核苷酸刺激后,可活化TLR-4或TLR-9,提供MyD88依賴的信號,并產生IL-10。而同樣的刺激條件下,DC和巨噬細胞不能產生IL-10。TLR刺激后,DC和B細胞對T細胞應答具有相反作用。LPS或CpG活化的B細胞培養上清抑制CD4+T細胞增殖反應,抑制程度與LPS或CpG活化的B細胞數量和活化時間成比例。而LPS活化的DC上清可上調T細胞增殖反應,可見TLRs/MyD88介導的信號是細胞特異性的,DC促進T細胞活化,而B細胞通過提供一個富含IL-10的周圍環境而抑制 T細胞增殖和分化[26,28]。B細胞MyD88-/-小鼠顯示強烈的自身反應T細胞增殖應答,并產生高水平IL-17[28]。提示B細胞中MyD88信號抑制自身反應T細胞應答。
3.3.3不同的TLR介導Breg功能控制炎癥免疫相關疾病的啟動和恢復TLR信號轉導觸發Breg細胞調節功能,可抑制Th1和Th17,并促使T細胞介導的炎癥轉變為自限性。B細胞外的其他細胞如DC和巨噬細胞中MyD88信號能夠啟動EAE的發生,而B細胞中MyD88信號可促使EAE的恢復[29]。在EAE小鼠模型,B細胞固有TLR信號可抑制Th1和Th17細胞介導的炎癥應答,利于疾病恢復[30]。TLR-4或TLR-9的激動劑可抑制小鼠 EAE、CIA和 SLE等發生[31]。消除tlr-9基因可加重狼瘡傾向小鼠的SLE癥狀,tlr-9基因多態性導致TLR-9低表達時,也能增加人SLE發病傾向[32]。B-TLR-2/4-/-小鼠能夠發展為慢性EAE,與對照組比較,B細胞MyD88-/-小鼠和B-TLR-2/4-/-小鼠產生大量IL-17和IFN-γ,提示從病程中恢復,限制病理性Th1和Th17應答需要通過TLR-2和或TLR-4的B細胞活化。但是TLR-2/4雙重缺陷的小鼠易感EAE,提示不同的TLR激動劑控制著EAE 的發生和恢復[26,28]。
另外,Breg的調節功能也需要BCR信號參與。體內,Breg的調節功能是抗原限制性的,提示需要一個抗原特異性的BCR信號。傳輸抗原孵育的B10細胞可減輕接觸性過敏反應(contact hypersensitivity)炎癥和EAE發生的嚴重度[33]。體外單獨用膠原或膠原加上CD40 mAb活化關節炎動物脾臟B細胞,可使B細胞產生高水平IL-10,而抑制關節炎。輸注BCR活化的B細胞也阻止NOD發生1型糖尿病。在CIA、SLE和EAE模型中,BCR和CD40協同作用對Breg的功能是需要的[34]。
4 展望
總之,Breg等負性調節細胞不僅在維持免疫系統平衡,而且在自身免疫病的病理機制調控中起著十分重要作用。TLR信號在自身免疫病中具有雙重作用,TLR通過啟動天然免疫和適應性免疫,打破了免疫耐受,而誘導自身免疫病,參與自身免疫病炎癥發生發展病理過程。TLR信號轉導通過觸發Breg細胞調節功能,也參與自身免疫病病理的負性調控。微生物產物通過TLR活化誘導Breg細胞產生IL-10。TLRs介導的信號是細胞特異性的,DC中TLRs/MyD88信號促進T細胞活化,而Breg細胞中TLRs/MyD88信號通過產生IL-10而抑制T細胞增殖和分化,并促使T細胞介導的炎癥轉變為自限性,而抑制自身免疫病理變化,促進炎癥免疫相關疾病的恢復。提示TLR激動劑不僅可促進免疫,對抗微生物和腫瘤,也可用于抑制自身免疫。因此,運用優先觸發Breg細胞調節功能的TLR激動劑,分離TLRs的相反作用,對控制免疫反應,制定合理的炎癥免疫相關疾病的治療策略具有重要的意義。
[1]Miyara M,Yoshioka Y,Kitoh A,et al.Functional delineation and differentiation dynamics of human CD4+T cells expressing the FoxP3 transcription factor[J].Immunity,2009,30(6):899-911.
[2]Chinen T,Volchkov P Y,Chervonsky AV,Rudensky AY.A critical role for regulatory T cell-mediated control of inflammation in the absence of commensal microbiota[J].J Exp Med,2010,207(11):2323-30.
[3]Stoop J N,Harry R A,von Delwig A,et al.Therapeutic effect of tolerogenic dendritic cells in established collagen-induced arthritis is associated with a reduction in Th17 responses[J].Arthritis Rheum,2010,62(12):3656-65.
[4]Katz S I,Parker D,Turk J L.B-cell suppression of delayed hypersensitivity reactions[J].Nature,1974,251(5475):550-1.
[5]Merims S,Dokouhaki P,Joe B,Zhang L.Human Vδ1-T cells regulate immune responses by targeting autologous immature dendritic cells[J].Hum Immunol,2011,72(1):32-6.
[6]Frick J S,Grünebach F,Autenrieth I B.Immunomodulation by semi-mature dendritic cells:a novel role of Toll-like receptors and interleukin-6[J].Int J Med Microbiol,2010,300(1):19-24.
[7]Vlad G,Chang C C,Colovai A I,et al.Membrane and soluble ILT3 are critical to the generation of T suppressor cells and induction of immunological tolerance[J].Int Rev Immunol,2010,29(2):119-32.
[8]Cantaert T,Doorenspleet M E,Francosalinas G,et al.Increase of CD5(+)B lymphocytes with a regulatory phenotype in spondyloarthritis[J].Arthritis Rheum,2012:22231660
[9]Kessel A,Haj T,Peri R,et al.Human CD19(+)CD25(high)B regulatory cells suppress proliferation of CD4(+)T cells and enhance Foxp3 and CTLA-4 expression in T-regulatory cells[J].Autoimmun Rev,2012;in pressed.
[10]Evans J G,Chavez-Rueda K A,Eddaoudi A,et al.Novel suppressive function of transitional 2 B cells in experimental arthritis[J].J Immunol,2007,178(12):7868-78.
[11]Mauri C,Ehrenstein M R.The“short”history of regulatory B cells[J].Trends Immunol,2008,29(1):34-40.
[12]Mauri C,Gray D,Mushtaq N,Londei M.Prevention of arthritis by interleukin 10-producing B cells[J].J Exp Med,2003,197(4):489-501.
[13]DiLillo D J,Matsushita T,Tedder T F.B10 cells and regulatory B cells balance immune responses during inflammation,autoimmunity,and cancer[J].Ann N Y Acad Sci,2010,1183(1):38-57.
[14]Rieger A,Bar-Or A.B-cell-derived interleukin-10 in autoimmune disease:regulating the regulators[J].Nat Rev Immunol,2008,8(6):486-7.
[15]Iwata Y,Matsushita T,Horikawa M,et al.Characterization of a rare IL-10-competent B-cell subset in humans that parallels mouse regulatory B10 cells[J].Blood,2011,117(2):530-41.
[16]Knippenberg S,Peelen E,Smolders J,et al.Reduction in IL-10 producing B cells(Breg)in multiple sclerosis is accompanied by a reduced na?ve/memory Breg ratio during a relapse but not in remission[J].J Neuroimmunol,2011,239(1-2):80-6.
[17]Gray M,Miles K,Salter D,et al.Apoptotic cells protect mice from autoimmune inflammation by the induction of regulatory B cells[J].Proc Natl Acad Sci USA,2007,104(35):14080-5.
[18]Matsushita T,Horikawa M,Iwata Y,Tedder T F.Regulatory B Cells(B10 Cells)and Regulatory T cells Have independent roles in controlling experimental autoimmune encephalomyelitis initiation and Late-Phase Immunopathogenesis[J].J Immunol,2010,185(4):2240-52.
[19]Derbigny W A,Shobe L R,Kamran J C,et al.Identifying a role for Toll-like receptor 3 in the innateimmuneresponseto Chlamydia muridarum infection in murine oviduct epithelial cells[J].Infect Immun,2012,80(1):254-65.
[20]Triantafilou K,Triantafilou M.Visualising PAMP-PRR interactions using nanoscale imaging[J].Methods Mol Biol,2012,799(2):253-66.
[21]Minematsu H,Shin M J,Celil Aydemir A B,et al.Nuclear presence of nuclear factor of activated T cells(NFAT)c3 and c4 is required for Toll-like receptor-activated innate inflammatory response of monocytes/macrophages[J].Cell Signal,2011,23(11):1785-93.
[22]Pone E J,Zan H,Zhang J,et al.Toll-like receptors and B-cell receptors synergize to induce immunoglobulin class-switch DNA recombination:relevance to microbial antibody responses[J].Crit Rev Immunol,2010,30(1):1-29.
[23]Lang K S,Recher M,Junt T,et al.Toll-like receptor engagement converts T-cell autoreactivity into overt autoimmune disease[J].Nat Med,2005,11(2):138-45.
[24]Pierer M,Wagner U,Rossol M,Ibrahim S.Toll-like receptor 4 is involved in inflammatory and joint destructive pathways in collagen-induced arthritis in DBA1J mice[J].PLoS One,2011,6(8):e23539.
[25]Sadanaga A,Nakashima H,Akahoshi M,et al.Protection against autoimmune nephritis in MyD88-deficient MRL/lpr mice[J].Arthritis Rheum,2007,56(5):1618-28.
[26]Yanaba K,Bouaziz J D,Matsushita T,et al.The development and function of regulatory B cells expressing IL-10(B10 cells)requires antigen receptor diversity and TLR signals[J].J Immunol,2009,182(12):7459-72.
[27]Simmons D P,Canaday D H,Liu Y,et al.Mycobacterium tuberculosis and TLR2 agonists inhibit induction of typeⅠIFN and class Ⅰ MHC antigen cross processing by TLR9[J].J Immunol,2010,185(4):2405-15.
[28]Lampropoulou V,Hoehlig K,Roch T,et al.TLR-activated B cells suppress T cell-mediated autoimmunity[J].J Immunol,2008,180(7):4763-73.
[29]Kirkland D,Benson A,Mirpuri J,et al.B cell-intrinsic MyD88 signaling prevents the lethal dissemination of commensal bacteria during colonic damage[J].Immunity,2012,36(2):228-38.
[30]Lampropoulou V,Hoehlig K,Roch T,et al.TLR-activated B cells suppress T cell-mediated autoimmunity[J].J Immunol,2008,180(7):4763-73.
[31]Buenafe A C,Bourdette D N.Lipopolysaccharide pretreatment modulates the disease course in experimental autoimmune encephalomyelitis[J].J Neuroimmunol,2007,182(1-2):32-40.
[32]Tao K,Fujii M,Tsukumo S,et al.Genetic variations of Toll-like receptor 9 predispose to systemic lupus erythematosus in Japanese population[J].Ann Rheum Dis,2007,66(7):905-9.
[33]Yanaba K,Bouaziz J D,Haas K M,et al.A regulatory B cell subset with a unique CD1dhiCD5+phenotype controls T cell-dependent inflammatory responses[J].Immunity,2008,28(5):639-50.
[34]Matsushita T,Horikawa M,Iwata Y,Tedder T F.Regulatory B cells(B10 cells)and regulatory T cells have independent roles in controlling experimental autoimmune encephalomyelitis initiation and late-phase immunopathogenesis[J].J Immunol,2010,185(4):2240-52.

