四丁基丙二胺對人MG63骨髓瘤細(xì)胞增殖、凋亡和遷移能力的影響
張賀吉,王 凱,韓 鈺,楊建林,王艷林
(1.三峽大學(xué)醫(yī)學(xué)院,三峽大學(xué)分子生物學(xué)研究所,湖北宜昌 443002;2.武漢工程大學(xué),湖北省新型反應(yīng)器與綠色化學(xué)工藝重點實驗室,湖北武漢 430073)
多胺(腐胺、精瞇、精胺)是存在于真核細(xì)胞中的有機小分子,廣泛參與細(xì)胞增殖、分化和基因表達(dá)與調(diào)控等重要生理功能[1-3]。近來研究發(fā)現(xiàn),腫瘤細(xì)胞的快速生長依賴于細(xì)胞內(nèi)異常升高的多胺含量,由此多胺代謝途徑成為抗腫瘤治療和抗腫瘤藥物設(shè)計的新靶點[4-5]。多胺類似物是與天然多胺具有相似結(jié)構(gòu)的小分子化合物,它們或者通過干擾多胺代謝而耗竭細(xì)胞內(nèi)多胺庫,或者競爭性抑制多胺的正常功能而阻遏腫瘤細(xì)胞增殖,誘導(dǎo)腫瘤細(xì)胞凋亡[6-9]。正在研究中的一批多胺類似物在體外雖能有效抑制腫瘤細(xì)胞生長,但高效低毒、能用于人體腫瘤治療的類似物卻為數(shù)不多。研發(fā)和篩選新的多胺類似物用于臨床抗腫瘤治療仍為當(dāng)前的熱點研究領(lǐng)域。四丁基丙二胺(tetrabutyl propanediamine,TBP)是本課題組協(xié)作單位武漢工程大學(xué)新合成的一種腐胺類似物,具有潛在的抗腫瘤藥理活性。本研究分析了TBP對人MG63骨髓瘤細(xì)胞生長,凋亡及遷移能力的影響。
1 材料與方法
1.1材料人骨髓瘤細(xì)胞株MG63由本實驗室保存,多胺類似物四丁基丙二胺(tetrabutyl propanediamine,TBP)由武漢工程大學(xué)王凱副教授合成,PVDF膜為Millipore公司產(chǎn)品;ECL試劑盒為Thermo公司產(chǎn)品;兔抗人Bax和細(xì)胞色素C多克隆抗體為Santa Cruz公司產(chǎn)品,羊抗兔IgG-HRP為Jackson公司產(chǎn)品。其它化學(xué)試劑來自Invitrogen和Sigma公司。Transwell細(xì)胞培養(yǎng)板為Corning公司產(chǎn)品。GelLogic-200凝膠圖像分析儀為Kodak公司產(chǎn)品,EPLCS XL流式細(xì)胞分析儀為Becman-Coulter公司產(chǎn)品,全波長酶標(biāo)儀為Thermo公司產(chǎn)品。
1.2方法
1.2.1MTT法測定細(xì)胞增殖速度取對數(shù)生長期的MG63細(xì)胞,調(diào)整細(xì)胞濃度至2×107·L-1后接種于96孔板中,每孔100 μl。37℃培養(yǎng)24 h后,向孔內(nèi)加入含不同濃度TBP的DMEM培養(yǎng)液100 μl并繼續(xù)培養(yǎng)。在設(shè)定的培養(yǎng)時間點去培養(yǎng)液,加入含200 mg·L-1MTT的無血清培養(yǎng)液,37℃孵育4 h后去上清,然后加入 DMSO 200 μl·well-1,室溫振搖20 min溶解結(jié)晶,570 nm波長下檢測每孔的吸光值A(chǔ)。細(xì)胞生存率/%=A藥物/A對照×100%。
1.2.2Western blot法鑒定相關(guān)基因在蛋白水平上的表達(dá)將收集的培養(yǎng)細(xì)胞分為兩份,一份用細(xì)胞裂解液 A(10 mmol·L-1HEPES,pH 7.2,210 mmol·L-1D-mannitol,70 mmol·L-1sucrose,5 mmol·L-1sodium succinate,0.2 mmol·L-1EGTA,100 mg·L-1digitonin)在冰浴裂解20 min,室溫保溫5 min后,600 r·min-1離心 5 min去細(xì)胞核,將上清轉(zhuǎn)移至另一試管中,12 000 r·min-1離心10 min去線粒體,取上層裂解液用于細(xì)胞色素C(Cyt-C)檢測。另一份用細(xì)胞裂解液 B(20 mmol·L-1Tris-HCl,pH 8.0,150 mmol·L-1NaCl,2 g·L-1NP-40)裂解、離心取上清用于Bax的檢測。上述裂解液中的蛋白經(jīng)10%的SDS-PAGE分離后,電轉(zhuǎn)移至PVDF膜上。膜先后與第一抗體和HRP標(biāo)記的第二抗體作用,ECL法示蹤目標(biāo)蛋白。實驗中以β-actin作為內(nèi)參照蛋白。
1.2.3流式細(xì)胞術(shù)(FCM)檢測細(xì)胞周期收集對數(shù)生長期細(xì)胞,用含75%乙醇和0.5 mmol·L-1EDTA的PBS重懸細(xì)胞,4℃固定30 min后2 000 r·min-1離心 5 min 棄上清,用含1 g·L-1Triton X-100和50 mg·L-1RNAse的 PBS混合液500 μl重懸細(xì)胞,加入 0.5 g·L-1PI(Propidium Iodide)90 μl,37℃避光保溫30 min,尼龍膜過濾,流式細(xì)胞分析儀檢測。
1.2.4Transwell技術(shù)分析腫瘤細(xì)胞的遷移能力無血清DMEM培養(yǎng)基培養(yǎng)MG63細(xì)胞4 h,收集細(xì)胞后用含2 g·L-1BSA的DMEM基礎(chǔ)培養(yǎng)基重懸細(xì)胞,調(diào)整細(xì)胞密度為 2.5 ×108·L-1,取 200 μl細(xì)胞懸液鋪在Transwell上室中,同時加入TBP(終濃度為 40 μmol·L-1),下室內(nèi)加入 800 μl含 10% 胎牛血清的DMEM培養(yǎng)基,37℃培養(yǎng)18 h后,PBS清洗小室細(xì)胞2次,4%多聚甲醛室溫固定小室膜30 min,PBS清洗3次后,蘇木精染細(xì)胞核5 min,清水浸泡20 min,用棉簽輕輕擦拭上室內(nèi)側(cè)面的細(xì)胞,同時清水沖洗3~5遍,用鑷子撥下小室的膜,下側(cè)面向上平鋪于載玻片,顯微鏡下隨機觀察5個視野并做細(xì)胞計數(shù),取其平均值代表細(xì)胞的遷移能力。
1.2.5統(tǒng)計學(xué)分析實驗數(shù)據(jù)采用組間t檢驗經(jīng)SPSS 2.0軟件進(jìn)行統(tǒng)計分析,結(jié)果用±s表示。
2 結(jié)果
2.1TBP對MG63細(xì)胞增殖的影響用MTT法檢測了TBP對MG63細(xì)胞生長的影響,結(jié)果顯示,TBP能明顯抑制MG63細(xì)胞生長,抑制效應(yīng)呈濃度和時間依賴性(Tab 1)。
2.2TBP對腫瘤細(xì)胞生長周期的影響分別收集40 μmol·L-1TBP 處理48 h 和對照 MG63 細(xì)胞,利用流式細(xì)胞儀檢測細(xì)胞周期變化,結(jié)果顯示,TBP處理MG63細(xì)胞后,G1期和G2期細(xì)胞增加但S期細(xì)胞明顯減少,同時出現(xiàn)大量凋亡細(xì)胞(亞凋亡峰),提示多胺類似物TBP可能通過干擾細(xì)胞周期而影響MG63細(xì)胞的正常生長,并同時誘導(dǎo)MG63骨肉瘤細(xì)胞發(fā)生凋亡(Tab 2,F(xiàn)ig 1)。
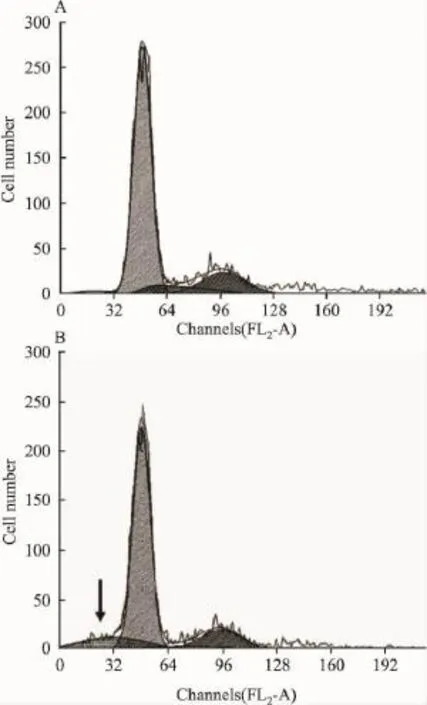
Fig 1 Effect of TBP on cell cycle and apoptosis in MG63 cells
Tab 1 Effect of TBP on cell survival rate in MG63 cells with MTT method(±s,n=3)
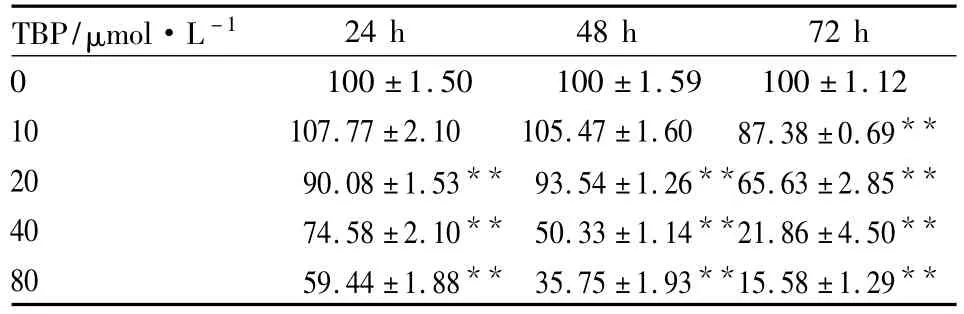
Tab 1 Effect of TBP on cell survival rate in MG63 cells with MTT method(±s,n=3)
The cells were treated by 0~40 μmol·L-1TBP for 24~72 h.**P <0.01 vs 0 μmol·L -1TBP group.
TBP/μmol·L -124 h 48 h 72 h 0 100 ±1.50 100 ±1.59 100 ±1.12 10 107.77 ±2.10 105.47 ±1.60 87.38 ±0.69**20 90.08 ±1.53** 93.54 ±1.26**65.63 ±2.85**40 74.58 ±2.10** 50.33 ±1.14**21.86 ±4.50**80 59.44 ±1.88** 35.75 ±1.93**15.58 ±1.29**
Tab 2 Effect of TBP on cell cycle in MG56 cells with flow cytometry method(±s,n=3)

Tab 2 Effect of TBP on cell cycle in MG56 cells with flow cytometry method(±s,n=3)
The cells were treated by 40 μmol·L -1TBP for 48 h.**P <0.01 vs control group
MG63-control 75.61 ±0.55 12.57±0.40 11.82±0.45 0.46 ±0.06 MG63-TBP 79.68 ±1.42**16.24±0.43** 4.08±0.79**11.74 ±1.44**
2.3TBP對DNA片段化的影響40 μmol·L-1TBP處理MG63細(xì)胞48 h后,分別提取處理細(xì)胞和對照細(xì)胞胞質(zhì)中的DNA,然后對樣本進(jìn)行Agarose凝膠電泳分析,結(jié)果顯示,TBP處理導(dǎo)致凋亡細(xì)胞典型的DNA的片段化現(xiàn)象(Fig 2)。

Fig 2 Cell apoptosis induced by TBP with DNA degradation assay
2.4TBP對凋亡相關(guān)蛋白的影響用Western blot分析了TPB處理后,MG63細(xì)胞質(zhì)中凋亡相關(guān)蛋白Bax和Cyt C水平的影響。結(jié)果發(fā)現(xiàn),TBP導(dǎo)致促凋亡蛋白Bax蛋白水平增加和Cyt C從線粒體的釋放(Fig 3)。
2.5藥物對腫瘤細(xì)胞遷移能力的影響用Transwell技術(shù)分析了TBP對MG63細(xì)胞遷移能力的影響,結(jié)果顯示,TBP處理細(xì)胞降低MG63細(xì)胞的遷移能力,與對照細(xì)胞比較,差異具有顯著性(Tab 3)。
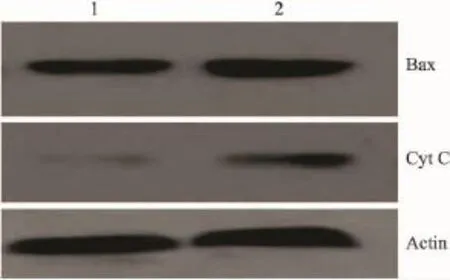
Fig 3 Bax and Cyt C levels in the cytosol of MG63 cells with Western blot
Tab 3 Effect of TBP on cell migration in MG63 cells(cell number/Each field of vision,±s,n=5)

Tab 3 Effect of TBP on cell migration in MG63 cells(cell number/Each field of vision,±s,n=5)
The cells were treated by 40 μmol·L -1TBP for 48 h.**P <0.01 vs control group
Group Migrated cell MG63-control 43.7 ±9.29 MG63-TBP 5.2 ±1.58**
3 討論
通過控制多胺代謝和干擾多胺功能而抑制腫瘤生長是抗腫瘤藥物設(shè)計的新策略,其中抗腫瘤多胺類似物的合成與篩選為當(dāng)前的研究熱點,本研究應(yīng)用的TBP即為新合成的一種腐胺對稱性修飾物。為探討TBP作為抗腫瘤藥物的潛在價值,本研究以人骨髓瘤MG63細(xì)胞為實驗對象,分析了TBP對瘤細(xì)胞增殖、遷移和凋亡的影響。結(jié)果證實,TBP能有效抑制MG63細(xì)胞的生長,且這種抑制呈時間和劑量依賴性。隨后的細(xì)胞周期和細(xì)胞凋亡分析提示,上述抑制作用可能與TBP抑制細(xì)胞周期和誘導(dǎo)細(xì)胞凋亡密切相關(guān)。多胺能與DNA分子結(jié)合,參與DNA構(gòu)象轉(zhuǎn)換,結(jié)構(gòu)穩(wěn)定、染色質(zhì)凝縮和解凝縮等過程,以及調(diào)節(jié)轉(zhuǎn)錄因子與DNA元件間的相互作用,并由此加快DNA復(fù)制和細(xì)胞分裂[10-12]。作為一種多胺的結(jié)構(gòu)類似物,TBP可能干擾了上述多胺的正常功能,導(dǎo)致DNA復(fù)制障礙,細(xì)胞周期抑制,S期細(xì)胞明顯減少。腫瘤細(xì)胞的典型特征之一是喪失發(fā)生凋亡的能力,因而誘發(fā)腫瘤細(xì)胞凋亡是抗腫瘤藥物設(shè)計的重要目標(biāo)。細(xì)胞凋亡分為外源性凋亡和內(nèi)源性凋亡兩大類,而線粒體結(jié)構(gòu)和功能的改變是內(nèi)源性細(xì)胞凋亡的核心事件[13]。在本研究中,TBP處理導(dǎo)致MG63細(xì)胞發(fā)生典型的DNA片段化現(xiàn)象和流式細(xì)胞分析中亞凋亡峰(Sub-G1)的出現(xiàn),以及線粒體促凋亡蛋白Bax和Cyt C在胞質(zhì)中含量增加,均提示TBP激活了線粒體介導(dǎo)的凋亡途徑。
上述結(jié)果提示,TBP有作為骨髓瘤治療藥物的臨床應(yīng)用前景。在后續(xù)研究中,我們將進(jìn)一步探討TBP抗腫瘤藥理活性的分子機制,特別是對多胺代謝的影響,以及在動物水平上評價該藥的安全性。
[1]Casero R A,Pegg A E.Polyamine catabolism and disease[J].Biochem J,2009,421(3):323 -38.
[2]Wallace H M,F(xiàn)racer A V,Hughes A.A perspective of polyamine metabolism[J].Biochem J,2003,374:1 -14.
[3]Childs A C,Mehta D J,Gerner E W.Polyamine-dependent gene expression[J].Cell Mol Life Sci,2003,60:1394 - 406.
[4]Gerner E W,Meyskens F L Jr.Polyamines and cancer:old molecules,new understanding[J].Nat Rev Cancer,2004,4(10):781-92.
[5]Casero R A,Marton L J.Targeting polyamine metabolism and function in cancer and other hyperproliferative diseases[J].Nature Rev Drug Disc,2007,6(5):373 -90.
[6]Seiler N.Pharmacological aspects of cytotoxic polyamine analogues and derivatives for cancer therapy[J].Pharmacol Ther,2005,107(1):99-119.
[7]Huang Y,Pledgie A,Casero R A Jr,Davidson N E.Molecular mechanisms of polyamine analogues in cancer cells[J].Anticancer Drugs,2005,16(3):229 -41.
[8]王艷林,韓 鈺,袁太寧,周永琴.多胺類似物CPENSpm通過干擾多胺代謝抑制肺癌細(xì)胞的增殖[J].中國藥理學(xué)通報,2008,24(1):132 -5.
[8]Wang Y L,Han Y,Yuan T N,Zhou Y Q.Polyamine analogue CPENSpm inhibits proliferation of human lung cancer cells by interfering polyamine metabolism[J].Chin Pharmacol Bull,2008,24(1):132-5.
[9]Casero R A,Woster P M.Recent advances in the development of polyamine analogues as antitumor agents[J].J Med Chem,2009,52:4551-73.
[10]Thomas T J,Messner R P.Structural specificity of polyamines in left-handed Z-DNA formation.Immunological and spectroscopic studies[J].J Mol Biol,1988,201:463 - 7.
[11]Feuerstein B G,Williams L D,Basu H S,Marton L J.Implications and concepts of polyamine-nucleic acid interactions[J].J Cell Biochem,1991,46:37 -47.
[12]Panagiotidis C A,Artandi S,Calame K,Silverstein S J.Polyamines alter sequence-specific DNA-protein interactions[J].Nucleic Acids Res,1995,23:1800 -9.
[13]Kimi H E,Du F H,F(xiàn)ang M,Wang X D.Formation of apoptosome is initiated by cytochromecinduced dATP hydrolysis and subsequent nucleotide exchange on Apaf-1[J].PNAS USA,2005,102(4):17545-50.

