不同營養水體對喜旱蓮子草化感抗藻的影響
葉良濤,錢家忠,左勝鵬,李蜀萍,陳雅瓊
(1.安徽師范大學環境科學與工程學院,安徽 蕪湖241003;2.合肥工業大學資源與環境工程學院,安徽 合肥230009)
一些水生植物能產生化感物質抑制有害藻類的生長,因此利用水生植物的化感潛力抑藻成為一種很有前景的藻類控制技術[1,2]。如挺水植物中的蘆葦(Phragmitescommunis)釋放2-甲基乙酰乙酸乙酯[3]、浮水植物中的鳳眼蓮(Eichhorniacrassipes)釋放 N-苯基-2-萘胺[4]、沉水植物中的穗花狐尾藻(Myriophyllumspicatum)[5]產生五倍子酸、焦棓酸等,均能抑制水體中有害藻類的生長。兩棲植物喜旱蓮子草(Alternantheraphiloxeroides)是莧科多年生草本植物,原產南美洲,后被引入北美洲、大洋洲、東南亞和中國等地,現已成為一個世界性的入侵植物種[6]。目前關于喜旱蓮子草的研究多集中于喜旱蓮子草生物入侵性[7]、生態適應性[8]、生物防治[9]、環境效應[10]以及對草坪草的化感作用[11]等方面的內容,而關于入侵植物喜旱蓮子草抗藻方面的研究鮮有報道。由于在我國巢湖、滇池、太湖等眾多淺型湖泊中幾乎連年暴發水華,有害藻中以藍藻和綠藻居多。因此,本研究選擇銅綠微囊藻為實驗對象,設計不同的喜旱蓮子草水體營養環境,比較分析了喜旱蓮子草活體和殘體植株對銅綠微囊藻生長的影響,同時調查水體理化性質,試圖揭示富營養化水體中入侵植物喜旱蓮子草化感控藻的機制,為有效地管理和利用入侵植物,以及合理控制水華提供理論參考。
1 材料與方法
1.1 材料
銅綠微囊藻購自中國科學院水生生物研究所淡水藻種庫。實驗前用BG11培養基在GHP-160光照培養箱(三發,上海)中對銅綠微囊藻進行擴大并穩定繼代培養,光暗周期12h∶12h,晝間溫度25℃,光強70μmol/(m2·s);夜間溫度20℃。喜旱蓮子草于2009年7月采自于巢湖忠廟濕地,實驗前分別經自來水、蒸餾水各沖洗3次,每次10min,去除植株上攜帶泥沙、附著物等雜質。其中一部分植株在水族箱作為活體培養,備用;另一部分在110℃下殺青15min,再自然晾干,剪成5cm小段,放于低溫冰箱保存,備用。
1.2 喜旱蓮子草活體和殘體植株化感抗藻測定
實驗共設3種培養環境:富營養化湖水(巢湖西半湖湖心,其水體特征見表1)、標準BG11培養液和二次蒸餾水。選取30株形態相似(30cm/株)、生物量相近、幼嫩鮮活的喜旱蓮子草植株,分別移植于裝有上述3種培養液(培養液體積為10L)的水族箱中(20cm×40cm×60cm),每箱移栽10株。當移植成活后,分別在第0,5,10,15和20天用酸度計(雷磁,上海)測定培養水體的pH值和氧化還原電位。同時分別取2類材料在3種不同水體營養狀態下所對應天數的種植水和腐解液100mL,先用定性濾紙過濾,再用0.45μm的濾膜(新亞,上海)進行抽濾,最后通過0.22μm的濾膜(新亞,上海)濾除微生物和雜質,儲藏于4℃冰箱備用。

表1 來自巢湖的富營養化培養水體特征Table 1 Water features of eutrophic culture medium from Chaohu Lake mg/L
前期實驗結果顯示在接種銅綠微囊藻的同時,分別加1,2,5,10,20mL上述3種濾液,培養3,6,9,12,15d后,發現10mL添加液對處于遲滯期(即0~6d)的銅綠微囊藻有顯著抑制,而且處理間差異顯著(P<0.01,20mL為100%抑制,數據未顯示)。在已裝有50mL滅菌BG11培養液的錐形瓶中,于DL-CJ-2ND醫用型超凈工作臺上,分別接種5mL銅綠微囊藻液。
因此,本實驗先采用喜旱蓮子草活體植株、3類水體(蒸餾水、BG11、富營養水)、每類水體各取5個培養時期水樣(第0,5,10,15和20天),每時期均取20mL水樣,最后得到10mL濾液,加入到已接種4d的藻類培養液中,用帶微生物過濾的封口膜包裹好,放入光照培養箱進行培養,培養3d后,從各處理的錐形瓶中取10mL于試管中用低頻漩渦混合振蕩器振蕩2min,使藻細胞分布均勻,然后分別在顯微鏡(歐依卡,重慶)下用血球計數板進行計數,測定藻密度。培養過程中,每天定時振搖4次,進行藻類擾動,增強活力和保持正常增殖。活體植株共15個處理,每處理重復6次。同理,進行殘體植株腐解實驗,以上步驟基本相同,只是在以上3種培養液中,以50 g/L的標準進行添加喜旱蓮子草殘體植株,在水族箱自然腐解,最后測定藻密度。
化感指數(allelopathic index)的確立是根據 Williamson和Richardson[12]提出的化感作用評價方法。
1.3 數據處理
實驗數據采用Excel 2003軟件進行作圖和統計分析。
2 結果與分析
2.1 不同營養水體對喜旱蓮子草化感抗藻的影響
在3種不同的水體營養狀態下,喜旱蓮子草活體植株對銅綠微囊藻的抑制效應為:蒸餾水>富營養化湖水>標準BG11營養液(圖1A)。喜旱蓮子草第5天的種植水已達到抗藻的一個高峰,隨后的第10天到第20天的種植水抑藻效應趨于穩定,但有輕微波動。在蒸餾水培養下,其第5天種植水對銅綠微囊藻的化感指數為70.7%,為最高值;之后從第5天到第15天的種植水化感指數持續下降,到第15天降到最低值;隨后其種植水化感指數又開始緩慢上升。在富營養湖水培養下,喜旱蓮子草活體植株第5天種植水對銅綠微囊藻的化感指數為56.5%;在第5~10天,其種植水化感指數開始緩慢上升,第10天達到最高(63.2%);之后化感指數開始緩慢下降,第20天下降到最低值,僅為54%。在BG11營養液培養下,喜旱蓮子草活體植株第5天種植水對銅綠微囊藻的化感指數為48.5%,達到最高值;隨后第5~20天,化感指數先下降再上升,然后再下降,直到最低值37.1%。喜旱蓮子草殘體植株腐解液化感抗藻動態在3種不同營養水體中差異顯著,表現為:富營養化湖水>標準BG11營養液>蒸餾水,但總體趨勢基本相同(圖1B),即第5天的腐解液化感指數達到最大值,隨后的第10~20天抑藻效應趨于穩定。在富營養化湖水中腐解的喜旱蓮子草殘體植株表現出最佳的化感抑藻效應,其第5天的腐解液就對銅綠微囊藻的化感指數達到91.7%;之后在第5~15天,其化感指數逐漸上升,并達到最高值(96%);隨后,在第15~20天,其值略有下降。在BG11營養液中腐解的喜旱蓮子草殘體植株抑藻效應中等,其第5天的腐解液對銅綠微囊藻化感指數達到87.1%,僅次于第10天的腐解液對銅綠微囊藻87.9%的最高化感指數;之后在第10~20天,其化感指數持續下降。在蒸餾水中腐解的喜旱蓮子草殘體植株化感抑藻效應在3類模擬水體環境中最低,其腐解液對銅綠微囊藻的化感指數最高值僅為78.5%。
2.2 喜旱蓮子草培養水體的pH變化
喜旱蓮子草的活體植株和殘體植株的水培養液pH值隨時間推移而發生改變,殘體植株腐解液的pH值主要呈酸性,而活體植株培養液的pH值變化趨勢不一致(圖2)。活體植株的富營養化湖水培養液pH值偏堿性,在標準BG11培養液中pH值近似為中性,在蒸餾水培養液中pH值偏酸性,即3類水體的pH值按降序排列為:富營養化湖水>標準BG11營養液>蒸餾水(圖2A)。在不同的水體環境中喜旱蓮子草殘體植株腐解液的pH值變化趨勢很明顯,都是隨時間的推移緩緩下降,但到了15d以后pH變化趨勢平穩,基本無變化(圖2B)。喜旱蓮子草殘體植株可能在腐解的過程中釋放某些酸性物質,使得pH緩緩下降。
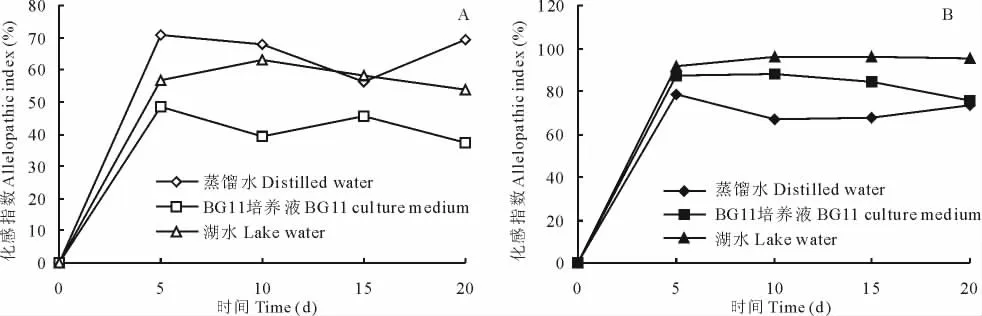
圖1 不同營養水體中的喜旱蓮子草活體植株(A)和殘體植株(B)對銅綠微囊藻生長的影響Fig.1 Effects of living plants(A)and dead plants(B)of A.philoxeroides on the growth of M.aeruginosain different trophic status

圖2 喜旱蓮子草的培養液在不同培養時間下的pH變化Fig.2 pH variation of cultivated solution of A.philoxeroides at different cultivated period A:活體植株 Living plants;B:殘體植株 Dead plants.
2.3 喜旱蓮子草培養水體氧化還原電位變化
喜旱蓮子草的活體植株培養液和殘體植株腐解液的氧化還原電位隨時間發生顯著變化,且兩者氧化還原電位變化趨勢不同(圖3)。喜旱蓮子草活體植株蒸餾水培養液的氧化還原電位的總變化趨勢是先逐漸下降到最低點再逐漸上升。喜旱蓮子草活體植株富營養化湖水培養液的氧化還原電位總變化趨勢是先緩慢上升后逐漸下降。喜旱蓮子草活體植株標準BG11培養液的氧化還原電位也是先緩慢上升,但后期大幅下降。喜旱蓮子草殘體植株的3類水體環境腐解液的氧化還原電位變化趨勢基本一致,都是逐漸下降的,按降序來排列大致順序為:蒸餾水>標準BG11營養液>富營養化湖水。總之,活體植株培養液的氧化還原電位變化較緩,按降序來排列大致順序為:蒸餾水>富營養化湖水>標準BG11營養液,其氧化還原電位值大部分比殘體植株腐解液氧化還原電位值高;殘體植株腐解液的氧化還原電位值變化幅度較大,且氧化還原電位值隨時間推移逐漸降低(圖3)。

圖3 喜旱蓮子草的培養液在不同培養時間下的氧化還原電位的變化Fig.3 Oxidation and reduction potential variation of cultivated solution of A.philoxeroides at different cultivated period A:活體植株 Living plants;B:殘體植株 Dead plants.
3 討論
3.1 喜旱蓮子草對銅綠微囊藻生長特性的影響
植物化感物質的釋放途徑主要包括植物揮發、根系分泌、雨霧淋溶、殘株分解等[13,14]。因此推測喜旱蓮子草活體植株主要通過根系分泌方式釋放化感物質,而殘體植株主要采用腐解方式釋放化感物質。本研究發現入侵植物喜旱蓮子草的活體植株和殘體植株培養液均對銅綠微囊藻的生長和繁殖表現出一定的化感抑制效應,且喜旱蓮子草的殘體植株腐解液比活體植株種植水對銅綠微囊藻的生長抑制效應更強。喜旱蓮子草活體植株在不同水體培養環境下化感作用強弱關系,按降序排列為:蒸餾水>富營養化湖水>標準BG11營養液。孔垂華等[15]認為在缺水、缺肥等環境脅迫條件下,植物可以通過釋放化感物質的方式抑制周圍其他植物的生長,從而增加其對養分、水分等的相對競爭能力。蒸餾水中培養的活體植株正是在缺肥的環境脅迫下,釋放大量化感物質抑制周圍其他植物生長,其種植水對銅綠微囊藻生長抑制效應最強;同樣,在富營養化湖水中培養的活體植株由于其營養物質過剩,也會釋放大量化感物質,但對銅綠微囊藻的抑制效應比蒸餾水培養液要弱;而在營養成分適中的BG11培養液生長的喜旱蓮子草由于不受任何環境因子脅迫,釋放的化感物質量最少,其化感指數也最低。研究還發現喜旱蓮子草殘體植株在不同水體培養環境下所呈現的化感作用也存在明顯的強弱關系,其順序為:富營養化湖水>標準BG11營養液>蒸餾水。而3種不同營養狀態下的水體環境中的營養成分排列順序也為:富營養化湖水>BG11培養液>蒸餾水。這表明營養物質中某些成分可能會加快殘體植株分解的速度和程度,所以在營養物質含量越高的情況下,殘株越容易腐解釋放大量化感物質,抑制銅綠微囊藻的生長和繁殖。
3.2 培養水體性質pH和氧化還原電位對化感抗藻的影響
pH值是藻類生長的非常重要的理化指標。一般認為,藍藻偏好較高的pH[16],但本實驗發現在酸性pH和堿性pH條件下的活體植株培養液和殘體植株腐解液均對銅綠微囊藻有很好的抑制效應,只是在低pH環境條件下,殘株腐解液的抑藻效應表現得更強烈些。本研究中的喜旱蓮子草殘體植株腐解液比活體植株培養液對銅綠微囊藻的生長抑制效應更強,殘體植株可能分解產生更多的酸性化感物質,pH值開始下降,導致藻的生長受到抑制,而后pH值又慢慢趨于穩定,抑藻效應也隨之趨于穩定。目前還未見氧化還原電位變化與水生植物化感物質釋放強度關系的相關報道。本研究中喜旱蓮子草活體植株培養液氧化還原電位變化較緩,而殘體植株腐解液的氧化還原電位表現為持續下降,這可能是活體植株培養液釋放化感物質速率較慢,量較少,而殘體植株腐解液釋放化感物質較快,量較多。喜旱蓮子草的殘體植株可能釋放一些具有還原性化學物質,消耗了水中氧化性物質,所以導致出現培養液中氧化還原電位緩緩下降現象,這些物質具體化學成分還需進一步分析。
[1]Hong Y,Hu H Y.Effects of the aquatic extract ofArundodonaxL.(giant reed)on the growth of freshwater algae[J].Allelopathy Journal,2007,20(2):315-325.
[2]Sutfeld R,Petereit F,Nahrstedt A.Resorcinol in exudates ofNupharlutea[J].Journal of Chemical Ecology,1996,22:2221-2231.
[3]Li F M,Hu H Y.Allelopathic effects of different macrophytes on the growth ofMicrocystisaeruginosa[J].Allelopathy Journal,2005,15(1):145-152.
[4]俞子文,孫文浩,郭克勤,等.幾種高等水生植物的克藻效應[J].水生生物學報,1992,16(1):1-7.
[5]Nakai S,Inoue Y,Hosomi M,etal.Myriophyllumspicatum-released allelopathic polyphenols inhibiting growth of bluegreen algae,Microcystisaeruginosa[J].Water Research,2000,34(11):3026-3032.
[6]Julien M,Skarratt B,Maywald G F.Potential geographical distribution of alligator weed and its biological control byAgasicleshygrophila[J].Journal of Aquatic Plant Management,1995,33:55-60.
[7]Shelley B,Andrew N.Alligator weed(Alternantheraphiloxeroides)in New South Wales,Australia:A status report[J].Weed Biology and Management,2008,(8):284-290.
[8]Wang N,Yu F H,Li P X,etal.Clonal integration supports the expansion from terrestrial to aquatic environments of the amphibious stoloniferous herbAlternantheraphiloxeroides[J].Plant Biology,2009,(11):483-489.
[9]Tan W Z,Li Q J,Qing L.Biological control of alligatorweed(Alternantheraphiloxeroides)with aFusariumsp.[J].Bio-Control,2002,(47):463-479.
[10]Naqvi S M,Rizvi S A.Accumulation of chromium and copper in three different soils and bioaccumulation in an aquatic plant,Alternantheraphiloxeroides[J].Bulletin of Environmental Contamination and Toxicology,2000,65:55-61.
[11]劉愛榮,張遠兵,張雪梅,等.空心蓮子草水浸液對黑麥草和高羊茅種子發芽和幼苗生長的影響[J].草業學報,2007,16(5):96-101.
[12]Williamson G B,Richardson D.Bioassays for allelopathy:measuring treatment responses with independent controls[J].Journal of Chemical Ecology,1988,14(1):181-187.
[13]孔垂華,徐濤,胡飛.勝紅薊化感作用研究Ⅱ.主要化感物質的釋放途徑和活性[J].應用生態學報,1998,9(3):257-260.
[14]張悅麗,秦立琴,高興祥,等.小根蒜對花生田3種主要雜草馬唐、稗草和反枝莧的化感作用[J].草業學報,2010,19(5):57-62.
[15]孔垂華,徐濤,胡飛,等.環境脅迫下植物的化感作用及其誘導機制[J].生態學報,2000,20(5):849-854.
[16]劉春光,金相燦,孫凌,等.pH值對淡水藻類生長和種類變化的影響[J].農業環境科學學報,2005,24(2):294-298.

