牦牛尿嘌呤衍生物排出量對皺胃注射酵母RNA水平的響應
王虎成,葉得河,周建偉,龍瑞軍*
(1.草地農業生態系統國家重點實驗室 蘭州大學草地農業科技學院,甘肅 蘭州730020;2.甘肅農業大學動物醫學院,甘肅 蘭州730070)
牦牛是分布在青藏高原及周邊地區特有的家畜遺傳資源。中國現有牦牛1 400多萬頭,約占世界牦牛總數的92%[1]。牦牛同當地藏族及其他少數民族的生產、生活、文化、宗教等有著密切的關系,發展牦牛業對提高藏族及其他少數民族的生活水平有著十分重要的意義。由于其獨特的生物學特性,決定了牦牛是唯一能充分利用青藏高原天然草地資源進行動物性生產的牛種,因此在其分布地區具有不可替代的生態和經濟學地位。特別是在地球生態環境日益惡劣、稀有物種不斷消失的今天,以牦牛、藏羊為主體的高寒生態生產體系所具有的潛力及面臨的危機,已引起了世人廣泛的重視[2-5]。多年來,廣大科研工作者在牦牛營養學方面進行了能量代謝[6-9]、瘤胃消化生理[10-12]、氮代謝及補氮技術的研究[8,13],填補了該畜種營養領域的空白。最近研究亦揭示了牦牛在牧食行為[14]、代謝物腎臟調控[15]和采食器官形態結構[16]諸方面有別于黃牛的高原適應機制,但受高原氣候及牦牛生活習性的影響,傳統營養學方法的應用正面臨著挑戰。Topps和Elliot[17]研究發現尿嘌呤衍生物排出量與小腸吸收微生物蛋白數量存在相關性,Verbic等[18]通過給閹牛皺胃連續灌注微生物核酸,發現有77%核酸以尿囊素和尿酸的形式被排出,通過皺胃注射嘌呤堿基,許多試驗室已測定了注射嘌呤在尿中回收率,并進一步建立相關模型,基于此類模型,利用尿嘌呤衍生物估測瘤胃微生物產量模型亦被建立[19-24]。但模型的相關參數因動物種屬及生境而存在差異[25-29]。基于牦牛所處生活環境的獨特性,以及利用尿嘌呤衍生物估測瘤胃微生物產量模型的特異性,本研究旨在借助皺胃瘺管注射技術,以酵母RNA為嘌呤堿基供體,測定牦牛吸收嘌呤回收率,為建立快速、高效監測牦牛瘤胃微生物蛋白產量方法(purine derivative,PD法)奠定量化基礎,以期改善放牧牦牛管理系統,使青藏高原草地生態系統服務功能[30]得以有效體現。
1 材料與方法
1.1 試驗動物及皺胃手術
1.1.1 動物 2010年4月于天祝藏族自治縣白牦牛產區選取體況相近的3頭成年閹牦牛,在烏鞘嶺試驗站舍飼1周后進行皺胃瘺管手術,經30d康復后進行皺胃注射試驗,試驗期室內平均溫度5℃,相對濕度為60%。
1.1.2 牦牛皺胃瘺管手術 皺胃瘺管:選擇中國農業大學肉牛研究中心研制的中號T-型瘺管(內徑1.7cm,高9.8cm,長9.7cm),對基部做適當修整,以利于更緊地貼于胃內壁。
術前準備:術前禁食24h,禁水12h。腹肋骨下緣皺胃區常規剪毛,術野面積為20cm×25cm,刮凈毛茬。手術器械、紗布和創巾等均高壓滅菌消毒,瘺管用溫水配制的0.1%新潔爾滅溶液浸泡消毒。
麻醉與保定:首先拴系固定試牛頭部,注射硫酸阿托品溶液2~5mL,15min后注射2% 靜松靈5~10mL進行全身麻醉,使牛左側臥倒下,將牛于蹄部分前后綁定,頭部專人壓定。手術人員常規消毒,術部先用5%的碘酊消毒,再用75%的酒精脫碘。然后于牛左、右側均施行腰旁神經傳導麻醉結合術部浸潤麻醉。腰旁神經傳導麻醉包括麻醉最后肋間神經、髂下腹神經和髂腹股溝神經。刺入點分別為第一腰椎橫突游離端前緣、第二腰椎橫突游離端后緣和第四腰椎橫突游離端后緣,垂直皮膚進針,每點深達骨面后沿骨緣下行1.0cm后注入2%的普魯卡因溶液10mL。在左側預行切口線部位分兩點注射0.5%的普魯卡因20mL浸潤麻醉。
瘺管安裝:術野部做一與最后肋骨平行的10cm切口,用手術刀柄按肌纖維走向鈍性剝離腹外斜肌、腹內斜肌和腹直肌,切開腹膜,打開腹腔,將手伸入腹腔找到皺胃,將其順勢小心拉出,用腸鉗夾住皺胃,并用生理鹽水浸泡的滅菌紗布繞其下部塞住切口。在皺胃腹側部血管稀疏處做荷包縫合,于縫合圈內做一約4cm切口,置入瘺管底座,擰緊瘺管冒,雙層荷包縫合,將腸道切口漿膜內翻,套上圓形夾片,以無菌生理鹽水(每500mL生理鹽水內加160IU青霉素和80IU鏈霉素)沖洗手術創口后還納胃部于腹腔,逐層縫合肌肉大切口,在原切口皮膚層后方作一略小于直管外徑(1.5cm)的小切口,用組織鉗拉出瘺管,縫合皮膚大切口,隨后用外夾片固定瘺管,創口外用碘酊進行常規消毒。
術后護理:肌注320萬IU青霉素和100萬IU鏈霉素,連續注射7d,每天2次。動物立即飲用溫水,并在術后第1周喂以少量易消化的日糧,隨后飼喂試驗飼糧20d。術后當日開始每天于創口周圍用酒精或碘酊棉球擦洗2遍。直到傷口愈合并拆線。
1.2 試驗日糧及調制
試驗期基礎日糧由豌豆秸稈草粉、豌豆和青稞面構成,每頭牛每天飼喂2.4kg全價飼糧,分別于8:00和17:00分2次飼喂。每次飼喂前按60%草粉+15%豌豆+34%青稞面+1%的復合添加劑(微量元素Co、Cu、I、Fe、Mn、Se、Zn含量依次為0.03,2.75,0.15,3.08,3.50,3.08,10.75mg/kg;維生素 A、D、E含量依次為921.0,251.0,6.4IU/kg)配比,加少量水拌勻后飼喂給試畜,試驗期動物自由飲水。
1.3 嘌呤堿基
1.3.1 試劑 酵母 RNA (ribonucliec acid from torula yeast,Sigma R6625,CAS 63231-63-0)為嘌呤堿基(purine base,PB)供體,含量為1.4mmol PB/g RNA。
1.3.2 溶液配制及注射 于注射前1d配制注射液。稱取一定量酵母RNA于400mL 0.1mol/L氫氧化鈉溶液,40℃攪拌溶解,用蒸餾水定容至1 000mL,濃鹽酸調節pH值為5~6,4℃儲存至次日注射。用蠕動泵(BT00-100M)將PB溶液以0.7mL/min流速經皺胃瘺管注入動物體內。
1.4 試驗設計
本試驗參照Guerouali等[31]方案執行,分15d基礎日糧適應期和20d注射期。其中注射期為4個處理(PB日均注射量分別為0,14,30,52mmol/d),2個重復,每個處理適應2d、采樣3d,共4期合計20d。
1.5 樣品采集及分析
依國際原子能機構(International Atomic Energy Agency,IAEA)試驗程序全收集尿樣[32];尿肌酐、尿嘌呤衍生物(尿囊素和尿酸)測定參照李曉鵬等[33]的方法;尿氮測定參照楊勝[34]的方法。
1.6 回收率計算
回收率 (%)=100×(PDi-PD0)/(PBi-PB0),式中,PDi為第i期尿嘌呤衍生物排出量;PD0為第1期尿嘌呤衍生物排出量;PBi為第i期嘌呤堿基注射量;PB0為第1期嘌呤堿基注射量;i=2,3,4。
1.7 數據分析
利用SPSS 13.0線性回歸方法建立嘌呤衍生物排出量與注射嘌呤之間的等式。處理效應按程序GLM(general linear models)由多項式比較(polynomial contrasts)實現,顯著水平為P<0.05。
2 結果與分析
2.1 試驗動物體況
3頭動物于第一期同時參加試驗,2d預注射發現,其中1頭動物應激性較強,故退出試驗。另外2頭動物整個注射期一切正常,且試驗前后體重無明顯變化。
2.2 牦牛皺胃嘌呤注射量與尿嘌呤衍生物排出量關系
在連續注射嘌呤堿基條件下,牦牛尿嘌呤衍生物由尿囊素和尿酸組成,且各試驗期動物尿樣未檢出黃嘌呤和次黃嘌呤(表1)。回歸分析發現,牦牛皺胃嘌呤注射量(X,mmol/d)與尿嘌呤衍生物排出量(Y,mmol/d)間存在如下關系:Y=0.85X+33.02(R2=0.96,n=8,P<0.001)。
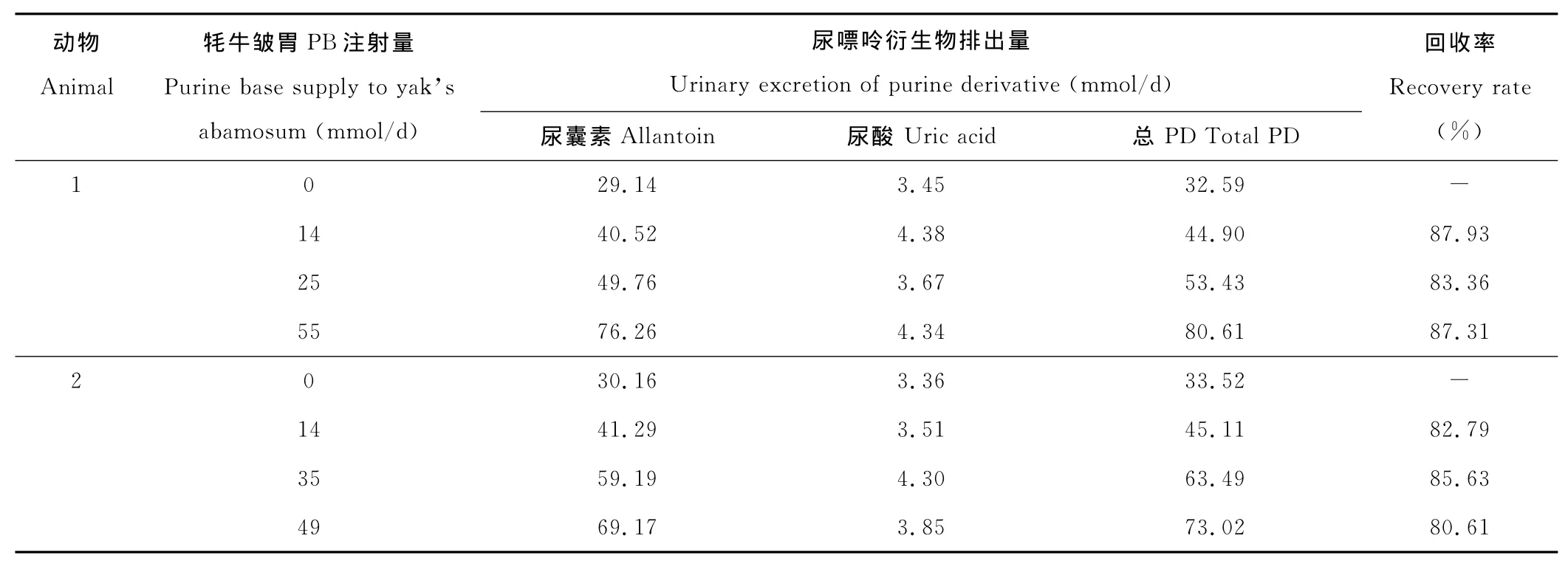
表1 牦牛皺胃嘌呤注射量與尿嘌呤衍生物排出量間關系Table 1 Urinary excretion of PD in relation to purine supply to abamosum in yak
2.3 牦牛皺胃嘌呤注射量對尿嘌呤衍生物、肌酐及尿氮排出量的影響
牦牛皺胃連續注射酵母RNA可導致尿中尿囊素(564~1 426μmol/kg BW0.75)(表2)、總嘌呤衍生物排出量(629~1 507μmol/kg BW0.75)及尿囊素占總PD比例(0.90~0.95)線性提高(P<0.01);尿酸所占比例(0.10~0.05)則線性降低(P<0.001);PB注射水平對尿酸、肌酐及尿氮排出量影響不顯著(P>0.05)。

表2 牦牛皺胃嘌呤注射量對尿嘌呤衍生物,肌酐及尿氮日排出量的影響Table 2 Effect of abamosum purine infusion level on daily urinary excretion of purine derivatives,creatinine and nitrogen of yak
3 討論
3.1 牦牛外源性嘌呤供給量對尿嘌呤衍生物組成的影響
本研究結果表明,牦牛連續注射嘌呤堿基并不影響尿嘌呤衍生物的組分(尿囊素和尿酸),且尿囊素為主要的構成部分(≥0.90),但其構成比例則會受到顯著影響。總體趨勢為隨嘌呤堿基注射量的增加,尿囊素比例顯著升高(P=0.002),而尿酸所占比例變化趨勢與之相反(P<0.001)。下列研究也有類似的發現:Pimpa等[29]給黃牛(Bosindicus)十二指腸連續注射腺苷和鳥苷發現,隨著PB注射量的增加(0~45mmol/d),尿囊素占總PD比例線性增加(0.75~0.90),尿酸所占比例線性降低(0.22~0.09);Chen等[19]給綿羊皺胃注射PB(0~45mmol/d),尿囊素占總PD比例線性增加(0.56~0.81),尿酸所占比例線性降低(0.27~0.10)。上述趨勢基于嘌呤堿基在體內的代謝規律,亦即,進入血液的一部分外源性嘌呤通過補救合成途徑合成核酸補充組織損失,而另一部分則被降解為嘌呤衍生物隨尿排出體外,由于動物體絕大部分黃嘌呤氧化酶存在于肝臟和腸粘膜,當嘌呤堿基經過腸粘膜時被脫氨基氧化生成尿酸,因而動物通過補救合成組織核酸的幾率很小,需經過直接合成途徑以補償組織的核酸損失,但是當動物被動的給予遞增的外源補給量時,則利用外源性嘌呤合成體核酸以補償代謝損失。因此利用PD估測反芻動物微生物蛋白產量時應以其總量為參數,而非單一尿囊素數值,尤其在飼養水平較低時更應如此。
3.2 牦牛外源性嘌呤供給量與尿嘌呤衍生物排出量關系
反芻動物血漿中嘌呤衍生物來源于體組織核酸的周轉及從腸道吸收而未用于合成體組織的外源性嘌呤。盡管血漿中嘌呤衍生物可通過腎臟排出體外,也可通過非腎臟途徑如唾液、奶和腸分泌物等分泌。大量研究結果表明,隨外源性嘌呤供給量的增加,反芻動物尿嘌呤衍生物排出量亦線性提高。Belenguer等[35]給山羊注射0~17 mmol/d外源性嘌呤,則總尿嘌呤衍生物排出量從11.42增至26.07mmol/d;Chen等[19]給綿羊皺胃注射0~45 mmol/d PB,則PD排出量從2.06增至19.02mmol/d。更多的研究也表明尿中嘌呤衍生物的排出量與十二指腸核酸量或注入皺胃的核酸量相關,已建立的模型能很好地量化注入綿羊、山羊、牛皺胃或十二指腸中核酸量與嘌呤衍生物排出量間的關系[19-21,35]。與此同時,Chen等[19]和 Balcells等[20]相繼發現,綿羊和山羊因體組織酶活差異性,用曲線模型更能確切地描述二者的關系,并指出吸收嘌呤在尿中的回收率為0.84,由吸收的外源嘌呤補救方式合成代替直接合成的速率常數為-0.25,當吸收的外源嘌呤量為0時,尿中排出內源嘌呤衍生物量為0.15 mmol/kg BW0.75。然而,由于牛血液及組織中黃嘌呤氧化酶的活性較高,尿中排出嘌呤衍生物的數量與吸收嘌呤的數量關系與羊不同。本研究嘌呤回收率(0.85)與早期他人研究結果:0.85[18,26],0.86[36],0.84[37]一致。Wang等[15]絕食代謝研究結果表明,牦牛內源性尿嘌呤衍生物日排出量為134μmol/kg BW0.75,基于本研究回收率參數,則牦牛吸收嘌呤(X,mmol/d)與尿嘌呤衍生物排出量(Y,mmol/d)的數學模型為:Y=0.85X+0.134kg BW0.75。
3.3 牦牛瘤胃微生物氮產量估測模型
Topps和Elliot[17]首次發現瘤胃內容物中核酸濃度與尿中尿囊素排出量呈正相關關系。進一步研究表明,由于日糧中核酸在瘤胃中快速降解,故進入十二指腸的核酸主要來自微生物,而微生物氮75%~85%以蛋白質、肽或游離氨基酸形式存在,15%~25%存在于核酸中[38,39]。Chen等[19]指出,應該使用總嘌呤衍生物(尿囊素、尿酸、黃嘌呤和次黃嘌呤,即PD在尿中的排泄量)作為估測參數,而非單一尿囊素,尤其當動物的采食量較低時更應如此。本研究結果發現牦牛尿囊素所占比例隨嘌呤吸收量的增加而變化,進而表明利用總PD估測瘤胃微生物氮產量的合理性。Chen和Gomes[40]提出利用以下等式計算進入小腸的微生物氮(MN,g/d)流量:MN=(X×70)/(0.83×0.116×1000)=0.727X,式中,X為小腸所吸收的外源嘌呤數量;70指每毫摩爾嘌呤含70mg氮;0.83指微生物核酸的消化率;0.116指混合微生物中嘌呤氮占總氮的11.6%。Ellis和Pfander[41]指出,瘤胃細菌嘌呤氮與細菌總氮比值十分恒定,變化范圍為10%~15%,Leng和Nolan[42]研究結果為8%~15%。韓興泰等[10]指出在能蛋比例固定條件下,日糧精粗比和日糧氮源不會明顯影響牦牛瘤胃細菌嘌呤氮與微生物總氮的比值,然而日糧粗蛋白質水平卻顯著影響該比值,當日糧粗蛋白質水平為12%時,瘤胃細菌粗蛋白質含量為37%,嘌呤氮占微生物總氮的比值為0.15,而當日糧粗蛋白水平降至8%時,瘤胃細菌粗蛋白質含量為29%,嘌呤氮占微生物總氮的比值為0.33。
本研究建立了牦牛吸收嘌呤與尿嘌呤衍生物排出量的數學模型,解決了利用尿嘌呤衍生物估測瘤胃微生物蛋白產量瓶頸問題,但受牦牛產區牧草產量及質量隨季節而劇烈變化,牦牛瘤胃細菌嘌呤氮與細菌總氮比值參數亦不盡一致,已有模型并不完全適應于牦牛生產實際,相關研究有待進一步深入和完善。
[1]常祺,劉滿香.青藏高原牦牛競爭力研究報告[J].青海畜牧獸醫雜志,2002,32(6):22-25.
[2]柴永清,曹致中.草地農業生態系統4個生產層理論對肅北縣畜牧業可持續發展的指導[J].草業科學,2010,27(4):160-164.
[3]周刊社,杜軍,袁雷,等.西藏怒江流域高寒草甸氣候生產潛力對氣候變化的響應[J].草業學報,2010,19(5):17-24.
[4]李東,黃耀,吳琴,等.青藏高原高寒草甸生態系統土壤有機碳動態模擬研究[J].草業學報,2010,19(2):160-168.
[5]淡瑞芳,張海濤,龍瑞軍,等.藏系綿羊瘤胃細菌數量及其放牧地牧草養分隨季節變化的研究[J].草業學報,2009,18(1):100-104.
[6]韓興泰,胡令浩.生長牦牛能量代謝的研究[J].青海畜牧業,1993,(1):13-16.
[7]胡令浩,謝敖云.不同海拔高度下生長牦牛絕食代謝的研究[J].青海畜牧獸醫雜志,1992,22(2):1-5.
[8]董世魁,龍瑞軍.不同采食水平下舍飼干奶牦牛能量轉化,氮、鈣和磷代謝的研究[J].草業學報,2000,9(2):32-37.
[9]韓興泰,胡令浩.粗飼條件下生長牦牛能量代謝的估測[J].青海畜牧獸醫雜志,1992,22(2):21-22.
[10]韓興泰,胡令浩,謝敖云,等.牦牛瘤胃細菌中核糖核酸含量及其與細菌總氮比值的研究[J].動物營養學報,1998,10(2):35-39.
[11]李林,薛白.控釋尿素對牦牛瘤胃氨氮和微生物蛋白質的影響[J].中國草食動物,2007,27(3):10-11.
[12]胡令浩,謝敖云.生長期牦牛瘤胃消化代謝的研究:II.飼喂氨化麥秸對牦牛瘤胃代謝的影響[J].青海畜牧獸醫雜志,1989,(3):11-13.
[13]薛白,柴沙駝.生長期牦牛蛋白質需要量的研究[J].青海畜牧獸醫雜志,1994,24(4):1-4.
[14]Ding L M,Long R J,Shang Z H,etal.Feeding behaviour of yaks on spring,transitional,summer and winter pasture in the alpine regionof the Qinghai-Tibetan plateau[J].Applied Animal Behaviour Science,2008,111:373-390.
[15]Wang H C,Long R J,Zhou W,etal.A comparative study on urinary purine derivative excretion for yak(Bosgrunniens),cattle(Bostaurus)and crossbred (Bosgrunniens×Bostaurus)in Qinghai-Tibetan plateau[J].Journal of Animal Science,2009,87:2355-2362.
[16]Shao B P,Long R J,Ding Y P,etal.Morphological adaptations of yak(Bosgrunniens)tongue to the foraging environment of the Qinghai-Tibetan Plateau[J].Journal of Animal Science,2010,88:2594-2603.
[17]Topps J H,Elliot R C.Relationship between concentrations of ruminal nucleic acids and excretion of purine derivatives by sheep[J].Nature(London),1965,2005:498-499.
[18]Verbic J,Chen X B,MacLeod N A,etal.Effect of microbial nucleic acid infusion on purine derivative excretion by steers[J].Journal of Agricultural Science,1990,114(3):243-248.
[19]Chen X B,Hovell F D,rskov E R,etal.Excretion of purine derivatives by ruminants:effect of exogenous nucleic acid supply on purine derivative excretion by sheep[J].British Journal of Nutrition,1990,63(1):131-142.
[20]Balcells J,Guada J A,Castrillo C,etal.Urinary excretion of allantoin and allantoin precursors by sheep after different rates of purine infusion into the duodenum[J].Journal of Agriculture Science,1991,116(2):309-317.
[21]Fujihara T,rskov E R,Reeds P J,etal.The effect of protein infusion on urinary excretion of purine derivatives in ruminants nourished by intragastric nutrition[J].Journal of Agricultural Science,1987,109(1):7-12.
[22]Antoniewicz A M,Pisulewski P M.Measurements of endogenous allantoin excretion in sheep urine[J].Journal of Agricultural Science,1982,98:221-223.
[23]Perez J F,Rodriguez C A,Gonzalez J,etal.Contribution of dietary purine bases to duodenal digesta in sheep[J].Animal Feed Science Technology,1996,62(4):251-262.
[24]Belenguer A,Yanez D,Balcells J,etal.Urinary excretion of purine derivatives and prediction of rumen microbial outflow in goats[J].Livestock Production Science,2002,77(2):127-135.
[25]Liang J B,Matsumoto M,Young B A.Purine derivative excretion and ruminal microbial yield in Malaysian cattle and swamp buffalo[J].Animal Feed Science and Technology,1994,47(4):189-199.
[26]Pimpa O,Liang J B,Jelan Z A,etal.Urinary excretion of duodenal purine derivatives in Kedah-Kelantan cattle[J].Animal Feed Science and Technology,2001,92(3):203-214.
[27]Vercoe J E.Urinary allantoin excretion and digestible dry-matter intake in cattle and buffalo[J].Journal of Agricultural Science,1976,86(3):613-615.
[28]Liang J B,Young B A.Comparative energetic efficiencies of male Malaysian cattle and buffalo[J].Livestock Production Science,1995,41(1):19-27.
[29]Pimpa O,Liang J B,Balcells J Q.Absorption of nucleic acid from the small intestines of swamp buffaloes and zebu cattle[J].Silpakorn Uuniversity Science and Technology Journal,2007,1(1):26-35.
[30]龍瑞軍.青藏高原草地生態系統之服務功能[J].科技導報,2007,25(9):26-28.
[31]Guerouali A,Gass Y E,Balcells J,etal.Urinary excretion of purine derivatives as an index of microbial protein synthesis in the camel(Camelusdromedarius)[J].British Journal of Nutrition,2004,92(2):225-232.
[32]IAEA.Estimation of Basal Purine Excretion,in Estimation of Rumen Microbial Protein Production from Purine Derivatives in Urine[M].Vienna:International Atomic Energy Agency,1997:21-24.
[33]李曉鵬,周圍,王虎成,等.高效液相色譜法對牦牛血漿與尿中嘌呤衍生物及肌酐含量的測定[J].分析測試學報,2009,28(7):867-861.
[34]楊勝.飼料分析及飼料質量檢測技術[M].北京:農業大學出版社,1993.
[35]Belenguer A,Yanez D,Balcells J,etal.Urinary excretion of purine derivatives and prediction of rumen microbial outflow in goats[J].Livestock Production Science,2002,77(3):127-135.
[36]Vagnoni D B,Broderick G A,Clayton M K,etal.Excretion of purine derivatives by Holstein cows abomasally infused with incremental amounts of purines[J].Journal of Dairy Science,1997,80(8):1695-1702.
[37]Orellana B P,Balcells J,Martn-Orúe S M,etal.Excretion of purine derivatives in cows:Endogenous contribution and recovery of exogenous purine bases[J].Livestock Production Science,2001,68(3):243-250.
[38]Smith R H,McAllan A B.Nucleic acid metabolism in the ruminant:Amounts of nucleic acids and total and ammonia nitrogen in digesta from the rumen,duodenum and ileum of calves[J].British Journal of Nutrition,1971,25(1):181-190.
[39]McAllan A B.The fate of nucleic acids in ruminants[J].Proceedings of the Nutrition Society,1982,41(3):309-316.
[40]Chen X B,Gomes M J.Estimation of Microbial Protein Supply to Sheep and Cattle Based on Urinary Excretion of Purine Derivatives-an Overview of the Technical Details[M].Bucksburn Aberdeen:International Feed Resources Unit,1992.
[41]Ellis W C,Pfander W H.Rumen microbial polynucleotide synthesis and its possible role in ruminant nitrogen utilization[J].Nature,1965,205(4975):974-975.
[42]Leng R A,Nolan J V.Nitrogen metabolism in the rumen[J].Journal of Dairy Science,1984,67(5):1072.

