TiO2納米管修飾鎳電極及其光催化輔助電解水制氫性能研究
何洪波 常 明 陳愛平馬 磊 董海軍 李春忠
(華東理工大學材料科學與工程學院,超細材料制備與應用教育部重點實驗室,上海 200237)
TiO2納米管修飾鎳電極及其光催化輔助電解水制氫性能研究
何洪波 常 明 陳愛平*馬 磊 董海軍 李春忠
(華東理工大學材料科學與工程學院,超細材料制備與應用教育部重點實驗室,上海 200237)
本文通過水熱法制備二氧化鈦納米管(TiO2NT),并用制備的TiO2NT對堿性電解水制氫裝置的鎳片陽極進行修飾,在電解水的基礎上,通過光催化與電解過程的耦合,提出并實現了光催化輔助電解水制氫過程。通過XRD、UV-Vis、FE-SEM、AFM和光催化輔助電解水制氫等方法對試樣的結構和性能進行了表征和測試。結果表明,在紫外光照條件下,用TiO2NT修飾鎳片陽極的光催化輔助電解水過程的產氫速率比單純電解水提高了61%。
TiO2納米管;鎳電極修飾;電解水;光催化;制氫
能源危機和環境污染是當今社會發展面臨的嚴峻挑戰。氫能因其高效和清潔被普遍推崇為最適當的能源載體。氫氣是二次能源,在目前各種制氫技術中,電解水制氫工藝成熟,從環保和原料的角度被視為通向氫經濟的較佳途徑[1-4]。
1972年日本學者Fujishima和Honda[5]對光照二氧化鈦電極導致水分解產生氫氣這一現象的發現,揭示了利用太陽能裂解水制氫的可能性,其巨大的應用前景立即吸引了全世界眾多研究者從事半導體光電化學制氫的研究[6-8]。現有的光電化學制氫研究,都是以光催化為基礎,通過施加較低的直流偏壓(一般都低于1 V,遠低于電解水所需的理論電壓1.23 V)構成電輔助光催化過程。雖然圍繞光催化劑設計和篩選[9-14]、添加氫犧牲劑的電解質溶液的選擇、采用真空抽氣等特殊的制氫工藝、以及通過施加較低的直流偏壓構成電輔助光催化過程 (光電化學制氫過程)等方面,進行了大量的工作,但以光催化為基礎的分解水制氫過程的量子效率沒有根本性的突破[15-16]。
將太陽能利用與電解水制氫結合在一起的工作,主要集中在如何把太陽能轉化為電能的光伏技術與電解水制氫技術相結合方面。在已工業應用的堿性電解水制氫技術的改進研究中,主要集中在篩選金屬基合金電極,達到降低電極的析氫析氧過電位、降低電耗等目的,但也沒有取得顯著的收效[17-18]。
TiO2納米管由于具有更大的比表面積、更高的吸附能力和傳導電子的能力,改善了顆粒TiO2的光電催化性能[19-22],受到了廣泛的關注。Mor[23]等報道了TiO2納米管陣列作陽極,Pt作陰極,1 V偏壓,337 nm光照等條件下,光電轉換效率IPCE超過90%。
本文改變目前光電化學制氫研究中以光催化為基礎的思路,以成熟的堿性電解水制氫技術為基礎,將TiO2納米管光催化劑涂覆在電解池的鎳片陽極上,通過光對陽極的輻照,借助納米半導體光催化劑上產生的光生空穴所具有的強氧化活性,改善電解池陽極的析氧性能,在電解池直流電壓的驅動下,光生電子及時遷移到陰極,促進陰極的析氫過程,將光催化與電解水制氫技術有機地耦合在一起,提出并實現了光催化輔助電解水制氫(WEAP)過程,提高了電解水的產氫速率。
1 實驗部分
1.1 主要試劑與儀器
采用場發射掃描電鏡(FE-SEM,日本JEOL公司JSM-6700F型)、透射電鏡 (TEM,日本JEOL公司JEM-1230型)、原子力顯微鏡(AFM,NanoScope III a MultiMode,Veeco)觀察TiO2納米管薄膜的形貌;利用X射線衍射儀 (XRD,日本理學公司Rigaku D/Max 2550 VB/PC型)對二氧化鈦粉體及二氧化鈦納米管的晶相進行分析;用紫外-可見吸收分光光度計(美國Varian公司Cary500 UV-Vis Spectro photometer)進行樣品光吸收性能的測試。
試劑:Degussa 公司的 P25 TiO2(工業品),NaOH和濃鹽酸均為分析純試劑,購于國藥集團化學試劑有限公司。
1.2 TiO2納米管的制備
本實驗以水熱法[24-25]制備TiO2納米管。稱取0.5 g P25納米粉體置于裝有50 mL濃度為10 mol·L-1NaOH的內襯為聚四氟乙烯的高壓釜中,密封后放在烘箱中383 K保溫48 h后取出,自然冷卻到室溫,倒出溶液,用蒸餾水將沉淀物洗滌至中性后,在0.1 mol·L-1的稀鹽酸中超聲分散,使 Na+被 H+取代,繼續用蒸餾水洗至中性,過濾后濾餅用于涂膜。
1.3 涂 膜
取一定量的洗至中性的TiO2納米管濾餅,加入無水乙醇混合均勻,超聲分散制成TiO2涂膜漿料。將一定量的TiO2漿料滴在Ni電極基片上,使用旋轉涂膜機涂膜,待膜自然干燥后,于60℃下烘干,使膜結合更牢固。稱量等質量的P25粉末用同樣的方法在鎳片上涂膜。
1.4 光催化輔助電解水制氫實驗
在傳統的堿性水電解池的基礎上[20],設計的光催化輔助電解水制氫的實驗裝置如圖1。
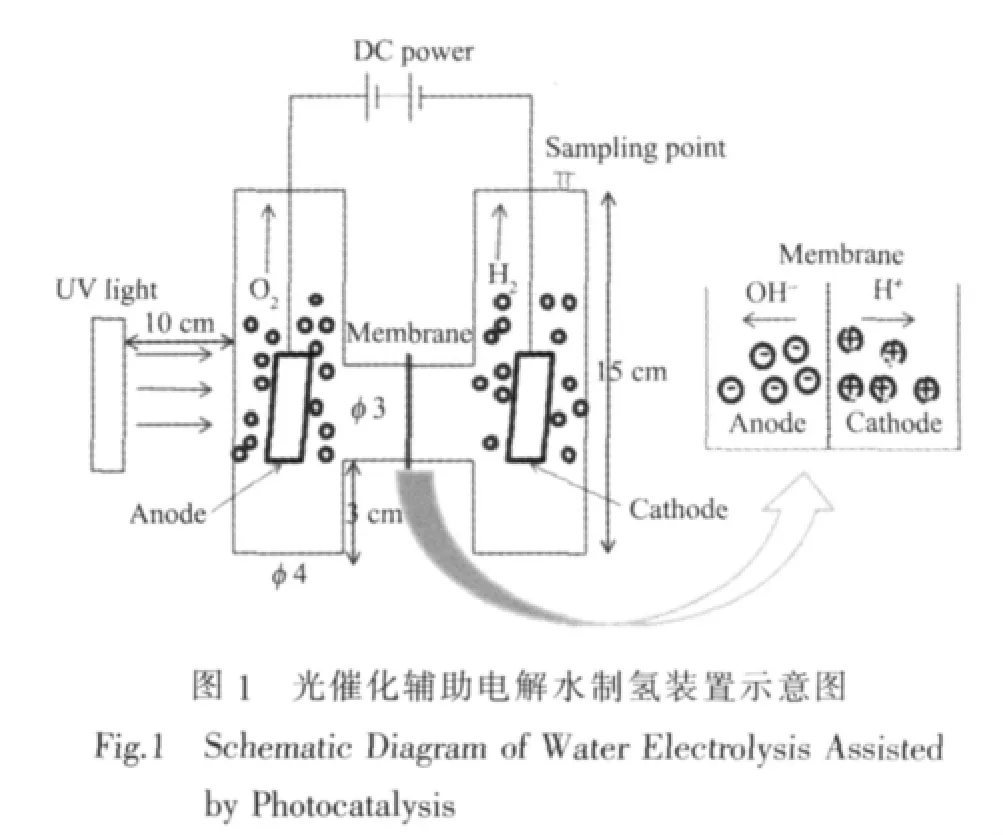
以工業化堿性水電解池為參考,采用的相關材料如下:陰極為 Ni-Cr 15×30×0.5 mm,陽極為 Ni 15×30×0.5 mm,全氟磺酸離子交換膜(φ 40 mm,厚 180 μm)作為陰極區與陽極區的隔膜,電解液為30%NaOH溶液。以TiO2光催化劑修飾的鎳片為陽極,以紫外燈(150 W,主波長365 nm,上海亞明燈泡廠)為光源輻照陽極,構成光催化輔助電解水過程。產生的氫氣量用氣相色譜法測定。氣相色譜儀以高純氮氣為載氣,使用熱導池(TCD)檢測器。配制不同體積比的氫氣標樣,進樣量為100 μL,得到氫氣含量與峰面積的關系式:
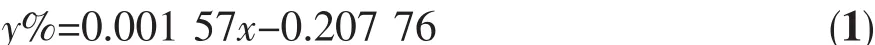
上式中y%:氫氣體積百分含量,x:色譜峰峰面積,適用的氫氣濃度范圍為0.05%~80%。
由于陰極區最初全部是空氣,當有H2生成時,陰極區的氣體為H2含量不斷增大的H2與空氣的混合物,每隔一段時間用100 μL微量注射器從陰極區取樣,注射到色譜儀中測其峰面積,用式(1)計算氫氣含量,比較產氫速率。
3 結果與討論
3.1 TiO2納米管薄膜的形貌表征
圖2a、2b分別為制備的TiO2納米管濾餅的TEM和SEM圖,可以看出P25納米顆粒經水熱反應后已全部轉化成了TiO2納米管,平均管外徑約為10 nm,納米管生長良好。從圖2c中可以看出TiO2納米管均勻地涂覆在Ni片上,管外徑約為7~12 nm,與TiO2納米管濾餅的形貌分析結果相當,說明涂膜過程不會改變TiO2納米管結構。從圖2d的膜層側面觀察可知,TiO2納米管薄膜的厚度為6~7 μm。
圖3是修飾在鎳片上的TiO2納米管薄膜的AFM表面形貌圖,分析結果顯示,薄膜表面致密,分布均勻,粗糙度(RMS)為 15.82 nm。


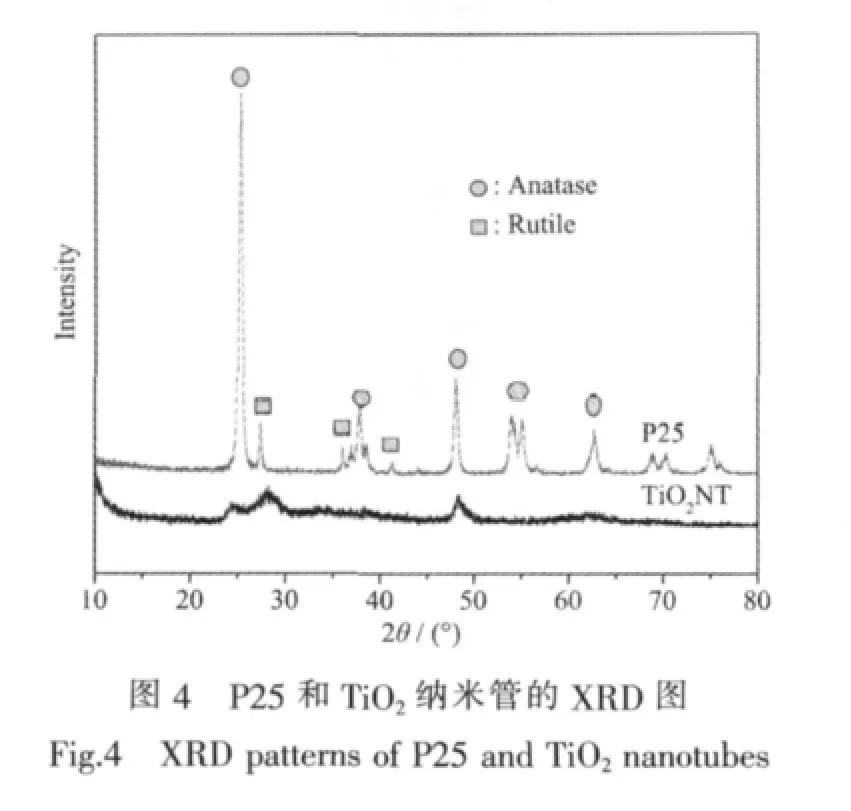
3.2 XRD分析
從圖4所示的XRD圖可以看出,原料P25是銳鈦礦相和金紅石相的混晶結構,銳鈦礦與金紅石的質量比約為80/20,而經過水熱處理轉變成TiO2納米管后,銳鈦礦與金紅石的質量比變為50/50,并且衍射峰強度顯著降低,說明結晶度顯著下降。水熱處理后生成的TiO2納米管的衍射峰變寬,表明其晶粒變小。納米級TiO2具有量子尺寸效應,顆粒變小,能隙變寬,導帶電位更負,價帶電位更正,將具有更強的氧化還原能力;對光生載流子被受體俘獲過程的研究發現,粒徑越小,光生電荷分離效率越高,則電子-空穴對復合幾率越小,有利于TiO2光催化活性的提高[21]。
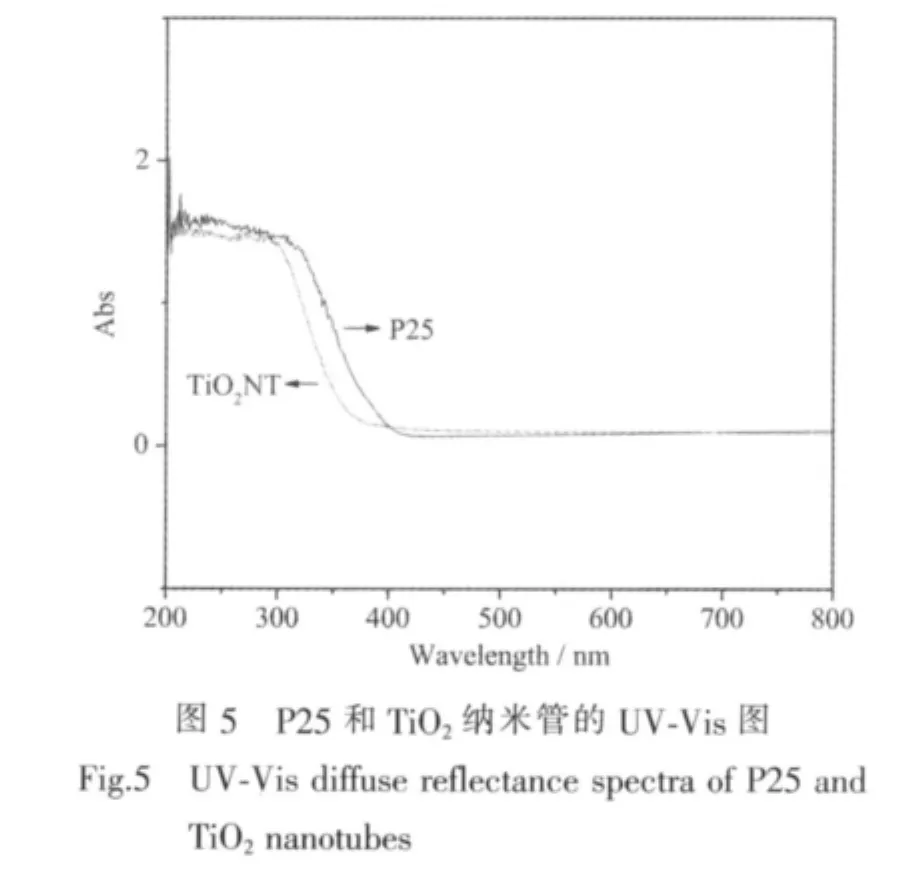
3.3 UV-Vis分析
圖5是P25和制備的二氧化鈦納米管樣品的紫外-可見吸收光譜圖,由圖可知,與原料P25相比,納米管的紫外吸收光譜發生了藍移。圖2所示的TiO2納米管的SEM形貌觀察表明,其平均管徑約為10 nm,而原料P25的粒徑為10~50 nm,表明由水熱處理制備的TiO2納米管的管壁是由很小的晶粒構成,這些晶粒的尺寸要明顯小于原料P25(與XRD中衍射峰寬化的結果一致)。納米粒子量子尺寸效應認為,小尺寸顆粒會使紅外吸收帶的精細結構消失,引起譜帶寬化,吸收峰藍移[22]。因此TiO2納米管在紫外可見吸收光譜上表現為吸收邊界相對于原料P25發生了藍移。
3.4 光催化輔助電解水制氫
圖6為不同陽極材料在有、無紫外光輻照下,陰極區氫氣濃度與時間關系的對比圖 (電解池電壓為1.7 V),對圖6進行線性擬合得到的斜率即為產氫速率R,結果列于表1。對單純鎳片(鎳片未經修飾處理)電極,紫外光輻照對其產氫效率沒有顯著影響;在無光照情況下,純Ni片作陽極與TiO2修飾陽極的產氫效率基本相同;當存在光照時,TiO2納米管修飾陽極的電解水產氫速率比P25修飾陽極提高了20%,比單純的Ni片作陽極提高了61%,從而實驗初步驗證了本文提出的光催化與電解對產氫的耦合作用的存在,并且納米管結構的二氧化鈦比顆粒狀的P25具有更高的活性。
光解水與電解水的耦合作用如以下電極反應所示:
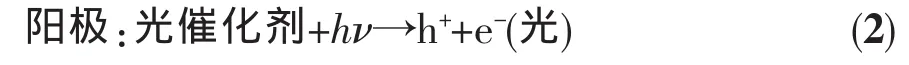
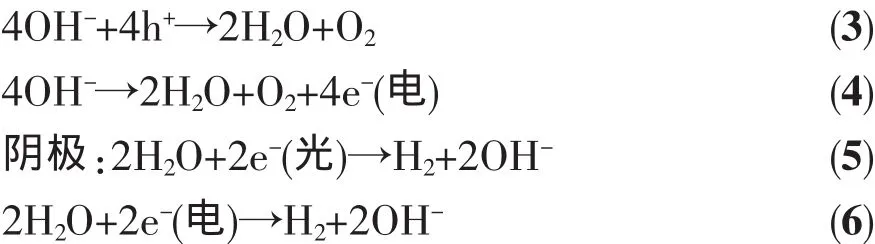
hⅤ、h+、e-(光)和 e-(電)分別代表光子、光生空穴、光生電子和直流電源貢獻的電子。(2)、(3)和(5)是光催化過程,(4)和(6)是電解過程,在光催化輔助電解水中,同時發生了光催化和電解過程。
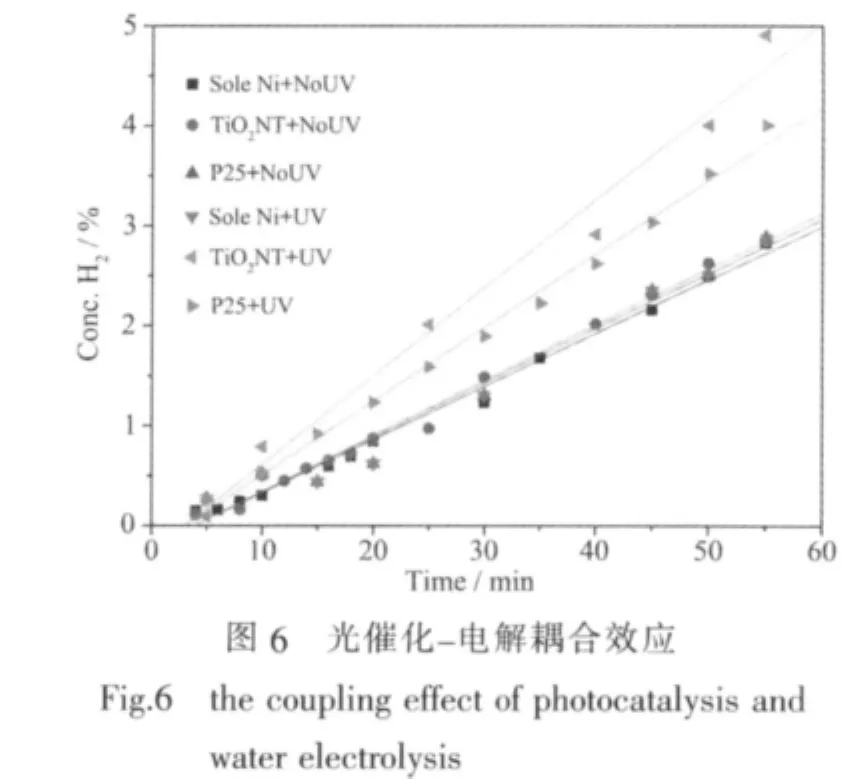
圖7為以TiO2納米管修飾鎳片為陽極的電解水裝置在單獨光、電作用下和光電共同作用下的產氫情況。在沒有紫外光輻照時,即為傳統的電解水制氫過程,在本實驗條件下,電解池電壓低于1.6 V時,都沒有觀察到明顯的產氫現象。單獨紫外光照射(0 V+UV)時,甚至在施加直流電壓低于1.6 V并同時有紫外光照射 (如圖中列出的1 V+UV和1.5 V+UV)時,也都沒有觀察和檢測到H2的產生,這與很多文獻報道的光催化制氫和光電化學制氫的研究結果不同,可能是因為文獻中使用具有很低析氫過電位、但價格昂貴和較難推廣應用的貴金屬Pt作陰極,或者是加入了犧牲劑(如乙二醇、Na2S),或者采用了抽真空的低壓條件,另外文獻報道的光電化學制氫體系中施加的偏壓一般低于1 V,實際上沒有電解水過程發生。Li[23]等報道了陽極氧化TiO2納米管/Ti作光陽極,Pt/C作陰極,1 mol·L-1KOH作電解液,0.6 V 偏壓下光電產氫速率為 0.178 mL·h-1·cm-2。張建靈[24]等報道了CdS/TiO2納米管/Ti作光陽極,鎳片作陰極,Na2S和Na2SO3為電子給體,1 V偏壓下,光電產氫速率達到 0.245 mL·h-1·cm-2。而本實驗采用的是以傳統的堿性電解槽為基礎,Ni-Cr合金作陰極,30%NaOH為電解質的工業化應用的電解水條件[25]。

表1 不同陽極材料的光催化輔助電解水產氫速率Table 1 Hydrogen production rate of WEAP with different anodes
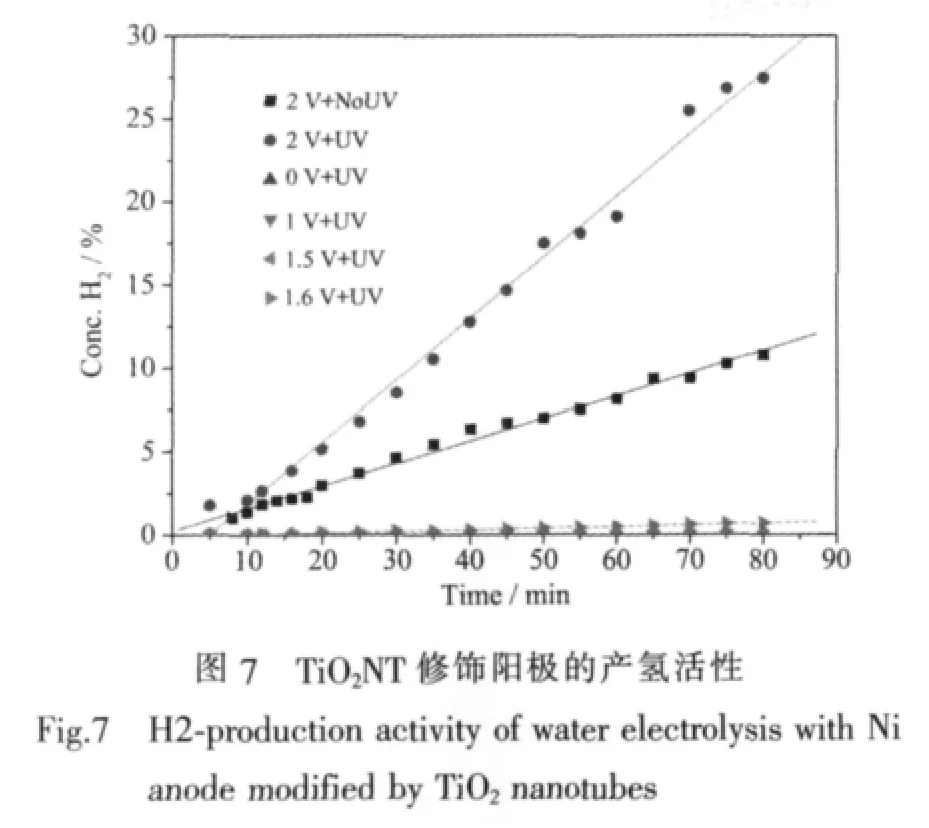
由圖7的實驗結果可知,在本實驗條件下,只有當直流電壓達到1.6 V時,才能克服理論水分解化學勢、電極過電位和電解池阻抗,電解水產氫過程才能進行。只有在電解過程能夠發生的前提下,用紫外光輻照TiO2光催化劑改性的陽極 (如圖7中2 V+UV),產氫速率才會顯著加快。表明光電耦合作用的基礎是
電解水過程已經發生,在電解水的基礎上耦合光催化過程構成的光催化輔助電解水的產氫效率遠高于單獨光、電作用時產氫量的簡單加和,表現出明顯的光電協同耦合產氫效應。說明只有在電解水產氫過程發生的情況下,光催化輔助的效果才能體現出來。
陽極涂覆的光催化劑在一定波長光線照射下能夠產生電子空穴對,具有還原性的電子將H+還原為氫氣,而具有氧化性的空穴則將OH-氧化為氧氣,從而實現水的光解。然而,光生電子空穴對極易在短時間內復合,通常載流子間的復合是納秒級快速過程,絕大多數光生電子和空穴還未來得及遷移到催化材料的表面參與氧化還原反應,就已經復合消耗了,導致單獨光催化產H2效率極低。在本實驗沒有采用貴金屬對光催化劑進行修飾、沒有加入氫犧牲劑、常溫常壓和空氣氣氛等條件下,沒有觀察和檢測到單獨光催化產氫現象。在本文提出的光催化輔助電解水過程中,通過電解池的直流電壓,將光生電子通過外電路及時轉移到陰極,在陰極實現H+的還原產生氫氣,陽極的空穴被電子給體OH-捕獲,產生O2,促進了光生電子空穴的有效分離,因此將光解水制氫與電解水制氫有機地耦合在一起,產生了協同效應,顯著地提高了產氫速率。
五結論
(1)采用水熱法成功制備了平均外徑為10 nm的TiO2納米管光催化劑,并涂覆在電解池的陽極鎳片上,形成了均勻的厚度約6~7 μm的光活性膜。
(2)制備的TiO2納米管比顆粒狀P25具有更高的光活性。
(3)光催化輔助電解水制氫實驗表明,將TiO2納米管光催化劑涂覆在電解池的陽極上,通過光對陽極的輻照,產氫速度比單純的電解水過程提高了61%。初步驗證了提出的光催化輔助電解水制氫的過程。
[1]Graf D,Monnerie N,Roeb M.Int.J.Hydrogen Energy,2009,33:4511-4519
[2]Clarke R E,Giddey S,Ciacchi F T.Int.J.Hydrogen Energy,2009,34:2531-2542
[3]Cherigui A N,Mahmah B,Harouadi F.Int.J.Hydrogen Energy.,2009,34:4934-4940
[4]NI Meng(倪萌),Leung M K H,Sumathy K.Energy Environmental Protection(Nengyuan Huanjing Baohu),2004,18(5):5-9
[5]Fujishima A,Honda K.Nature,1972,238:37-38
[6]WAN Bin(萬斌),SHEN Jia-Nian(沈嘉年),CHEN Ming-Bo(陳鳴波),et al.Acta Chim.Sin.(Huaxue Xuebao),2008,66(11):1301-1306
[7]WANG Hou-Jin(王后錦),WU Xiao-Jing(吳曉婧),HUANG Lang-Huan(黃浪歡),et al.Chinese J.Catal.(Cuihua Xuebao),2011,32(4):637-642
[8]SUN Lan(孫嵐),LI Jing(李靜),WANG Cheng-Lin(王成林),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2009,25(2):334-338
[9]Wu N Q,Wang J,Tafen D N,et al.J.Am.Chem.Soc.,2010,132(19):6679-6685
[10]LIU Rong-Fang(劉蓉芳),CHENG Fang-Yi(程方益),TAO Zhan-Liang(陶 占 良),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2011,27(6):1021-1026
[11]QI Xiao-Wang(奚小網),HU Lin-Hua(胡林華),FANG Xia-Qin(方霞琴),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2011,27(7):1353-1357
[12]Lei Z B,You W S,Liu M Y,et al.Chem.Commun.,2003,17:2142-2143
[13]Lei Z B,Ma G J,Liu M Y,et al.J.Catal.,2006,237:322-329
[14]WEN Xin-Yu(文新宇),HUANG Zi-Yang(黃紫洋).Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2011,27(6):1128-1132
[15]WEN Fu-Yu(溫 福 宇),YANG Jin-Hui(楊 金 輝),LI Can(李燦),et al.Progress in Chemistry(Huaxue Jinzhan),2009,21(11):2285-2302
[16]TIAN Meng-Kui(田蒙奎),SHANGGUAN Wen-Feng(上官文峰),OUYANG Zi-Yuan(歐陽自遠),et al.Journal of Functional Materials(Gongneng Cailiao),2005,36(10):1489-1492
[17]LI Qiong-Jiu(李瓊玖),WANG Jian-Hua(王建華),LI De-Kuan(李德寬),etal.SinoGlobalEnergy(ZhongwaiNengyuan),2008,13(3):35-42
[18]HUANG Jin-Zhao(黃金昭),XU Zheng(徐征).Journal of Linyi University(Linyi Shifan Xueyuan Xuebao),2004,26(6):10-13
[19]Bach U,Lupo D,Comte P,et al.Nature,1998,395:583-585
[20]CAI Fang-Gong(蔡芳共),Yang Feng(楊峰),ZHAO Yong(趙勇),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2011,27(3):504-508
[21]LI Hong-Yi(李洪義),WANG Jin-Shu(王金淑),CHEN Xin(陳欣),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2010,26:217-222
[22]CUI Qiang(崔強),FENG Bo(馮波),CHEN Wei(陳偉),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2010,25:233-239
[23]Li Y K,Yu H M,Wei S,et al.Int.J.Hydrogen Energy,2011,36:14374-14380
[24]ZHANG Jian-Ling(張建靈),ZHANG Xing-Wang(張興旺),LEI Le-Cheng(雷樂成).Chinese Science Bulletin(Kexue Tongbao),2008,12(53):1471-1473.
[25]WU Yu-Ping(吳玉萍),ZHOU Zhong-Hua(周忠華),HUANG Yue(黃悅),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2010,27(3):473-479
[26]Zeng K,Zhang D K.Prog.Energgy Combust Sci.,2010,36(3):307-326
[27]WANG Yi-zhong(王怡中),FU Yan(符雁),TANG Hong-xiao(湯鴻霄).Acta Scientiae Circumstantiate(Huanjing Kexue Xuebao),1999,19(1):65-69
[28]YE Zhao(葉釗),ZHANG Han-hui(張漢輝),PAN Hai-bo(潘海波).Spectroscopy and Spectral Analysis(Guangpuxue Yu Guangpu Fenxi),2002,22(6):928-931
[29]Mohapatra S K,Raja K S,Mahajan V K,et al.J.Phys.Chem.C.,2008,112:11007-11012
[30]Cho I S,Chen Z B,Forman A J,et al.Nano Lett.,2011,11:4978-4984
[31]SONG Gang-Xiang(宋剛祥).Thesis for the Master of Tianjing University(天津大學碩士論文).2008.
Nickel Anode Modified by TiO2Nanotubes and Photocatalytically Assisted Water Electrolysis for Hydrogen Generation
HE Hong-Bo CHANG Ming CHEN Ai-Ping*MA LeiDONG Hai-Jun LI Chun-Zhong
(Key Laboratory for Ultrane Materials of Ministry of Education,School of Materials Science and Engineering,East China University of Science and Technology,Shanghai 200237,China)
TiO2nanotubes(TiO2NT)were successfully synthesized by hydrothermal method.The TiO2nanotubes were coated onto Ni anodes for water electrolysis.A new hydrogen generation process,called as water electrolysis assisted by photocatalysis(WEAP),was proposed based on the coupling of water electrolysis with photocatalytic hydrogen evolution.The samples were characterized by X-ray diffraction(XRD),UV-Vis absorption spectroscope,field emission scanning electron microscope(FESEM),atomic force microscope(AFM)and WEAP measurement.The results showed that the rate of hydrogen generation increased by 61%in WEAP with the anode modified with TiO2NT in comparison with that in sole water electrolysis with unmodified Ni anode.
TiO2nanotubes;nickel anode modification;water electrolysis;photocatalysis;hydrogen generation
O614.41+1;TQ116.2+1
A
1001-4861(2012)10-2097-06
2012-01-09。收修改稿日期:2012-04-24。
國家自然科學基金(No.20925621)和上海市科委納米專項(No.1052nm02400)資助項目。
*通訊聯系人。E-mail:apchen@ecust.edu.cn,Tel:(021)64250996

