胰腺癌組織Skp2與C-myc的表達及意義
李居劍 劉建生 王艷
·短篇論著·
胰腺癌組織Skp2與C-myc的表達及意義
李居劍 劉建生 王艷
細胞周期調節失控是腫瘤發生、發展的重要分子事件。S期激酶相關蛋白2(S-phase kinase associated protein 2,Skp2)是在細胞周期研究中發現的一種F-box蛋白,它通過調節泛素-蛋白酶途徑,參與細胞周期的調控[1]。而C-myc是一種原癌基因,是細胞從G0/G1期進入S期的“開關”,參與調控細胞增殖、分化及凋亡等[2]。有研究表明[3],Skp2可活化C-myc靶基因,引起S期轉換,而C-myc也可通過激活cullin基因,導致Skp2基因表達增高,二者協同作用參與腫瘤的發生與發展。本研究檢測Skp2、C-myc蛋白在胰腺癌組織中的表達,探討其與臨床病理特征的關系。
一、資料與方法
1.病例資料:收集山西醫科大學第一醫院2003年1月至2010年12月間行手術切除并經病理證實的胰腺癌標本48例。患者術前均未行放化療治療,其中男26例,女22例,年齡31~77歲,平均(59±11)歲。取20例同期手術切除的癌旁胰腺組織作為對照。
2.免疫組化染色:鼠抗人Skp2單抗、鼠抗人C-myc蛋白單抗及二抗PV-6002均購自北京中杉金橋生物技術有限公司。應用Envision免疫組化二步法檢測Skp2和C-myc蛋白表達。以PBS液代替一抗作陰性對照。
Skp2陽性染色主要位于胞核,C-myc陽性染色則位于胞質或胞核,陽性著色均為出現棕黃色顆粒。隨機觀察10個高倍鏡視野,參照Takeuchi等[4]方法,以陽性細胞百分數和染色強度評分。陽性細胞<10%為0分,10%~29%為1分,30%~59%為2分,60%~74%為3分,≥75%為4分。無染色為0分,淡黃色為1分,棕黃色為2分,深棕黃色為3分。兩分值相乘,>1為陽性,≤1為陰性。
3.統計學處理:應用SPSS17.0統計軟件進行分析。顯著性差異采用χ2檢驗,相關性分析采用Spearman等級相關分析。P<0.05為差異具有統計學意義。
二、結果
1.Skp2和C-myc蛋白在胰腺癌和癌旁胰腺組織中的表達:48例胰腺癌組織中Skp2的陽性表達率為79.2%(38/48),顯著高于癌旁胰腺組織的20.0%(4/20)(χ2=20.927,P<0.01)。48例胰腺癌組織中C-myc的陽性表達率為77.1%(37/48),顯著高于癌旁胰腺組織中的15.0%(3/20)(χ2=22.465,P<0.01,圖1)。
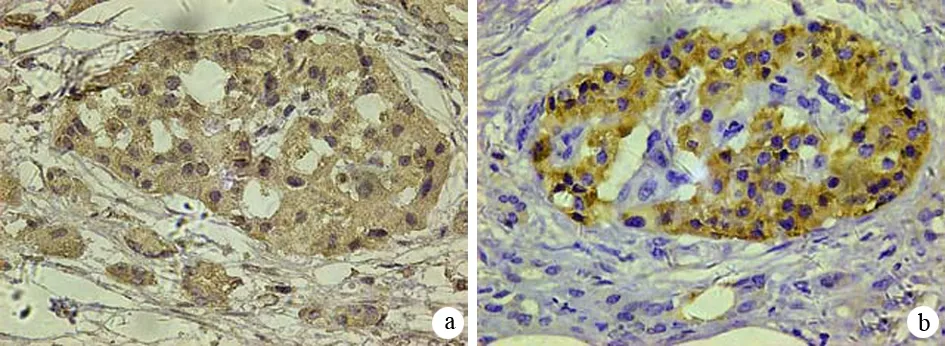
圖1Skp2(a)、C-myc(b)在胰腺癌組織中的表達(免疫組化 ×400)
2.Skp2和C-myc蛋白表達與胰腺癌臨床病理特征的關系:胰腺癌Skp2和C-myc表達均與性別、年齡、腫瘤大小及部位無關(P值均>0.05),而與癌組織的分化程度、淋巴結轉移及臨床分期有關(P值均<0.05,表1)。
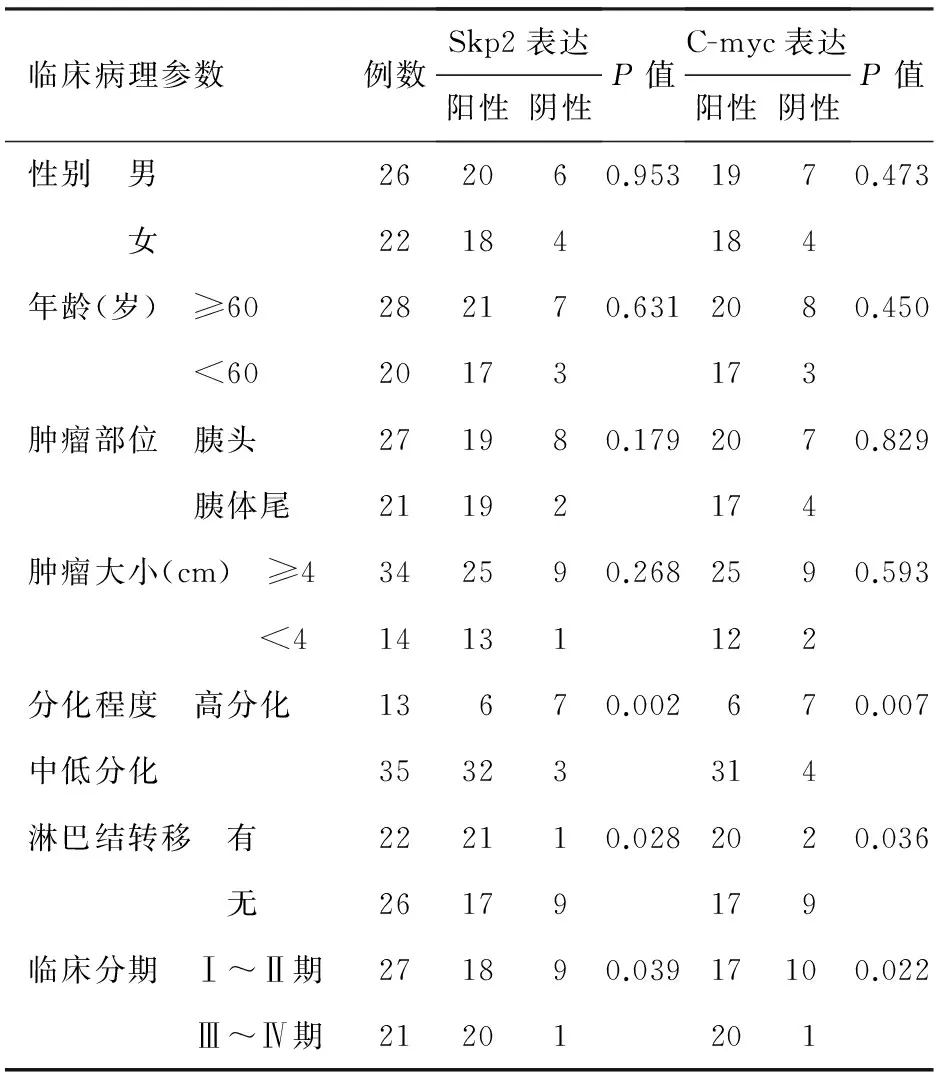
表1 Skp2、C-myc的表達與胰腺癌臨床病理特征的關系
3.胰腺癌Skp2和C-myc蛋白表達的相關性:38例Skp2表達陽性的胰腺癌組織中,33例C-myc陽性表達;10例Skp2陰性表達的胰腺癌組織中,6例C-myc表達陰性,Skp2與C-myc的表達呈顯著正相關(r=0.453,P<0.01)。
討論Skp2是泛素連接酶復合物(Skp1-Cullin-F-box,SCF)中的一種F-box蛋白,其作為SCF的底物識別亞基,特異性識別底物并誘導其泛素化降解來調控細胞周期。p27kip1蛋白是其主要的靶物質,對細胞G1~S期轉換具有抑制作用,p27kip1的降解可導致細胞惡性增殖[5]。Skp2蛋白在許多惡性腫瘤中均有異常升高,包括口腔鱗狀細胞癌、非小細胞肺癌、胃癌和肝癌等,且Skp2高表達患者較低表達者預后更差[6-8]。本實驗研究發現,Skp2在胰腺癌組織顯著高表達,且Skp2的表達與腫瘤分化程度、淋巴結轉移及臨床分期有關。提示Skp2與胰腺癌的侵襲、轉移能力具有一定的相關性。
C-myc是一種與細胞周期關系密切的原癌基因,其表達可使細胞獲能進入S期。C-myc對細胞具有雙重作用,既可刺激細胞增殖,也可促進細胞凋亡,同時C-myc的高表達還抑制細胞的分化,從而參與腫瘤的形成[9-10]。本實驗研究結果顯示,胰腺癌組織C-myc蛋白高表達,其表達與腫瘤分化程度、淋巴結轉移及臨床分期相關,提示C-myc與胰腺癌的發生發展亦有密切關系。
本研究結果還顯示,Skp2與C-myc在胰腺癌組織中的表達呈正相關性,提示二者的協同作用參與了胰腺癌的發生與發展,與Kim等11的結果一致。
[1] Ganoth D, Bornstein G, Ko TK, et al. The cell-cycle regulatory protein Cks1 is required for SCF(Skp2)-mediated ubiquitinylation of p27. Nat Cell Biol, 2001,3:321-324.
[2] Morrish F, Isern N, Sadilek M, et al. c-Myc activates multiple metabolic networks to generate substrates for cell cycle entry. Oncogene, 2009,28:2485-2491.
[3] O′Hagan RC, Ohh M, David G, et al. Myc-enhanced expression of Cul1 promotes ubiquitin-dependent proteolysis and cell cycle progression. Genes Dev, 2000,14:2185-2191.
[4] Takeuchi H, Fujimoto A, Tanaka M, et al. CCL21 chemokine regulates chemokine receptor CCR7 bearing malignant melanoma cells. Clin Cancer Res, 2004,10:2351-2358.
[5] 高海燕,鐘立厚,胡克.Skp2蛋白在非小細胞肺癌中的表達及其與C-myc蛋白表達的關系.中國肺癌雜志,2004,7:493-496.
[6] Reichert M, Saur D, Hamacher R, et al. Phosphoinositide-3-kinase signaling controls S-phase kinase-associated protein 2 transcription via E2F1 in pancreatic ductal adenocarcinoma cells. Cancer Res, 2007,67:4149-4156.
[7] Osoegawa A, Yoshino I, Tanaka S, et al. Regulation of p27kip1 by S-phase kinase-associated protein 2 is associated with aggressiveness in non-small-cell lung cancer. J Clin Oncol, 2004,22: 4165-4173.
[8] 胡少輝,張志偉,陳孝平,等.Skp2,C-myc在肝細胞肝癌中的表達及其意義.中國普通外科雜志,2006,1:45-48.
[9] 鄧景岳,畢明剛. 影響原癌基因C-myc作用因素的研究進展.腫瘤, 2009,29:1176-1179.
[10] Morrish F, Isern N, Sadilek M, et al.c-Myc activates multiple metabolic networks to generate substrates for cell cycle entry. Oncogene, 2009,28:2485-2491.
[11] Kim S, Herbst A, Tworkowski K, et al. Skp2 regulates Myc protein stability and activity. Mol Cell, 2003,11:1177-1188.
10.3760/cma.j.issn.1674-1935.2012.05.018
030001 山西省太原市,山西醫科大學第一醫院普外科
劉建生,Email:syyyljs@126.com
2011-11-04)
(本文編輯:呂芳萍)

