Nrf2和IGF-1在胃黏膜癌變過程中的表達
宋素貞 王洪波 (山東中醫藥大學第二附屬醫院職業病科,山東 濟南 25004)
Nrf2和IGF-1在胃黏膜癌變過程中的表達
宋素貞 王洪波1(山東中醫藥大學第二附屬醫院職業病科,山東 濟南 250014)
目的 研究核因子相關因子-2(Nrf2)及胰島素樣生長因子-1(IGF-1)在胃正常黏膜、增生性息肉、上皮內腫瘤(GIN)及腺癌中的表達情況,并初步探討二者在胃癌癌變過程中的作用機制。方法 應用免疫組化方法檢測Nrf2和IGF-1在胃正常黏膜、增生性息肉、各級GIN及不同分化程度腺癌中的表達情況。結果 Nrf2和IGF-1在正常胃黏膜中幾乎無表達;從增生性息肉、GIN到腺癌,二者共表達逐漸增強;在增生性息肉、GIN、腺癌中的表達差異有統計學意義(均P<0.05),并且呈正相關(r=0.337,P=0.037)。結論 Nrf2和IGF-1表達增強可能與胃黏膜癌變過程有關,二者表達水平升高有可能促進腫瘤進展。
核因子相關因子-2;胰島素樣生長因子-1;胃癌;致癌作用;氧化應激
胃癌前病變在轉變為胃癌的過程中,由于受到亞硝酸鹽、酒精、膽汁反流及幽門螺桿菌(HP)感染等外源性氧化應激源的刺激,從而引起氧化應激反應,致使機體組織細胞中產生過多活性氧自由基,導致細胞DNA損傷及突變,從而導致胃癌的發生。核因子相關因子-2(Nrf2)與機體的防御系統密切相關,是細胞防御氧化應激的重要調節因子,通過介導一系列抗氧化酶和Ⅱ相解毒酶的表達,可以保護多種組織免受有害物質的攻擊。因此,Nrf2已被列為腫瘤化學預防候選基因〔1,2〕。在既往研究中發現Nrf2基因敲除鼠惡性腫瘤的發病率明顯高于野生鼠。胰島素樣生長因子-1(IGF-1)有顯著的抗凋亡作用,對腫瘤細胞的耐藥性起關鍵作用〔3,4〕。本研究擬探討Nrf2及IGF-1在胃癌癌變過程中的作用機制。
1 材料與方法
1.1 材料 本研究中283例病人胃組織標本來源于山東大學第二醫院。其中,腺癌135例,來自2001~2005年病理科手術切除標本;上皮內腫瘤(GIN)96例(62例低級別以及34例高級別,包括6例原位癌)、增生性息肉30例及正常胃黏膜組織22例,均來自2005~2008年胃鏡室活檢標本。臨床及病理信息包括姓名、性別、年齡、腫瘤浸潤深度、組織類型及淋巴結轉移情況等均來自臨床資料。Nrf2、IGF-1表達及共表達情況分低、中、高三組。所有病理科診斷均參照WHO胃癌病理學及遺傳學分類,由三名病理科醫師共同診斷。所有患者材料均經家屬同意,并有知情同意書。獲道德及倫理委員會批準。
1.2 實驗方法 標本經甲醛固定,常規程序化脫水、石蠟包埋、連續切片(4 μm)后,進行蘇木精-伊紅(HE)染色和免疫組化染色。Nrf2應用兔抗人 Nrf2多克隆抗體(Abcam公司;ab53019,稀釋度1∶500)進行檢測。IGF-1應用鼠抗人IGF-1單克隆抗體 (Santa Cruz公司;sc-74116,稀釋度1∶400)進行檢測。切片脫蠟,3%過氧化氫溶液孵育10 min除去內源性過氧化物酶。后進行抗原恢復步驟。切片應用0.01 mol/L檸檬酸緩沖液(pH6.0)浸泡,微波爐加熱25 min。0.01 mol/L磷酸鹽緩沖鹽水(PBS;pH7.4)沖洗,常溫下濕盒內正常血清覆蓋切片30 min。0.01 mol/L PBS沖洗掉多余血清,常溫下濕盒內應用一抗孵育45 min。然后,PBS沖洗,37℃下濕盒內應用生物酰化的二抗孵育40 min,PBS沖洗,加入鏈親和素-過氧化物酶復合物(DAKO),切片在室溫下孵育45 min,0.01 mol/L PBS沖洗,顯微鏡下3,3'二氨基聯苯胺4-鹽酸溶液(DAB)覆蓋15 min(顯色),流動的自來水浸泡,HE復染1 min,自來水浴,一系列漸高濃度酒精浸泡,而后二甲苯浸泡,封蓋玻片。用PBS代替一抗作為陰性對照。
1.3 結果判斷 細胞染色陽性信號為棕黃色顆粒,定位于細胞質或細胞核。組織學及免疫組化染色評價由3位病理學家獨立完成。有爭議的切片重新評估以達成共識。每份樣本,至少3 000個細胞進行免疫組化染色評估。切片放大200倍觀察,測定胞質染色的原發性癌細胞百分比。另外,根據腫瘤細胞染色的百分數,分為“低表達”(<33%癌細胞染色)、“中表達”(≥33%并且<66%癌細胞染色)及“高表達”(≥66% 癌細胞染色)〔5〕。
1.4 統計學方法 應用SPSS11.0統計軟件進行分析,采用方差齊性檢驗,兩組間比較應用Pearson相關分析及Mann-Whitney檢驗。
2 結果
2.1 Nrf2因子及IGF-1在非腫瘤性病變中的表達 Nrf2在正常胃黏膜幾乎無表達,良性增生性病變中低表達;陽性表達多位于細胞質,部分位于細胞核;30例增生性息肉中,16例無表達,14例合并嚴重炎癥者呈低表達。與Nrf2表達情況類似,IGF-1在正常胃黏膜組織中無表達;在增生性息肉中,2例中度表達,13例低表達,15例無表達。Nrf2及IGF-1在系列切片中,2例呈現共表達。見圖1。
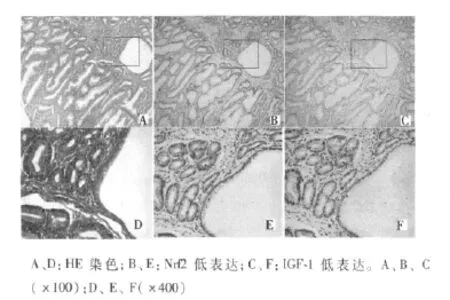
圖1 增生性息肉Nrf2和IGF-1表達
2.2 Nrf2因子及IGF-1在GIN中表達 Nrf2在癌前病變中表達增強。Nrf2在62例低級別GIN中,13例高表達,25例中等表達,24例低表達(包括4例陰性);34例高級別GIN者,15例高表達,15例中表達,4例低表達(包括2例陰性);Nrf2在高級別及低級別GIN中表達差別有統計學意義(P=0.034)。IGF-1在GIN中表達上調,62例低級別GIN中,18例高表達,15例中等表達,29例低表達(包括4例陰性);34例高級別GIN者,7例高表達,6例中表達,21例低表達(包括13例陰性表達);IGF1在高級別及低級別GIN中表達差別無統計學意義(P=0.058)。Nrf2及IGF-1共表達,在GIN中表達水平較增生性息肉提高,而高、低級別GIN中高、中、低共表達分別為7、6、4例及12、21、12例,組間無明顯差別(P=0.062)。見圖2。
2.3 Nfr2及IGF-1在腺癌中的表達 在135例腺癌中,Nrf2、IGF-1表達均增強,Nrf2及IGF-1共表達亦增強,見圖3。Nfr2、IGF-1以及共表達情況在增生性息肉、GIN及腺癌中差異有統計學意義(均P<0.05)。此外,良性病變、癌前病變及惡性病變中,Nfr2及 IGF-1表達呈正相關(r=0.337,P=0.037)。Nrf2、IGF-1及二者共表達與腫瘤分類、侵犯深度及轉移有關。見表1。
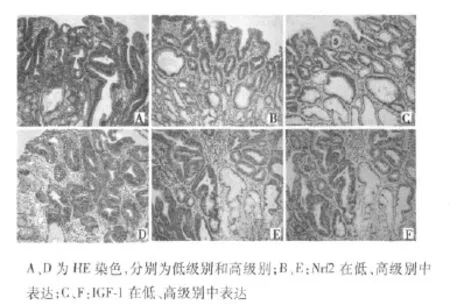
圖2 上皮內腫瘤Nrf2和IGF-1表達(×200)
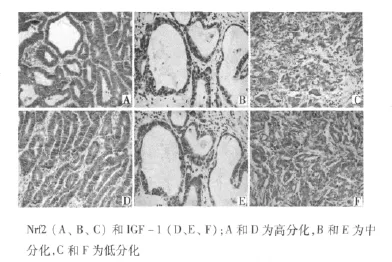
圖3 腺癌Nrf2和IGF-1表達(×200)
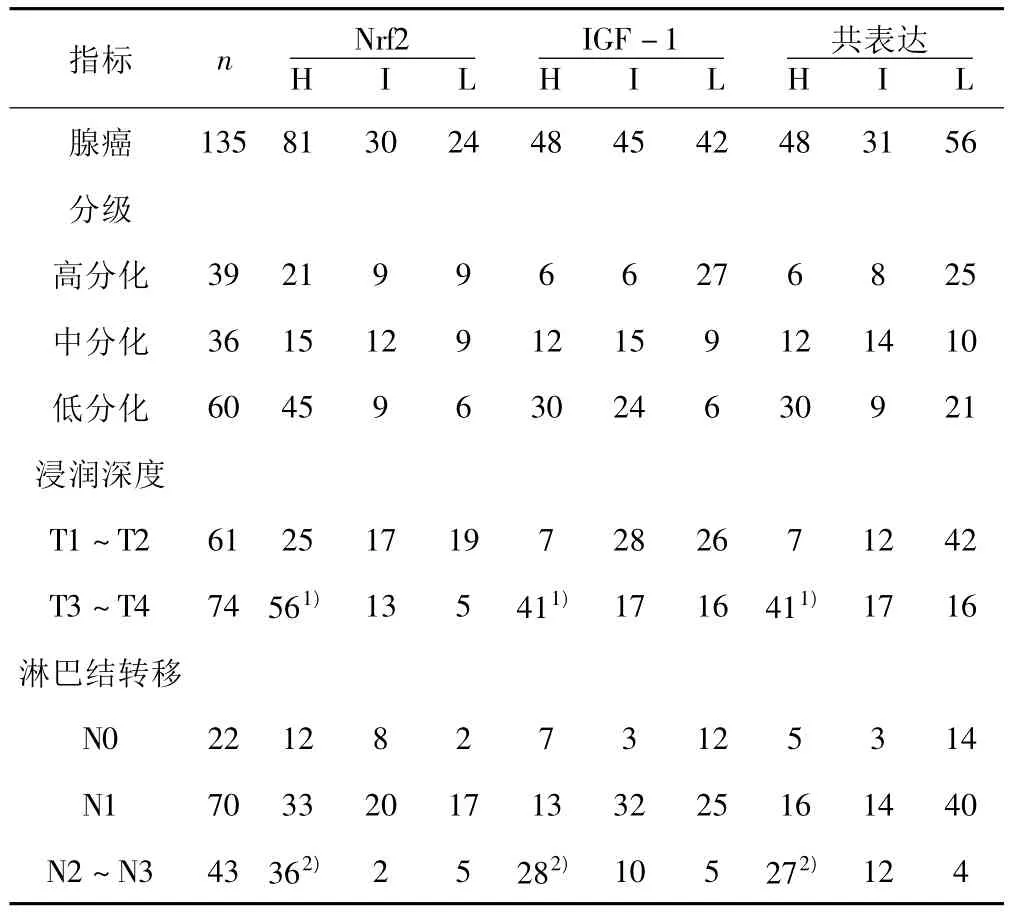
表1 Nrf2及IGF-1表達與胃腺癌浸潤深度及淋巴結轉移的關系(n)
3 討論
癌變過程是環境和遺傳因素相互作用而引起多基因突變和其他生物大分子改變積累的結果,是涉及啟動、促進和進展等多階段的復雜過程。化學致癌物經肝臟I相代謝酶(如細胞色素P450)催化后形成親電子活性致癌物,與DNA及蛋白質結合形成加成物,引起癌基因和抑癌基因改變;而經Ⅱ相代謝酶,如谷胱甘肽s-轉移酶(GST)的生物轉化作用,使終致癌物親水性增強,促進其體外排泄。Nrf2是調節Ⅱ相代謝酶表達的重要轉錄因子,通過與靶基因的抗氧化反應元件(ARE)結合,調節多種解毒酶的表達。Nrf2的激動劑CDDO-Im可以預防黃曲霉素介導的肝細胞癌前病變的發生〔6,7〕。抑制Nrf2向細胞核易位會加重氧化應激,導致非諾貝特介導的肝癌的形成〔8〕。Nrf2缺陷鼠比野生鼠更易形成肺轉移癌結節〔9〕。
氧化應激破壞了機體內氧化和抗氧化的平衡,致使組織細胞中自由基產生增多,從而導致了包括腫瘤在內的一些疾病的發生。生理狀態下,Nrf2與胞漿蛋白伴侶分子Keap1(Nrf2的Cullin3型泛素連接酶)耦連,錨合于胞質,處于活性相對抑制狀態。親電子脂質過氧化物4-羥基-2-壬烯醛(HNE)通過修飾Keap1,使其構象發生改變,使Nrf2解離后轉入胞核〔10〕。在癌癥化學預防研究中,叔丁基對苯二酚(tBHQ)及萊菔硫烷(SFN)誘導Nrf2在結直腸癌細胞胞核內積聚,激活Nrf2依賴的ARE介導的基因表達〔11〕。P62可與Keap1的Nrf2結合位點相互作用,P62過表達或自我吞噬缺陷與Nrf2和Keap1的交互作用競爭,最終導致Nrf2穩定及其靶基因轉錄活化〔12〕。近期一項研究表明,1 145例癌組織應用單鏈構象多態性分析(SSCP),其中22例鱗癌中有21例檢測到Nrf2基因突變(突變率99.5%)。所有發現Nrf2突變的食管鱗癌及皮膚鱗癌中,細胞核中的Nrf2表達均增強。然而,所有鱗癌中未發現Keap1突變。以上提示Nrf2突變在鱗癌發展中具有至關重要的作用,這是鱗癌的特點〔13〕。在人類的結腸癌細胞中,一氧化氮促進Nrf2在胞核中快速積聚,對照組細胞中的Nrf2則在胞質中表達。Nrf2在胞核中積聚與轉錄增強和轉錄后修飾有關〔14〕。IGF-1是有絲分裂潛在刺激物,能促進細胞分化及轉化。此外,IGF-1是主要的生存因子,可以保護細胞免于各種環境下的凋亡。
本研究證實,Nrf2和IGF-1在胃黏膜癌前病變及腺癌中表達較良性增生性病變明顯升高,與此結果一致的是,二者共表達水平在胃黏膜癌前病變及腺癌中亦升高。提示二者與癌變過程甚至與腫瘤侵襲及轉移有關。在正常及良性病變,二者共表達為無或低水平,但在癌前病變及腺癌中共表達上調。這一結果揭示二者之間存在協同效應,這種協同可能導致癌變發生,甚至促進腫瘤侵襲及轉移。Nrf2表達水平在高、低級別GIN差異顯著,提示高級別GIN可能接受了更多的氧化損傷,導致細胞DNA損傷及突變,即Nrf2基因的突變。有研究報導Nrf2為一種核蛋白〔15〕,本研究結果表明其在癌前病變及腺癌細胞質中表達,顯示胞質Nrf2可能為突變后過表達并有促進癌變發生的作用。另外,IGF-1表達從良性病變至惡性病變增加,提示其有保護癌細胞抗凋亡及促進腫瘤進展作用。國外研究已證實,IGF-1陽性結直腸癌較陰性者有更高的進展率,且有較高妥昔單抗(表皮生長因子單抗)耐藥率,生存期亦縮短〔4〕。本研究資料顯示低分化腺癌較高分化者有更高的Nrf2和IGF-1陽性表達率。Nrf2和IGF-1共表達暗示其在胃癌發生進展方面具有協同作用,可能對預后預測有一定價值。
1 Jeong WS,Jun M,Kong AN.Nrf2:a potential molecular target for cancer chemoprevention by natural compounds〔J〕.Antioxid Redox Signal,2006;8(1-2):99-106.
2 葉社房,侯振清,鐘李明,等.Nrf2/ARE在化學防癌機制中的作用〔J〕. 中華腫瘤防治雜志,2007;14(3):222-5.
3 Alberobello AT,D'Esposito V,Marasco D,et al.Selective disruption of insulin-like growth factor-1(IGF-1)signaling via phosphoinositide-dependent kinase-1 prevents the protective effect of IGF-1 on human cancer cell death〔J〕.J Biol Chem,2010;285(9) :6563-72.
4 Scartozzi M,Mandolesi A,Giampieri R.Insulin-like growth factor 1 expression correlates with clinical outcome in K-RAS wild type colorectal cancer patients treated with cetuximab and irinotecan〔J〕.Int J Cancer,2010;127(8):1941-7.
5 Dango S,Sienel W,Schreiber M,et al.Elevated expression of carcinoembryonic antigen-related cell adhesion molecule 1(CEACAM-1)is associated with increased angiogenic potential in non-small-cell lung cancer〔J〕.Lung Cancer,2008;60(3):426-33.
6 Roebuck BD,Curphey TJ,Li Y,et al.Evaluation of the cancer chemopreventive potency of dithiolethione analogs of oltipraz〔J〕.Carcinogenesis,2003;24(12):1919-28.
7 Yates MS,Kwak MK,Egner PA,et al.Potent protection against aflatoxininduced tumorigenesis through induction of Nrf2-regulated pathways by the triterpenoid 1-〔2-cyano-3-,12-dioxooleana-1,9(11)-dien-28-oyl〕imidazole〔J〕.Cancer Res,2006;66(4):2488-94.
8 Nishimura J,Dewa Y,Okamura T,et al.Role of Nrf2 and oxidative stress on fenofibrate-induced hepatocarcinogenesis in rats〔J〕.Toxicol Sci,2008;106(2):339-49.
9 Satoh H,Moriguchi T,Taguchi K,et al.Nrf2-deficiency creates a responsive microenvironment for metastasis to the lung〔J〕.Carcinogenesis,2010;31(10):1833-43.
10 Mahaffey CM,Zhang H,Rinna A,et al.Multidrug-resistant protein-3 gene regulation by the transcription factor Nrf2 in human bronchial epithelial and non-small-cell lung carcinoma〔J〕.Free Radic Biol Med,2009;46(12):1650-7.
11 Wu XY,Qu LY,Quan K,et al.Effect of tBHQ and sulforaphane on Nrf2-ARE signaling pathway of cancer cells〔J〕.Zhejiang Da Xue Xue Bao Yi Xue Ban,2010;39(1):17-23.
12 Komatsu M,Kurokawa H,Waguri S,et al.The selective autophagy substrate p62 activates the stress responsive transcription factor Nrf2 through inactivation of Keap1〔J〕.Nat Cell Biol,2010;12(3):213-23.
13 Kim YR,Oh JE,Kim MS,et al.Oncogenic NRF2 mutations in squamous cell carcinomas of oesophagus and skin〔J〕.J Pathol,2010;220(4):446-51.
14 Li CQ,Kim MY,Godoy LC,et al.Nitric oxide activation of Keap1/Nrf2 signaling in human colon carcinoma cells〔J〕.Proc Natl Acad Sci U S A,2009;106(34):14547-51.
15 Nguyen T,Sherratt PJ,Nioi P,et al.Nrf2 Controls Constitutive and in-ducible expression of ARE-driven genes through a dynamic pathway involving nucleocytoplasmic shuttling by Keap1〔J〕.J Biol Chem,2005;280(37):32485-92.
R735.2
A
1005-9202(2012)17-3658-04;
10.3969/j.issn.1005-9202.2012.17.018
1 山東大學第二醫院消化科
王洪波(1974-),男,博士,主治醫師,主要從事消化道腫瘤基礎及臨床研究。
宋素貞(1977-),女,碩士,講師,主要從事消化道腫瘤基礎及臨床研究。
〔2012-01-07收稿 2012-03-04修回〕
(編輯 袁左鳴)

