淋病奈瑟菌gyr A和par C基因喹諾酮耐藥決定區(qū)突變與環(huán)丙沙星耐藥相關性研究
高家良 王黎芳 李洵璐 周嬌萍 孫愛華
鑒于淋病奈瑟菌對青霉素和四環(huán)素高度耐藥世界衛(wèi)生組織于20世紀80年代提出將第三代頭孢菌素及喹諾酮類藥物推薦為治療淋病的一線藥物[1]。但隨著喹諾酮類藥物的大量和廣泛的應用,臨床對該類藥物的敏感性逐漸下降出現(xiàn)耐藥,我國淋病奈瑟菌耐藥監(jiān)測組連續(xù)20年對耐藥率變化檢測發(fā)現(xiàn),淋病奈瑟菌臨床菌株對環(huán)丙沙星的耐藥率從1995年的15.48%增至 2000年的 85.20%,2005年為 94.3%,而 2008 年達到 96.13%[2~4]。
淋病奈瑟菌對喹諾酮類藥物的耐藥機制復雜,目前認為編碼DNA螺旋酶A亞單位gyrA基因及拓撲異構酶ⅣC亞單位parC基因的喹諾酮耐藥決定區(qū)(quinolone resistance determining regions,QRDR)突變起了重要作用[5]。為探討淋病奈瑟菌對喹諾酮類藥物環(huán)丙沙星的耐藥機制,我們收集了137株淋病奈瑟菌臨床菌株并檢測其對6種抗生素的耐藥性,對50株環(huán)丙沙星耐藥的臨床菌株gyrA和parC基因QRDR區(qū)PCR擴增并直接測序,探討gyrA和parC基因的QRDR突變與細菌耐藥的相關性。
材料與方法
1.菌株的來源:2009年6月~2010年6月從浙江省寧波地區(qū)多家醫(yī)院及計劃生育指導站收集淋病奈瑟菌137株,已按常規(guī)細菌學分離及鑒定。青霉素、四環(huán)素、環(huán)丙沙星、氧氟沙星、頭孢曲松和大觀霉素購自Sigma公司,藥敏質控及PCR陽性對照株淋病奈瑟菌ATCC49226和PCR陰性對照大腸桿菌標準株ATCC25922由浙江大學醫(yī)學院病原生物系提供,采用瓊脂稀釋法測定各抗生素最低抑菌濃度(minimal inhibitory concentration,MIC)[4]。配制含10%脫纖維羊血、抗生素濃度均分別為0.015~32mg/L(大觀霉素為1.0~256mg/L三管)的GC瓊脂平板,37℃孵育24h檢菌。各淋病奈瑟菌臨床菌株和質控菌株在GC培養(yǎng)基上傳代2次后,用24h新鮮培養(yǎng)物制成107cfu/ml的菌懸液,接種于檢菌合格的藥敏平板,36℃培養(yǎng)48h后觀察結果,以細菌生長被抑制的藥物最高稀釋度為MIC。對各抗生素耐藥的判斷標準如下:青霉素、四環(huán)素和氧氟沙星均為MIC≥2mg/L,頭孢曲松為MIC≥0.5mg/L,大觀霉素為MIC≥128mg/L,對環(huán)丙沙星≥4mg/L為高度耐藥,MIC≥1mg/L為低度耐藥,0.06mg/L <MIC≤0.5mg/L為中介,MIC≤0.06mg/L 為敏感[4]。
2.實驗方法:(1)DNA模板的制備:采用申能博彩(Bio-Color)生物有限公司提供的DNA提純試劑盒制備DNA模板,具體步驟如下:挑取5個菌落置于50μl DNA提取液中,混勻后沸水浴10min,取5μl作為PCR的DNA模板。(2)引物設計:參考GenBank登錄淋病奈瑟菌gyrA和parC基因參考序列(Genbank accession no:U08817和U08907)及QRDR位置設計上、下游引物。gyrA基因上游引物序列:5'-CGG CGC GTA CTG TAC GCG -3',下游引物序列:5'-CGA GCC GTT GAC GAG CAG -3'。parC基因上游引物序列:5'-AAG GCC GCG CGCTGCCTG -3',下游引物序列:5'- CGG ACA ACA GCA ATT CCG -3'。委托上海生工生物技術有限公司(Sangon)合成引物。(3)PCR擴增及擴增產(chǎn)物檢測:PCR總體積為100μl,內(nèi)含 2.5mol/L 各 dNTP、250nmol/L 各引物、2.5U Ex-Taq DNA聚合酶(TaKaRa)、5μl細菌DNA提取物為模板、1×PCR 緩沖液(pH8.3)。PCR 參數(shù):94℃ 4 min;94℃30s,58℃ 30s,72℃ 30s,35 個循環(huán);72℃ 5 min。采用 1μg/ml溴乙錠預染色的2.0%瓊脂糖凝膠電泳檢測擴增產(chǎn)物,目的基因擴增片段預期大小分別為378 bp和321bp,擴增產(chǎn)物包括gyrA和parC基因QRDR的區(qū)域。(4)核苷酸序列測定及分析:隨機選取對環(huán)丙沙星耐藥的淋病奈瑟臨床菌株50株,采用BioColor公司的3S柱離心式瓊脂糖DNA小量快速純化試劑盒提純,委托Sangon公司測定50株淋病奈瑟菌PCR產(chǎn)物gyrA和parC基因片段的核苷酸序列。參照已報道的淋病奈瑟菌野生株gyrA和parC基因(Genbank accession no:U08817和U08907)QRDR核苷酸序列,對隨機抽取的50株淋病奈瑟菌gyrA和parC基因QRDR核苷酸及推測的氨基酸序列進行比較,以確定上述菌株gyrA和parC基因QRDR的突變情況。
3.統(tǒng)計學方法:檢測結果的分析和比較采用Stata 8.0統(tǒng)計學軟件中的χ2檢驗,對檢測結果進行比較,p<0.05認為有差異。
結 果
1.PCR擴增結果:137株淋病奈瑟菌DNA都能用自行設計引物擴增出gyrA和parC基因目的片段,2.0%瓊脂糖凝膠電泳顯示gyrA和parC基因目的片段為預期大小(此處不顯示)。同樣條件下PCR擴增淋病奈瑟菌標準株ATCC49226 DNA結果為陽性,大腸桿菌標準株ATCC25922 DNA結果為陰性。
2.MICs檢測結果:137株淋病奈瑟菌臨床菌株對6種檢測抗生素的MICs和耐藥情況見表1。未發(fā)現(xiàn)對大觀霉素和頭孢曲松耐藥菌株。對環(huán)丙沙星全部耐藥,對其余3種抗生素青霉素、四環(huán)素和氧氟沙星的耐藥率分別為 76.6%(105/137)、75.2%(103/137)和97.1%(133/137)。
3.gyrA和parC基因QRDR變異情況:137株淋病奈瑟菌臨床菌株中隨機抽取50株PCR擴增gyrA和parC基因,PCR產(chǎn)物純化后測序。結果QRDR測序的50株淋病奈瑟菌臨床菌株中13株只存在gyrA基因點突變,占26.0%,其余37株(74.0%)淋病奈瑟菌臨床菌株除gyrA基因存在突變外同時伴有parC基因至少1個位點突變。在gyrA基因共檢測到3種編碼氨基酸的核苷酸序列發(fā)生錯義突變,其中S91F突變發(fā)生在所有檢測菌株,49株(98.0%)D95位發(fā)生突變,其中D95G、D95A、D95N和D95E突變分別有12、25、11和1株,1株(2.0%)不發(fā)生 D95突變而發(fā)生A92P突變。37株(74.0%)淋病奈瑟菌臨床菌株有parC基因至少1個位點突變,且parC基因突變位點較多且相對比較分散,其中28株(28/35,75.7%)parC 基因 85、86、87、88 和 91 位發(fā)生單位點突變,包括G85C(1株)、D86N(7株)、S87R/N/I(23株)、S88P(1株)和 E91G/Q/K/A(7株);9株(9/37,24.3%)parC基因發(fā)生雙重突變,包括S87R+E91A(7株)和S86N+S87I(2株)(表2)。
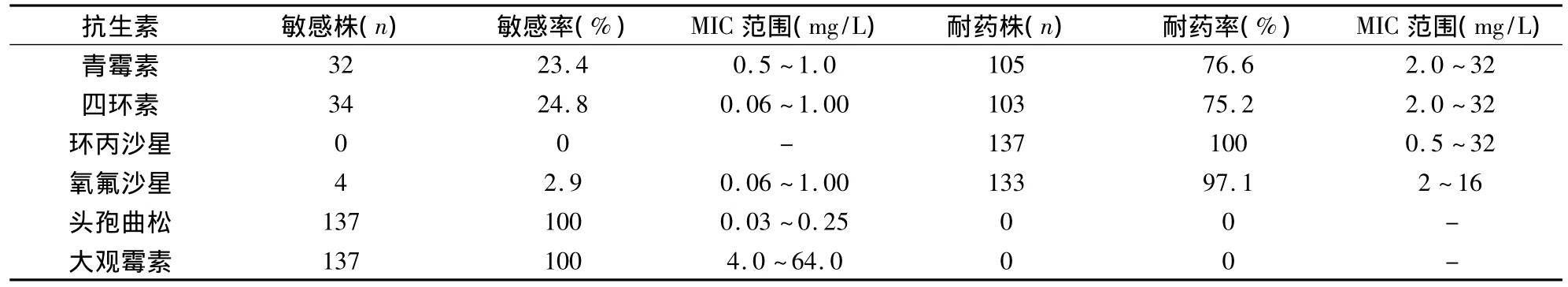
表1 137株淋病奈瑟菌臨床分離株對6種抗生素的耐藥率比較
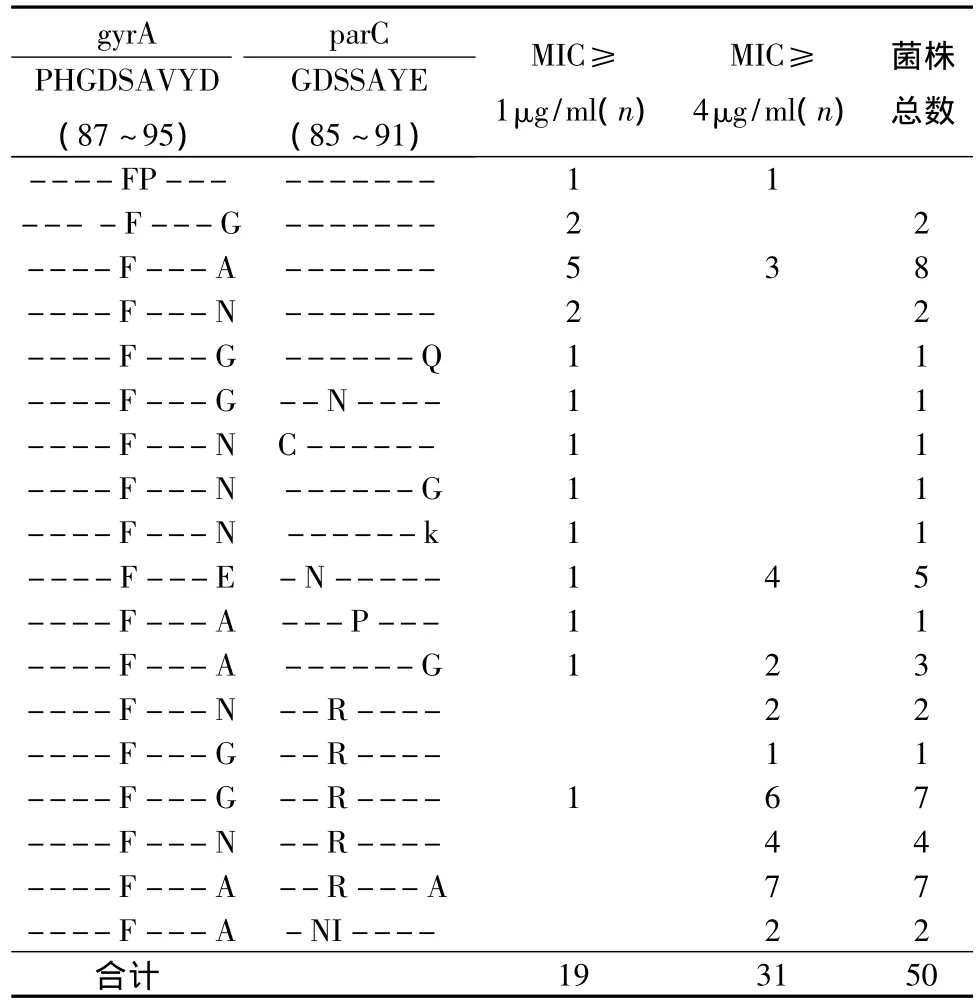
表2 50株對環(huán)丙沙星耐藥的淋病奈瑟菌臨床菌株gyr A和par C QRDR變異情況
4.gyrA和parC基因與耐藥的相關性:只存在gyrA基因突變的13株菌株,其中10株對環(huán)丙沙星呈低度耐藥(10/13,76.9%),3株對環(huán)丙沙星呈高度耐藥(3/13,23.1%)。37株淋病奈瑟菌臨床菌株除gyrA基因存在突變外伴有parC基因QRDR至少1個位點突變,其中9株對環(huán)丙沙星呈低度耐藥(9/37,24.3%),28株對環(huán)丙沙星呈高度耐藥(28/37,75.7%)。gyrA基因突變不伴parC基因突變引起淋病奈瑟菌臨床菌株對環(huán)丙沙星高度耐藥占23.1%(3/13),gyrA基因突變伴有parC基因突變引起淋病奈瑟菌臨床菌株對環(huán)丙沙星高度耐藥占75.7%(28/37),兩組間有統(tǒng)計學顯著性差異(χ2=11.3,P <0.01)。28株淋病奈瑟菌臨床菌株發(fā)生parC基因單個位點突變,其中9株(9/28,32.1%)對環(huán)丙沙星呈低度耐藥,19株(19/28,67.9%)對環(huán)丙沙星呈高度耐藥,發(fā)生parC基因兩個位點突變的9株淋病奈瑟菌臨床菌株藥敏結果對環(huán)丙沙星全部呈高度耐藥(9/9,100%),parC基因單個位點突變與兩個位點突變引起淋病奈瑟菌臨床菌株對環(huán)丙沙星高度耐藥有顯著性差異(χ2=3.8,P <0.01)(表 2)。
討 論
流行病學調(diào)查顯示,20世紀80年代開始環(huán)丙沙星用于淋病的治療,隨著環(huán)丙沙星等喹諾酮類藥物的廣泛使用,90年代其敏感性開始下降,到了2000年前后,許多國家與地區(qū)環(huán)丙沙星耐藥率已達90%以上[2~4],筆者收集的137株淋病奈瑟菌臨床菌株對6種抗生素的耐藥試驗表明,環(huán)丙沙星耐藥率為100%,其他喹諾酮類藥物如氧氟沙星的耐藥率也達97.1%,說明喹諾酮類藥物已不能成為本地區(qū)治療淋病的藥物。137株淋病奈瑟菌臨床菌株未檢測到對大觀霉素和頭孢曲松耐藥,提示大觀霉素和頭孢曲松可作為淋病治療的推薦藥物。
淋病奈瑟菌對喹諾酮類藥物耐藥機制較為復雜,但最主要與編碼DNA旋轉酶和拓撲異構酶Ⅳ的基因的突變有關,國外研究已發(fā)現(xiàn),gyrA和parC基因突變位點集中發(fā)生在核苷酸序列N端199~318的區(qū)間內(nèi),即所謂喹諾酮耐藥決定區(qū)(QRDR),淋病奈瑟菌對喹諾酮類藥物耐藥性的發(fā)生與gyrA和parC基因QRDR突變有關[4]。其中gyrA基因參與編碼的DNA旋轉酶是喹諾酮類藥物的主要作用靶位,Deguchi等研究發(fā)現(xiàn)對喹諾酮類敏感的淋病奈瑟菌gyrA基因沒有突變,耐藥株一般都有gyrA基因突變,其中編碼91位絲氨酸(S91)和95位天冬天氨酸(D95)的密碼子最易發(fā)生突變[6,7],我們對 50株耐環(huán)丙沙星的淋病奈瑟菌臨床菌株的測序結果發(fā)現(xiàn)S91F突變發(fā)生在所有檢測菌株,49株(49/50,98.0%)淋病奈瑟菌臨床菌株G/A/N/E突變,其中1株發(fā)生D95E突變未見文獻報道,1株D95不發(fā)生突變而發(fā)生A92P突變,表明gyrA基因發(fā)生點突變特別S91和D95突變是造成淋病奈瑟球菌臨床菌株產(chǎn)生喹諾酮類耐藥的主要原因。Deguchi等也發(fā)現(xiàn)對喹諾酮類耐藥的淋病奈瑟菌臨床菌株parC基因存在86、87、88和91的突變,而藥物敏感株沒有這些突變,另有研究發(fā)現(xiàn),parC基因突變基因僅出現(xiàn)在已存在gyrA基因雙突變且高度耐藥的菌株中[6,7],提示parC基因突變可能與淋病奈瑟菌對喹諾酮類藥物耐藥程度相關。我們檢測了50株淋病奈瑟菌臨床菌株parC的QRDR核苷酸序列,37株淋病奈瑟菌臨床菌株除gyrA基因存在突變同時伴有parC基因QRDR至少1個位點突變引起高度耐藥28株占75.7%,13株gyrA基因突變不伴parC基因突變引起高度耐藥3株占23.1%,兩組間有統(tǒng)計學顯著性差異(χ2=11.3,p<0.01),說明是否伴隨parC基因突變與淋病奈瑟菌臨床菌株對環(huán)丙沙星高度耐藥明顯相關。28株淋病奈瑟菌臨床菌株發(fā)生parC基因單位點突變中19株對環(huán)丙沙星呈高度耐藥占67.9%,所有發(fā)生parC基因雙位點突變的9株淋病奈瑟菌臨床菌株對環(huán)丙沙星全部呈高度耐藥,有顯著性差異(χ2=3.8,P <0.01)。說明 parC 基因突變位點數(shù)目與淋病奈瑟菌臨床菌株對環(huán)丙沙星耐藥程度明顯相關性,這與國外文獻報道相似[2~4,7]。
1 Campos- Outcalt D.CDC update:guidelines for treating STDs[J].J Fam Pract,2011,60(3):143 -146
2 Furuya R,Tanaka M.Neisseria gonorrhoeae infections[J].Nippon Rinsho,2009,67(1):129 -135
3 Yang Y,Liao MM,Gu WM,et al.Antimicrobial susceptibility and molecular determinants of quinolone resistance in N.gonorrhoeae isolates from Shanghai[J].J Antimicrobial Chemotherapy,2006,58(4):868-872
4 Zhang TJ,Zhou XM,Zhang JL,et al.Fluoroquinolone resistance among Neisseria gonorrhoeae isolates from Shanghai,China:detection of quinolone resistancedetermining region mutations[J].Indian J Med Res,2009,129(6):701-706
5 Clinical and Laboratory Standards Institute.Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically:approved standard[M].7th ed.2006:M7 - A7
6 Deguchi T,Yasuda M,Nakano M,et al.Quinolone-resistant Neisseria gonorrhoeae:correlation of alterations in the GyrA subunit of DNA gyrase and the ParC subunit of topoisomerase IV with antimicrobial susceptibility profiles[J].Antimicrobial Agents and Chemotherapy,1996,40(4):1020-1023
7 Pérez-Losada M,Crandall KA,Bash MC,et al.Distinguishing importation from diversification of quinolone-resistant Neisseria gonorrhoeae by molecular evolutionary analysis[J].BMCEvol Biol,2007,7(1):84-93

