Pt/TiO2光催化甲烷重整水氣制氫
李曹龍 陳 威 袁 堅 上官文峰,*
(1上海交通大學燃燒與環境技術中心,上海200240;2中國藥科大學基礎部無機化學教研室,南京211169)
Pt/TiO2光催化甲烷重整水氣制氫
李曹龍1,2陳 威1袁 堅1上官文峰1,*
(1上海交通大學燃燒與環境技術中心,上海200240;2中國藥科大學基礎部無機化學教研室,南京211169)
在室溫下以太陽能替代傳統的高溫高壓熱反應條件,在固定床裝置中實現連續動態光催化甲烷重整水氣(PSRM)制氫反應:CH4+2H2O(g)→4H2+CO2.產物的主成分是H2和CO2,同時檢測到微量或痕量的C2H6、C2H4和CO.重點考察了以光沉積法負載Pt的TiO2(p-Pt/TiO2)為光催化劑,該反應體系在不同CH4/H2O進料摩爾比、進料的總流速、光照波長、催化劑用量以及貴金屬的負載方式等的實驗條件對氫氣產率的影響.最優化的反應條件為:CH4/H2O進料摩爾比為4;進料總流速為0.5 mL·min-1;光沉積負載要優于浸漬法;相同的負載方式Pd和NiOx為比較優異的助催化劑;最佳催化劑用量為20 mg·cm-2.最后循環實驗結果表明,p-Pt/TiO2及反應體系都具有比較高的穩定性.
光催化重整;氫氣;甲烷;水氣;TiO2
1 引言
基于環境保護和能源的可持續發展考慮,以可再生資源生產氫能是一個具有發展潛力的新途徑. 1972年Honda-Fujishima效應1的發現,揭開了光催化分解水制氫氣的序幕.Sakata和Kawai2報道從混有犧牲劑的水中更能有效地產生氫氣.犧牲劑主要是一些含碳的固體物質(活性碳、2糖、淀粉、纖維素、3焦炭、柏油沙4)和含碳的化學物質(MeOH、5EtOH、6C2H4、7CO、8甘油9).雖然EtOH、糖、淀粉、纖維素被認為是可再生資源,但到目前為止還沒有系統的實際應用.
在眾多的犧牲劑中,以甲烷(CH4)作為犧牲劑光解水產氫很少有報道.甲烷在自然界中分布很廣,是天然氣、沼氣、油田氣及煤礦坑道氣的主要成分.10CH4是所有碳氫化合物中H/C比最高的物質.目前全球氫產量中的相當一部分來自于天然氣和水的重整制氫.然而,甲烷-水(水氣)重整反應是一個強吸熱反應,即便是在催化劑作用下也要在750-920°C的高溫下反應才能進行,能耗極高.近來,日本Yoshida小組11-15在研究CH4作為犧牲劑光解水產氫時對不同的反應產物進行檢測,發現生成物中H2/CO2的摩爾比大約為4,與傳統的甲烷-水氣熱重整反應計量比一致,說明該熱重整反應可以通過光催化得以實現.因此,光催化甲烷水氣重整(PSRM)制氫是從可再生資源及自然能源中提取氫氣的一項具有前景的氫能源技術,反應式如下:
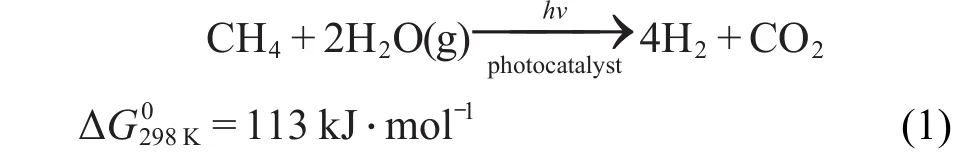
本文研究了以光沉積法負載Pt的TiO2(p-Pt/ TiO2)為光催化劑,在固定床裝置中連續動態條件下甲烷重整水氣制氫反應.同時考察了不同參數和實驗條件對氫氣產率的影響,以期得出最優化的實驗條件.
2 實驗
試劑:所有試劑均為分析純.P25(TiO2,德國,德固賽公司);氯鉑酸(H2PtCl6·6H2O,上海化學試劑一廠);醋酸鈀(Pd(O2CCH3)2,上海誠心化工有限公司);氯銠化鈉(Na3RhCl6,國藥集團化學試劑有限公司);氯化釕(RuCl3·3H2O,國藥集團化學試劑有限公司);氯金酸(HAuCl4·4H2O,國藥集團化學試劑有限公司).
以Pt/TiO2為光催化劑的制備:(1)將P25粉末浸漬在氯鉑酸溶液中,通過光沉積法制備負載Pt的質量分數為0.3%的p-Pt/TiO2光催化劑;(2)負載不同貴金屬量為1%的Ag(Ru,Pd,Pt,Au,Rh)/TiO2制備:①將P25粉末分別浸漬在不同貴金屬前驅物溶液中,攪拌30 min后烘干;②300°C條件下50%(體積分數)H2/He混合氣氛中還原2 h,得到還原法制備的貴金屬負載P25光催化劑;(3)NiOx含量為1%的NiOx/TiO2催化劑的制備:① 將P25粉末浸漬在Ni(NO3)2溶液中,攪拌30 min后烘干;②350°C空氣氣氛中焙燒1 h;③400°C條件下50%(體積分數) H2/He混合氣氛中還原2 h,冷卻至室溫;④200°C條件下50%(體積分數)O2/Ar混合氣氛中氧化2 h,制備出NiOx負載P25光催化劑;(4)RuO的質量分數為1%的RuO/TiO2制備:將P25粉末浸漬Ru鹽溶液中,攪拌30 min后烘干,在400°C空氣氣氛中焙燒4 h.
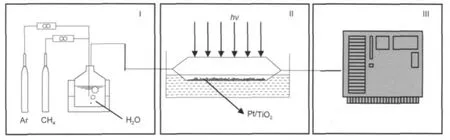
圖1 連續式光催化重整甲烷-水氣制氫評價示意圖Fig.1 Sketch of the experimental set up for photocatalytic steam reforming of methaneI:feeding system,II:photo-catalyzed reaction equipment,III:production detection part
連續式光催化重整甲烷-水氣制氫評價裝置見圖1.該套測試裝置包括三個部分:I為供料系統, CH4由氣瓶提供,水氣發生器提供水氣,混合反應物的流量由質量流量計調節;II為光催化反應裝置,催化劑平鋪在石英反應器底部,光源由上部照到催化劑表面,反應器用水冷卻;III為產物檢測部分,由在線氣相色譜儀分析產物組成及其產量.氣體產物從反應器中流入自動取樣器中被Ar帶出,進入色譜的碳分子篩TDX-01填充柱分離,然后進入熱導檢測器(TCD),測H2、O2和N2的含量.從TCD出來的氣體和高純氫氣混合后,一起進入甲烷轉化器,將CO、CO2轉化成甲烷,最后進入氫火焰離子化檢測器(FID)檢測甲烷含量,從而測定CO、CO2的含量.不同氣體產物的檢測靈敏度(體積分數)大約是:H2,≥100×10-6;C2H6、C2H4、CH4,≥1×10-6;CO、CO2,≥2× 10-6.光催化甲烷水蒸氣重整制氫反應是在一個連續式固定床系統中進行.光催化反應前,通入Ar氣對系統進行排空處理,除去系統中的空氣.光催化反應在接近室溫條件下進行.反應過程中通過控制水氣發生器的溫度,改變水的飽和蒸氣壓,獲得不同的反應物的摩爾比,使得進料配比可以調節.
3 結果與討論
3.1 光催化反應
圖2為光催化重整甲烷-水氣制氫反應產物隨時間的變化曲線圖.從圖2可以看出,開始反應時H2和CO2產率都比較低,而且波動比較大,隨著反應時間的延長,產率都增大,1200 min后趨于穩定,氫氣產率可達0.13 μmol·min-1,CO2產率可達0.07 μmol· min-1,H2/CO2摩爾比基本穩定在1.8,相比方程(1)的理論化學計量比4要低.另外還檢測到微量或者痕量的C2H6、C2H4和CO存在,說明該體系中反應式(1)是主反應,同時還存在其它的競爭反應.

圖2 產物的產率及H2/CO2摩爾比隨時間的變化曲線Fig.2 Time course of the production rate and the molar ratio of H2/CO2catalyst:p-Pt/TiO2;total flow rate of materials:0.5 mL·min-1; n(CH4)/n(H2O)=13;λ>200 nm
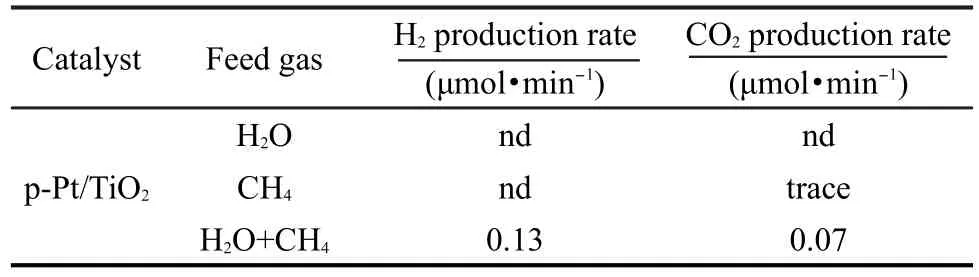
表1 不同進料條件下的氫氣產率Table 1 H2production rate in various feed gas conditions
為了驗證CH4在該催化反應中的作用,不同的進料下氫氣的產率結果見表1.如果只有水氣進入光反應器中,沒有檢測到(用nd表示)H2與CO2存在;進氣只有CH4,只能檢測到微量CO2和C2H6.微量的C2H6可能來自光催化甲烷偶聯反應.16,17結合上面的結果可以看出,CH4的加入促進了光分解水反應,使得重整甲烷-水氣制氫反應通過光催化也能得以實現,且熱力學上該反應的吉布斯自由能也比水分解的低.
3.2 CH4/H2O摩爾比對氫氣產率的影響
不同CH4/H2O進料摩爾比對氫氣產率的影響隨時間的變化曲線見圖3.由圖3可以看出不同的進料比對氫氣產率有很大的影響,但氫氣產率隨時間的變化趨勢基本一致,都是漸漸增加,最后基本達到穩定.隨著CH4/H2O進料摩爾配比減小,氫氣產率提高,說明H2O量的增加促進反應向右進行,有利于氫氣的生成.另外,發現CH4量對副產物CO和C2H6影響很大,高濃度會促進CO生成,降低C2H6生成.再結合圖4的氫氣產率和H2/CO2比值隨進料摩爾比變化的曲線,當CH4/H2O進料摩爾比為4時對應的H2/ CO2比值和氫氣產率為最高,故可以認為CH4/H2O進料摩爾比為4時最優.
3.3 總流速對氫氣產率的影響
圖5給出了總進料流速對氫產率的影響隨時間的變化曲線.
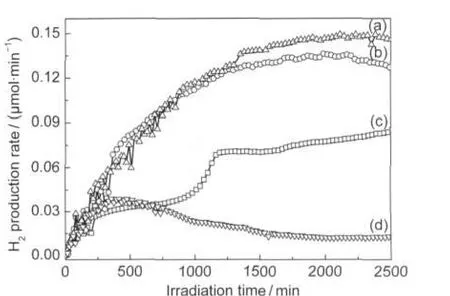
圖3 不同CH4/H2O進料摩爾比對氫氣產率的影響隨時間的變化曲線Fig.3 Time course of H2production rate in various molar ratio of CH4/H2On(CH4)/n(H2O):(a)1,(b)4;(c)43,(d)13;catalyst:p-Pt/TiO2; total flow rate of materials:0.5 mL·min-1,λ>200 nm
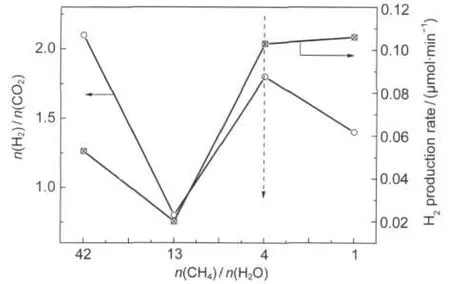
圖4 CH4/HO2的進料摩爾比對氫氣產率和生成物H2/CO2摩爾比的影響Fig.4 Effect of molar ratio of CH4/H2O on H2production rate and molar ratio of H2/CO2
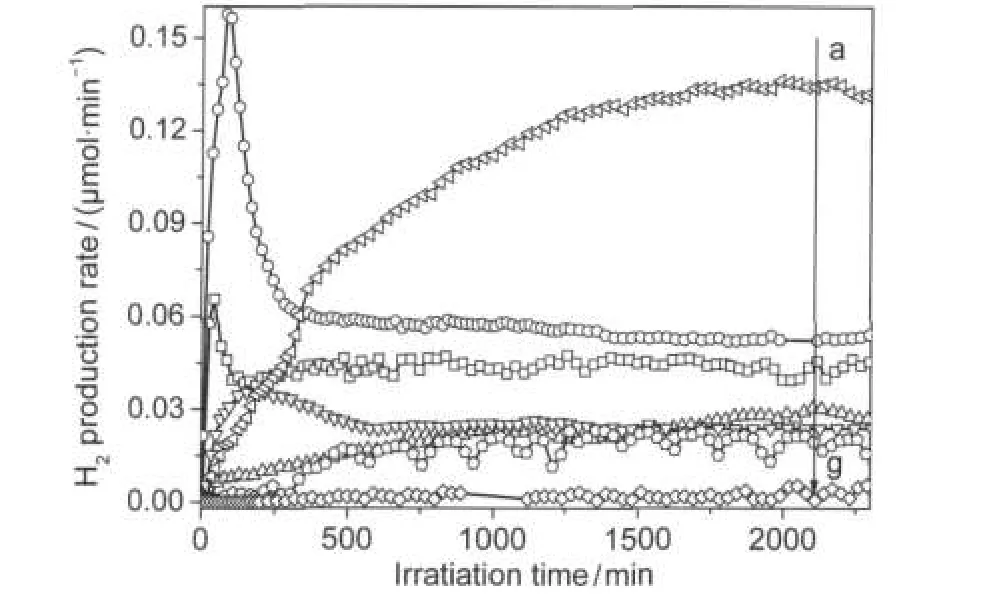
圖5 不同流速對氫氣產率的影響隨時間的變化曲線Fig.5 Time course of H2production rate in various flow ratesflow rate/(mL·min-1):(a)0.5,(b)5,(c)10,(d)2.5,(e)1, (f)0.2,(g)0.05;catalyst:p-Pt/TiO2;n(CH4)/n(H2O)=13;λ>200 nm
從a→g對應的流速分別為0.5、5、10、2.5、1、0.2和0.05 mL·min-1.不同流速下氫氣產率隨時間的變化趨勢一致:先增加,反應一段時間達到平衡.但流速為0.05和0.2 mL·min-1時,氫氣產率波動很大,可能由流速太低固定床系統不穩定導致.而流速為5和10 mL·min-1時,氫氣開始快速增加再回落達到平衡,可能由于高流速使產生的氫氣很快從催化劑表面脫附.
反應物與催化劑的接觸時間為流速的倒數,即流速越大,接觸時間越短,因此反應時間縮短,反應物還來不及進行反應就離開了催化劑,從而使得氫氣產率下降;在較低流速下,反應物與催化劑表面形成的邊界層較厚,傳質速率較低,反應受氣固間傳質所控制,使得氫氣產率下降.綜合圖6氫氣產率和H2/CO2摩爾比隨總流速的變化曲線,流速為0.5 mL·min-1時對應的氫氣產率和H2/CO2比值最佳.
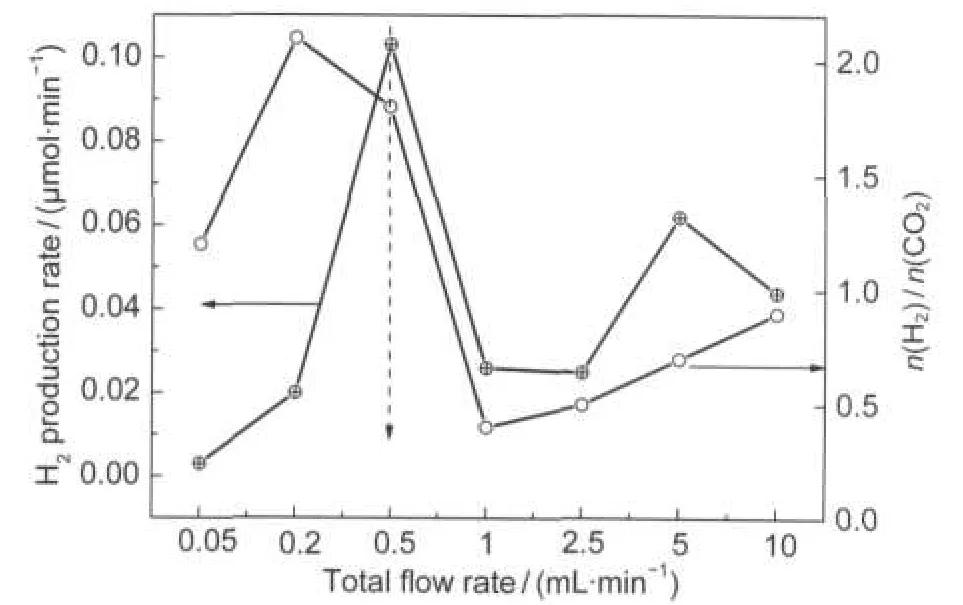
圖6 總流速對氫氣產率和生成物H2/CO2摩爾比的影響Fig.6 Effect of the total flow rate on H2production rate and molar ratio of H2/CO2
3.4 助催化劑的影響
為了研究助催化劑對光催化重整甲烷-水氣制氫反應的影響,制備了不同的貴金屬和金屬氧化物負載在P25上的光催化劑.助催化劑對重整反應影響很大,結果見圖7.以Ru和Rh為助催化劑時基本檢測不到H2存在,Ru/TiO2的副產物CO比較大,有意義的是C2H4的產率隨著反應時間的延長逐漸提高,而C2H6變化規律是緩慢提高,當C2H4降到最低達到平衡時,C2H6也趨于平衡,可以推測在Ru作為助催化劑時,主要的反應可能是光催化非氧化偶聯反應.18Ag、Pt為助催化劑時,發現氫氣的產率很低,相對于光沉積負載Pt而言,要低于3個數量級,說明助催化劑負載的方式影響很大,光還原法能使金屬Pt顆粒粒徑比較小而且均勻分散在TiO2表面,能夠有效地獲得TiO2導帶上的光生電子.12浸漬還原法導致金屬Pt顆粒團聚,粒徑變大且不均勻分散在TiO2表面,故光沉積負載貴金屬方式優于浸漬還原法.
Pd作為助催化劑時,氫氣的產率最高,重要的是沒有產生使催化劑中毒的CO,可能與Pd對甲烷的強吸附相關.對于貴金屬單質而言,氫氣的產率大小順序為Pd>Au>Pt≈Ag>Rh、Ru,這一規律與文獻19報道光催化重整生物質葡萄糖基本一致.NiOx和RuO2作為助催化劑時,氫氣的產率相近,相對于Pt來說要高2個數量級,生成C2H4的競爭反應對整個光催化反應的貢獻比較大.另外,在浸漬還原法制備的所有光催化劑中發現生成物H2/CO2的摩爾比遠小于主反應的化學計量比4.可推測不同的助催化劑下,存在以下反應和主反應間的競爭:

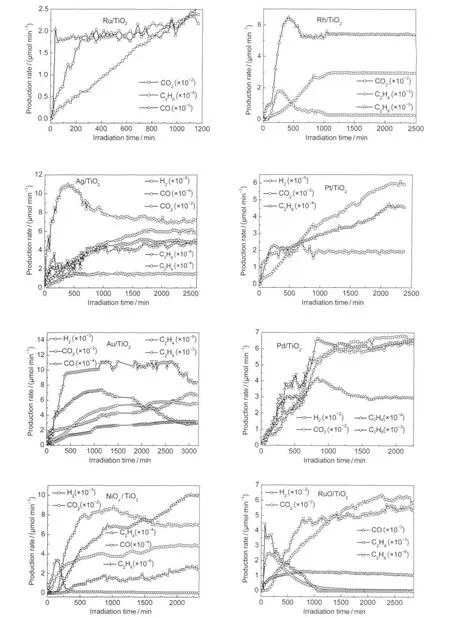
圖7 助催化劑的影響Fig.7 Effect of co-catalysts
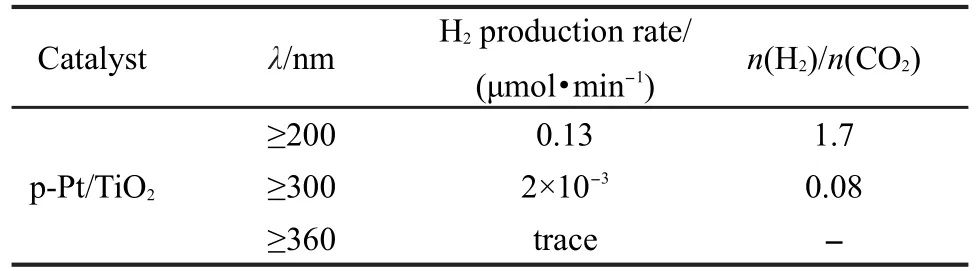
表2 入射光波長對氫氣產率的影響Table 2 Effect of irradiation light wavelength on H2production rate
3.5 入射光波長對氫氣產率的影響
入射光波長對氫氣產率的影響如表2所示.本實驗的光源是300 W紫外加強氙燈.通過濾波片把小于360 nm波長的光濾去,結果只有痕量的H2和CO2產生,說明大于360 nm波長的光不能促進光催化重整甲烷-水氣制氫反應進行.而濾去波長小于300 nm的光,反應穩定后氫氣的產率約為2×10-3μmol·min-1,生成物H2/CO2摩爾比只有0.08,說明主反應在大于300 nm波長的競爭反應中所占比例很小.大于200 nm波長光照射時氫氣的產率可以達到0.13 μmol·min-1,H2/CO2摩爾比可達1.7.故重整反應起到激發作用的光的波長主要在200-300 nm之間,且小于TiO2紫外-可見光吸收邊(380 nm),說明p-Pt/TiO2起到了光催化作用.
3.6 催化劑量對氫氣產率的影響
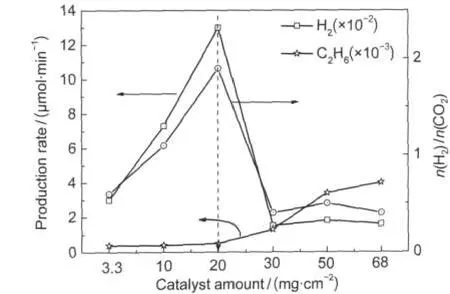
圖8 催化劑用量對氫氣產率和生成物H2/CO2摩爾比的影響Fig.8 Effect of amount of catalyst on H2production rate and molar ratio of H2/CO2catalyst:p-Pt/TiO2;total flow rate of materials:0.5 mL·min-1; n(CH4)/n(H2O)=13,λ>200 nm

圖9 p-Pt/TiO2光催化劑的循環使用對氫氣產率的影響Fig.9 Recycling efficiency of the p-Pt/TiO2photocatalyst on H2production ratecatalyst:p-Pt/TiO2;total flow rate of materials:0.5 mL·min-1; n(CH4)/n(H2O)=13;λ>200 nm
圖8為催化劑用量對氫氣產率的影響.固體床反應器是底面60 nm×50 nm平底石英反應器,催化劑平鋪在底面上.隨著催化劑的用量增加氫氣產率提高,催化劑的量為20 mg·cm-2時達最大,再隨催化劑量增加氫氣產率減小,基本保持穩定.H2/CO2摩爾比與氫氣產率有相同的變化趨勢.可以認為隨催化劑量的增加光照面積也增大,相同量的反應物和催化劑的接觸點增多,同樣光催化活性位也增多,故氫氣產率增大.但是催化劑用量的進一步增加不能繼續提高氫氣產率,原因主要為光在催化劑表面的照射深度達到了極限值.當催化劑的用量達到30 mg·cm-2以后,發現氫氣的產率反而下降到基本保持一個穩定值.這一現象可能是由于催化劑量的增加,催化劑表面的水氣冷凝,氣固兩相反應變成了多相反應.副產物C2H6隨著催化劑用量的增加逐漸增大,再趨于穩定.由于CH4不會在催化劑表面冷凝,光催化甲烷偶聯競爭反應比重增大.故最優催化劑用量為20 mg·cm-2.
3.7 催化劑的循環使用對氫氣產率的影響
本文對光催化重整甲烷-水氣制氫反應所采用的p-Pt/TiO2催化劑進行重復使用,所得結果見圖9.
在催化劑重復使用實驗中,每次實驗達到平衡后繼續反應到2550 min后關燈,色譜繼續測試出口端氫氣濃度的變化,一直到檢測不到氫氣為止,再開燈繼續下一輪實驗.由圖9可見,該催化體系具有良好的穩定性.雖然第二輪和第三輪反應平衡時間相對于第一輪反應要長,但隨著催化劑重復使用次數的增加,反應達平衡后氫氣的產率并未受到明顯的影響,這表明催化劑的穩定性很好,具有較好的應用前景.
4 結論
研究了以光沉積法負載Pt的TiO2(p-Pt/TiO2)為光催化劑,室溫下在固定床裝置中實現連續動態光催化甲烷重整水氣制氫反應CH4+2H2O(g)→4H2+ CO2,并考察了不同的實驗參數對反應的影響,得出最優化的實驗條件.p-Pt/TiO2的催化活性要優于浸漬法負載Pt的TiO2催化劑,相同的浸漬法負載不同的助催化劑時,其中以Pd和NiOx為比較優異的助催化劑.另外,以p-Pt/TiO2為催化劑時,CH4/H2O進料摩爾比為4時,產物中氫氣產率及H2/CO2摩爾比值達到最高;0.5 mL·min-1的總流速為最佳進料流速;對主反應起到激發的主要波長在200-300 nm之間;固定床裝置的最佳催化劑用量為20 mg·cm-2.最后循環實驗結果表明p-Pt/TiO2及反應體系都具有比較高的穩定性.
(1) Fujishima,A.;Honda,K.Nature 1972,238,37.
(2) Sakata,T.;Kawai,T.Nature 1979,282,283.
(3) Li,Y.X.;Gao,D.;Peng,S.Q.;Lu,G.X.;Li,S.B.Int.J. Hydrog.Energy 2011,36,4291.
(4) Luo,N.J.;Jiang,Z.;Shi,H.H.;Cai,F.H.;Xiao,T.C.; Edwards,P.P.Int.J.Hydrog.Energy 2009,34,125.
(5) Chiarello,G.L.;Forni,L.;Selli,E.Catal.Today 2009,144,69.
(6) Strataki,N.;Bekiari,V.;Kondarides,D.I.;Lianos,P.Appl. Catal.B 2007,77,184.
(7) Sato,S.;White,J.M.Chem.Phys.Lett.1980,70,131.
(8) Sato,S.;White,J.M.J.Catal.1981,69,128.
(9) Bowker,M.;Philip,R.D.;Al-Mazroai,L.S.Catal.Lett.2009, 128,253.
(10) Geert,L.;Anne,B.T.;Luc,D.B.;Willy,V.;Birgitte,K.A. Environ.Sci.Technol.2004,38,3418.
(11) Shimura,K.;Yoshida,H.Energy Environ.Sci.2010,3,615.
(12) Yoshida,H.;Hirao,K.;Nishimoto,J.;Shimura,K.;Kato,S.; Itoh,H.;Hattori,T.J.Phys.Chem.C 2008,112,5542.
(13) Shimura,K.;Kato,S.;Yoshida,T.;Itoh,H.;Hattori,T.;Yoshida, H.J.Phys.Chem.C 2010,114,3493.
(14) Yoshida,H.;Kato,S.;Hirao,K.;Nishimoto,J.I.;Hattori,T. Chem.Lett.2007,36,430.
(15) Shimura,K.;Yoshida,T.;Yoshida,H.J.Phys.Chem.C 2010, 114,11466.
(16)Yuliati,L.;Yoshida,H.Chem.Sco.Rev.2008,37,1592.
(17) Yuliati,L.;Hamajima,T.;Hattori,T.;Yoshida,H.J.Phys. Chem.C 2008,112,7223.
(18) Yuliati,L.;Hattori,T.;Itoh,H.;Yoshida,H.J.Catal.2008,257, 396.
(19) Fu,X.L.;Long,J.L.;Wang,X.X.;Fu,X.Z.Int.J.Hydrog. Energy 2008,33,6484.
August 5,2011;Revised:December 6,2011;Published on Web:December 14,2011.
Hydrogen Evolution by Photocatalytic Steam Reforming of Methane over Pt/TiO2
LI Cao-Long1,2CHEN Wei1YUAN Jian1SHANGGUAN Wen-Feng1,*
(1Research Center for Combustion and Environment Technology,Shanghai Jiao Tong University,Shanghai 200240,P.R.China;2Department of Inorganic Chemistry of Basic Courses,China Pharmaceutical University,Nanjing 211169,P.R.China)
Photocatalytic reaction of CH4gas with H2O vapor over Pt/TiO2at around room temperature(ca 323 K)was examined in a flow reactor.H2and CO2were the main products,and only trace amounts of C2H6,C2H4,and CO were observed.After an induction period,the molar ratio of H2to CO2in the outlet gas became close to 1.7.Thus,the main reaction is suggested to be:CH4+2H2O(g)→4H2+CO2,which can be referred to as photocatalytic steam reforming of methane(PSRM).The reaction would be promoted by photoexcited electrons and holes,which were generated by band gap photoexcitation of the TiO2photocatalyst.In addition,the effects of reaction parameters,such as molar ratio of CH4to H2O,total flow rate,noble-metal cocatalysts,wavelength of irradiating light,amounts of catalysts,and recycling efficiency of the p-Pt/TiO2photocatalyst via light deposition of preformed Pt nanoparticles on P25,on the hydrogen evolution were investigated.
Photocatalytic reforming;Hydrogen;CH4;Steam;TiO2
10.3866/PKU.WHXB201112141
*Corresponding author.Email:shangguan@sjtu.edu.cn;Tel:+86-21-34206020.
The project was supported by the National Natural Science Foundation of China(20973110)and National Key Basic Research Program of China(973) (2009CB220000).
國家自然科學基金(20973110)及國家重點基礎研究發展規劃項目(973)(2009CB220000)資助
O643

