慢性腎小球腎炎患者脈搏波傳導速度和動脈順應性的變化及影響因素研究
畢海燕,鐘 玲
在中國及發展中國家,慢性腎炎是引起終末期腎病的主要疾病。一方面患者腎功能發生慢性進行性的不可逆的下降,另外一方面,產生的心血管系統并發癥已成為患者死亡的第一位原因。大動脈僵硬程度與冠狀動脈粥樣硬化程度以及心血管疾病的死亡率直接相關[1]。慢性腎小球腎炎患者與同齡的單純高血壓患者相比,動脈僵硬度更高,校正的全因和心血管死亡率更高[2]。本研究旨在探討慢性腎小球腎炎患者脈搏波傳導速度(PWV)、大動脈順應性指數(C1)、小動脈順應性指數(C2)的變化及其相關影響因素,以期對預防和治療這類心血管事件有所幫助。
1 對象與方法
1.1 研究對象 選取2011年3月—2012年3月于重慶醫科大學附屬第二醫院住院的原發性腎小球腎炎患者90例,其中男41例,女49例;年齡(49.4±14.1)歲。排除標準:入選前1個月發生急性心腦血管事件、創傷、手術、嚴重感染、嚴重肝功能異常、精神異常、惡性腫瘤、外周血管動脈血栓性疾病、糖尿病、痛風。根據腎小球濾過率(eGFR)水平,將90例原發性腎小球腎炎患者分為病變早中期組〔eGFR≥30 ml·min-1·(1.73 m2)-1〕39例和病變晚期組〔eGFR<30 ml·min-1·(1.73 m2)-1〕51例,另選取年齡、性別匹配的健康成年人72例作為對照組,所有受試者對檢查項目知情同意。
1.2 方法
1.2.1 一般項目檢查 記錄受試者性別、年齡,測量身高、體質量,計算體質指數(BMI)。禁食8 h以上,次晨抽取靜脈血檢測血肌酐(Scr)、血尿酸(SUA)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、三酰甘油(TG)、總膽固醇(TC)。收集受試者24 h尿液,記錄尿總量,將尿液攪勻,留50~100 ml尿樣本送檢測定24 h尿蛋白定量。儀器采用日立7600-020全自動生化分析儀。采用改良MDRD公式計算患者的eGFR。采用24 h動態血壓監測分析儀(ES-H531,泰爾茂,東京,日本)監測受試者血壓〔日間收縮壓(d-SBP)、日間舒張壓(d-DBP),夜間收縮壓(n-SBP)、夜間舒張壓(n-DBP),24 h收縮壓(24 h-SBP),24 h舒張壓(24 h-DBP)〕,起止時間為10∶00~次日10∶00,檢測間隔時間為30 min,數據丟失超過4次,則視為無效數據。
1.2.2 動脈硬化功能指標測定 采用宇峰科技公司YF/XGYD-2000A動脈硬化測量儀。患者安靜休息5 min,取仰臥位,雙手置于身體兩側。將袖帶縛于上臂及下肢踝部,使上臂袖帶氣囊標志處對準肱動脈,袖帶的下緣距離肘窩橫紋2~3 cm,下肢袖帶氣囊標志處置于下肢內側,袖帶下緣距離內踝l~2 cm,再將一袖帶縛于左手手腕部,采用上肢肱動脈、橈動脈,下肢腳踝脛后動脈五點臥姿測量,氣泵自動加壓,儀器自動分析,打印輸出PWV、C1、C2值。
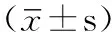
2 結果
2.1 一般資料比較 與對照組相比,病變早中期組、晚期組的eGFR均降低,LDL、TC、TG、UA、Scr、尿蛋白定量、各個階段動態血壓值均升高,差異均有統計學意義(P<0.05);與早中期組相比,晚期組的eGFR降低,Scr、SUA、各個動態血壓值升高,差異均有統計學意義(P<0.05,見表1)。
2.2 動脈硬化指標比較 與對照組相比,病變早中期組和晚期組PWV增快,且晚期組快于早期組,差異均有統計學意義(P<0.05);病變早中期組和晚期組的C1、C2都較對照組降低,且晚期組低于早中期組,差異均有統計學意義(P<0.05,見表2)。
2.3 動脈硬化指標與臨床生化指標相關性分析 結果顯示,PWV與eGFR呈負相關,與動態血壓各個值、SUA、TC、Scr呈正相關;C1與eGFR呈正相關,與LDL、SUA、動態血壓各個值呈負相關;C2與eGFR呈正相關,與SUA、Scr、動態血壓各個值呈負相關;尿蛋白、HDL、TG、BMI與3個動脈硬化指標均無相關性(見表3)。
2.4 動脈硬化指標的多元線性回歸分析 將與PWV、C1、C2有線性關系的參數進行向后逐步多元線性回歸分析,其中因為Scr、SUA是隨eGFR變化,故不將此兩個指標納入回歸。PWV的主要影響因素是eGFR(β=-0.404,P=0.024)和n-DBP(β=0.211,P=0.001),C1的主要影響因素是d-SBP(β=-0.052,P=0.049)、d-DBP(β=-0.199,P=0.043)、n-DBP(β=-0.283,P=0.002),C2的主要影響因素是eGFR(β=0.031,P=0.034)、n-SBP(β=-0.007,P=0.037)、n-DBP(β=-0.087,P=0.000)、24 h-DBP(β=-0.084,P=0.001)。
表2 對照組和病變早中期組、晚期組動脈硬化指標比較
Table2 Comparison of the atherogenic indexes in lesions early and middle group,advanced group and the control group

組別PWV(m/s)C1(ml/mmHg×10)C2(ml/mmHg×10)對照組13.54±1.77 12.60±2.95 5(3~12)▲ 早中期組15.88±2.94* 10.08±0.53* 4(3~7)*▲晚期組20.09±2.94*△ 8.17±1.82*△ 2.94±0.64*△
注:PWV=脈搏波傳導速度;與對照組比較,*P<0.05;與早中期組比較,△P<0.05;▲表示偏態分布
表3 動脈硬化指標與臨床生化指標相關性分析
Table3 Analysis of the correlation between atherogenic indexes and clinical biochemical indicators

臨床生化指標動脈硬化指標PWVr值 P值 C1r值 P值 C2r值 P值eGFR-0.678 0.000 0.445 0.012 0.566 0.001HDL 0.477 0.007-0.333 0.067-0.578 0.001LDL 0.014 0.942-0.086 0.646 0.012 0.948TC 0.328 0.072-0.394 0.028-0.194 0.296TG 0.362 0.045-0.320 0.079-0.144 0.439SUA 0.100 0.593-0.320 0.079-0.157 0.399Scr 0.490 0.005-0.444 0.012-0.610 0.000Proteinuria 0.266 0.148-0.206 0.266-0.154 0.408d-SBP 0.617 0.000-0.596 0.000-0.488 0.005n-SBP 0.637 0.000-0.617 0.000-0.524 0.00224h-SBP 0.681 0.000-0.607 0.000-0.460 0.000d-DBP 0.753 0.000-0.699 0.000-0.609 0.000n-DBP 0.631 0.000-0.610 0.000-0.509 0.00324h-DBP 0.727 0.000-0.662 0.000-0.540 0.002BMI 0.085 0.651-0.054 0.655-0.143 0.442

表1 對照組和病變早中期組、晚期組一般資料比較
注:eGFR=腎小球濾過率,HDL=高密度脂蛋白,LDL=低密度脂蛋白,TC=總膽固醇,TG=三酰甘油,SUA=血尿酸,Scr=血肌酐,d-SBP=日間收縮壓,n-SBP=夜間收縮壓,24 h-SBP=24 h收縮壓,d-DBP=日間舒張壓,n-DBP=夜間舒張壓,24 h-DBP=24 h舒張壓;與對照組比較,*P<0.05;與早中期組比較,△P<0.05
3 討論
慢性腎臟病(CKD)患者血管硬化發生時間早,早期可無任何相應的臨床表現[3]。能早期發現與檢測血管硬化,有利于預防CKD患者的心血管并發癥。PWV是評估外周動脈硬化程度的常用指標,指當心臟收縮、血液被擠壓時脈搏波從心臟傳遞到終端動脈的速度,其大小可以反映動脈壁硬度。Chen等[4]發現PWV可預測CKD患者腎功能下降、步入血液透析的速度,與死亡率有關。C1是大動脈順應性指數,其數值下降提示大動脈彈性減退,順應性下降,是預測心血管疾病發生和死亡的有價值的指標。C2是小動脈順應性指數,為反映內皮功能損害的早期指標,C1、C2在CKD患者中的應用尚很少。
本研究顯示,慢性腎小球腎炎患者的動脈硬化程度高于對照組,并且隨著病情進展,PWV升高,C1、C2降低。導致動脈硬化發生發展的危險因素復雜,Sengstock等[5]發現在CKD患者中,PWV與SBP、糖尿病、BMI、年齡、eGFR等因素有關,并且eGFR是其獨立預測因子。Chen等[6]發現在普通人群中順應性指數與PWV、收縮壓、舒張壓等多種因素相關。本研究發現,PWV與eGFR呈負相關,與各個動態血壓值、SUA、TC、Scr呈正相關,C1與eGFR呈正相關,與LDL、SUA、各個動態血壓值呈負相關,C2與eGFR呈正相關,與SUA、Scr、各個動態血壓值呈負相關;PWV的主要影響因素是eGFR、n-DBP,C1的主要影響因素是d-SBP、d-DBP、n-DBP,C2的主要影響因素是eGFR、n-SBP、n-DBP、24 h-DBP。
本研究中TG、TC、HDL、LDL 4個血脂代謝的指標中,TC、LDL與PWV及C1有相關性,提示TC、LDL在動脈硬化形成過程中的作用較大。LDL膽固醇在動脈管壁內皮下沉積,促進血管平滑肌細胞增生、鈣化,促進粥樣斑塊形成。高血壓是慢性腎炎的一種主要臨床表現,收縮壓、舒張壓與動脈硬化均有相關性,尤其是夜間血壓,其同時是PWV、C1、C2的主要影響因素。高血壓使血管內皮功能紊亂,動脈彈力層受到牽拉,彈性纖維受損、彈性減退發生斷裂。夜間血壓持續在高水平,高血壓負荷更長時間的作用于心血管系統,血管壁結構發生重塑繼而增厚[7];激活腎素-血管緊張素-醛固酮系統,血管緊張素Ⅱ通過促進細胞增殖及炎癥反應[8-10],另外,使內皮系統功能紊亂,夜間高血壓患者體內纖溶酶原激活物抑制劑、細胞間黏附分子等因子較血壓節律正常患者顯著升高[11]。eGFR與C1、C2呈正相關,與PWV呈負相關,是PWV、C2的主要影響因素之一,腎小球濾過率下降,激活腎素-血管緊張素-醛固酮系統,損傷血管;另外,腎功能下降患者體內普遍存在炎癥反應、毒素堆積,損傷血管內皮,刺激炎癥、氧化應激反應,促進平滑肌細胞增殖,促進動脈硬化[12-13]。本研究未發現BMI與PWV和動脈順應性有關,這與許多研究結果不符,原因可能是:(1)樣本量不夠大;(2)多個因素間相互影響;(3)存在不可避免的測量誤差。
綜上,慢性腎小球腎炎患者隨著病情進展,動脈硬化程度增高,多種傳統、非傳統致動脈硬化的危險因素并存,共同促進動脈硬化的發生發展,這就需要臨床診療過程中全面觀察檢測患者的各項相關指標,尤其是血脂、eGFR及血壓,預防和早期發現動脈硬化,以減少心血管疾病的發生。
1 Cohn JN,Duprez DA,Grandits GA.Arterial elasticity as part of a comprehensive assessment of cardiovascular risk and drug treatment.[J].Hypertension,2005,46(1):217-220.
2 Wang MC,Tsai WC,Chen JY,et al.Stepwise increase in arterial stiffness corresponding with the stages of chronic kidney disease[J].Am J Kidney Dis,2005,45(3):494-501.
3 Bellasi A,Ferramosca E,Ratti C.Arterial stiffness in chronic kidney disease:the usefulness of a marker of vascular damage[J].Int J Nephrol,2011,2011:734832.
4 Chen SC,Chang JM,Liu WC,et al.Brachial-ankle pulse wave velocity and rate of renal function decline and mortality in chronic kidney disease[J].Clin J Am Soc Nephrol,2011,6(4):724-732.
5 Sengstock D,Sands RL,Gillespie BW,et al.Dominance of traditional cardiovascular risk factors over renal function in predicting arterial stiffness in subjects with chronic kidney disease[J].Nephrol Dial Transplant,2010,25(3):853-861.
6 Chen JY,Tsai WC,Wu MS,et al.Novel Compliance Index derived from digital volume pulse associated with risk factors and exercise capacity in patients undergoing treadmill exercise tests[J].J Hypertens,2007,25(9):1894-1899.
7 Ripp TM,Mordovin VF,Pekarskii SE,et al.Correlation between the parameters of 24-hour monitoring of arterial pressure and changes in arterial wall structure based on the results of a prospective trial[J].Ter Arkh,2006,78(12):46-49.
8 Mitsuhashi H,Tamura K,Yamauchi J,et al.Effect of losartan on ambulatory short-term blood pressure variability and cardiovascular remodeling in hypertensive patients on hemodialysis[J].Atherosclerosis,2009,207(1):186-190.
9 Hirata Y,Fukuda D,Sata M.Critical role of renin-angiotensin system in the pathogenesis of atherosclerosis[J].Nihon Rinsho,2011,69(1):55-59.
10 王磊,韓戰營,邱春光.胸痛并慢性腎功能不全患者的冠狀動脈造影分析[J].中國全科醫學,2012,15(7):2342.
11 Von Kanel R,Jain S,Mills PJ,et al.Relation of nocturnal blood pressure dipping to cellular adhesion,inflammation and hemostasis[J].J Hypertens,2004,22(11):2087-2093.
12 Briet M,Burns KD.Chronic kidney disease and vascular remodelling:molecular mechanisms and clinical implications[J].Clin Sci(Lond),2012,123(7):399-416.
13 任文,方力爭,杜亞平.代謝綜合征與慢性腎臟病的關系[J].中國全科醫學,2012,15(2):480.

