鈀配合物對人乳腺癌細胞MCF-7增殖的抑制作用及機制
姜 虹 朱國巍 王麗君 (北華大學化學與生物學院,吉林 吉林 132013)
乳腺癌是嚴重威脅女性健康的最常見惡性腫瘤之一,近年來躍居女性惡性腫瘤發病率首位〔1〕。腫瘤的發生和發展與細胞凋亡失控密切相關,因此,利用凋亡調控機制尋找高效低毒、作用機制明確的凋亡誘導劑已成為腫瘤防治的一個重要策略。基于含硒小分子化合物具有在信號轉導過程中的調控機制及其相應的細胞生理功能〔2〕,結合鈀配合物(PBIPS)誘導腫瘤細胞凋亡的作用〔3〕,本文以含硒小分子為配體,設計合成了新型含硒生物活性小分子配合物,經元素色譜分析、紅外光譜分析等進行表征(結構式見圖1),以乳腺癌細胞(MCF-7)為體外模型,研究PBIPS對MCF-7增殖抑制及其誘導該細胞凋亡的能力,探討其作用的分子機制,以求為乳腺癌的治療尋求新的有效方法、策略提供基礎研究資料。
1 材料與方法
1.1 主要材料與儀器 PBIPS由本實驗室制備,MCF-7(中國科學院上海細胞生物學研究所),RPMI-1640培養液(Gibco),胎牛血清(杭州四季青生物工程有限公司),碘化丙啶(PI)(美國Caltag公司),吖啶橙(A0)/溴乙啶(EB)(華美生物工程有限公司),β-肌動蛋白(β-actin)、Bcl-2,survivin、半胱氨酸蛋白酶(Caspase-3)抗體(Santa Cruz Biotechnologies公司)。流式細胞儀(FCM)(美國 Beckman coulter公司),描定蛋白/碘化丙啶(Annexin/PI)凋亡檢測試劑盒(北京寶賽公司),BX51TF熒光顯微鏡(日本OLYMPUS公司)。
1.2 方法
1.2.1 細胞培養 MCF-7細胞均常規培養于含10%胎牛血清,100 U/ml青霉素和鏈霉素的RPMI-1640完全培養液中,于37℃,體積分數5%CO2培養箱培養,取對數生長期細胞進行試驗。
1.2.2 細胞增殖活性測定 取對數生長期的MCF-7細胞,以細胞數1.5×104/孔接種于96孔板。37℃、5%CO2培養箱中培養24 h,再加入PBIPS,使每孔的終質量濃度分別為0、12.5、25、50、100、150、200 μg/ml(每個質量濃度設 5 個平行孔),同時設置陰性對照。分24 h、48 h、72 h共3個培養時間段。培養結束時棄上清,加入5 mg/ml的噻唑藍(MTT)試劑10 μl,37℃、5%CO2孵箱繼續培養4 h,取出加入DMSO 150 μl/孔,充分振蕩10 min溶解,酶標儀490 nm處測定每孔的吸光度A值,計算細胞增殖抑制率〔4〕。抑制率(%)=〔A(陰性)/A(給藥)〕/〔A(陰性)/A(空白)〕×100%。

圖1 PBIPS結構式
1.2.3 熒光顯微鏡觀察MCF-7細胞凋亡 取對數生長期MCF-7細胞懸液接種于培養瓶中,待細胞貼壁后加入終濃度為100 μg/ml的 PBIPS 處理,同時設對照組,分別作用 24 h、48 h、72 h后終止培養,收集細胞懸液,用磷酸鹽緩沖液(PBS)洗滌2次,AO/EB染色后在熒光顯微鏡下觀察MCF-7細胞的凋亡情況。
1.2.4 FCM檢測PBIPS對MCF-7細胞凋亡的影響 選取對數生長期細胞接種于24孔板中,加入PBIPS使其終濃度分別為 50 μg/ml(低劑量組)、100 μg/ml(中劑量組)、200 μg/ml(高劑量組),處理細胞24 h、48 h、72 h后,用0.25%胰酶+0.02%乙二胺四乙酸(EDTA)消化,計數后取約 5×105個細胞,1 000 r/min離心5 min后棄上清液,用預冷PBS洗滌2次,按試劑盒說明書加入 Annexin V-FITC 10 μl和 PI 5 μl,避光室溫反應15 min,在1 h內用流式細胞儀檢測。以AnnexinⅤ+細胞比率作為細胞凋亡率,實驗重復3次,另設空白對照組。
1.2.5 Western印跡檢測PBIPS對MCF-7細胞凋亡相關蛋白表達的影響 應用Western印跡技術,以β-actin作為內照物,比較各組survivin、Caspase-3、Bcl-2和 Bax蛋白表達水平的改變。作用 48 h后分別收集空白對照組、PBIPS 50、100、200 μg/ml劑量組的細胞,PBS洗3次,加入預冷的細胞裂解液,裂解后離心取上清,用Bradford法測定各種蛋白的濃度。分別取蛋白樣品,按體積比4∶1加入上樣緩沖液,100℃、5 min變性,經十二烷基硫酸鈉-聚丙烯酰胺凝膠(SDS-PAGE)(5%的濃縮膠,18%的分離膠)電泳分離后,將蛋白電轉印于硝酸纖維素膜經脫脂奶粉封閉液封閉,將硝酸纖維素膜分別加入稀釋后一抗,再用相應辣根過氧化物酶(HPR)標記的二抗稀釋液孵育,用增強化學發光(ECL)法檢測不同樣品各種蛋白表達狀況。圖像以Bio-Rad圖像分析系統分析,用目的蛋白條帶的平均光強度值與β-actin條帶的平均光強度值的比值表示該蛋白表達的相對強度。
1.3 統計學方法 應用SPSS13.0統計軟件進行分析,實驗結果用±s表示,兩組間比較采用兩獨立樣本t檢驗,多組間均數比較采用單因素方差分析。
2 結果
2.1 PBIPS對MCF-7細胞增殖的影響 MTT檢測結果顯示,PBIPS可以時間和劑量依賴性地誘導MCF-7細胞發生生長抑制。12.5~200 μg/ml PBIPS對MCF-7細胞生長具有不同程度的抑制作用,在 24 h、48 h、72 h 的 IC50值分別是 128.7、86.7、60.8 μg/ml。見圖 2。
2.2 AO/EB雙染法觀察細胞凋亡形態學改變 PBIPS處理MCF-7細胞24 h、48 h、72 h后,出現典型的凋亡形態學改變。對照組正常細胞核為結構規則的綠色染色質;藥物作用24h時,部分細胞核染色質著黃色或黃綠色,呈圓珠狀或固縮狀,為早期凋亡細胞;48 h時細胞核染色質著橘紅色,呈固縮狀,為晚期凋亡細胞;72 h時大部分細胞核染色質著橘紅色,與作用48 h相比增多,并且細胞發生壞死,顯示為橙紅色的濃縮、碎裂染色質。見圖3。
2.3 PBIPS對MCF-7細胞凋亡的影響 FCM檢測結果顯示,50、100、200 μg/ml PBIPS作用 MCF-7 細胞 24 h后即出現凋亡現象,隨著PBIPS濃度的增加和作用時間的延長,細胞的凋亡率逐漸增加,與對照組比較,差異有統計學意義(P<0.01),呈現明顯的劑量/時間正向依賴關系。見圖4,5。
2.4 PBIPS對 MCF-7細胞 survivin、Caspase-3、bcl-2及 bax蛋白表達的影響 Western印跡檢測顯示經50、100、200 μg/ml PBIPS處理MCF-7細胞48 h,蛋白條帶相對強度圖表明,隨著作用濃度的增加,survivin和Bcl-2的蛋白表達均呈現下調的趨勢,而Caspase-3和bax的表達卻顯著升高,其效應均具有濃度梯度依賴性(P<0.05或P<0.01)。見圖6。
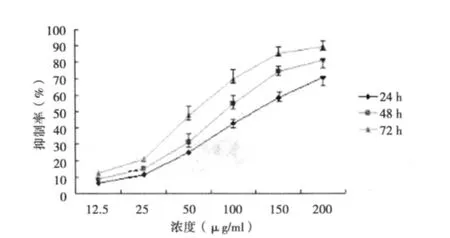
圖2 MTT檢測PBIPS對乳腺癌MCF-7細胞生長的抑制作用

圖3 AO/EB檢測各組凋亡情況(×200)

圖4 MCF-7細胞經不同濃度PBIPS處理24 h后凋亡情況
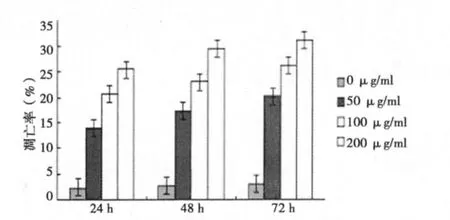
圖5 MCF-7細胞經不同濃度PBIPS處理后凋亡情況
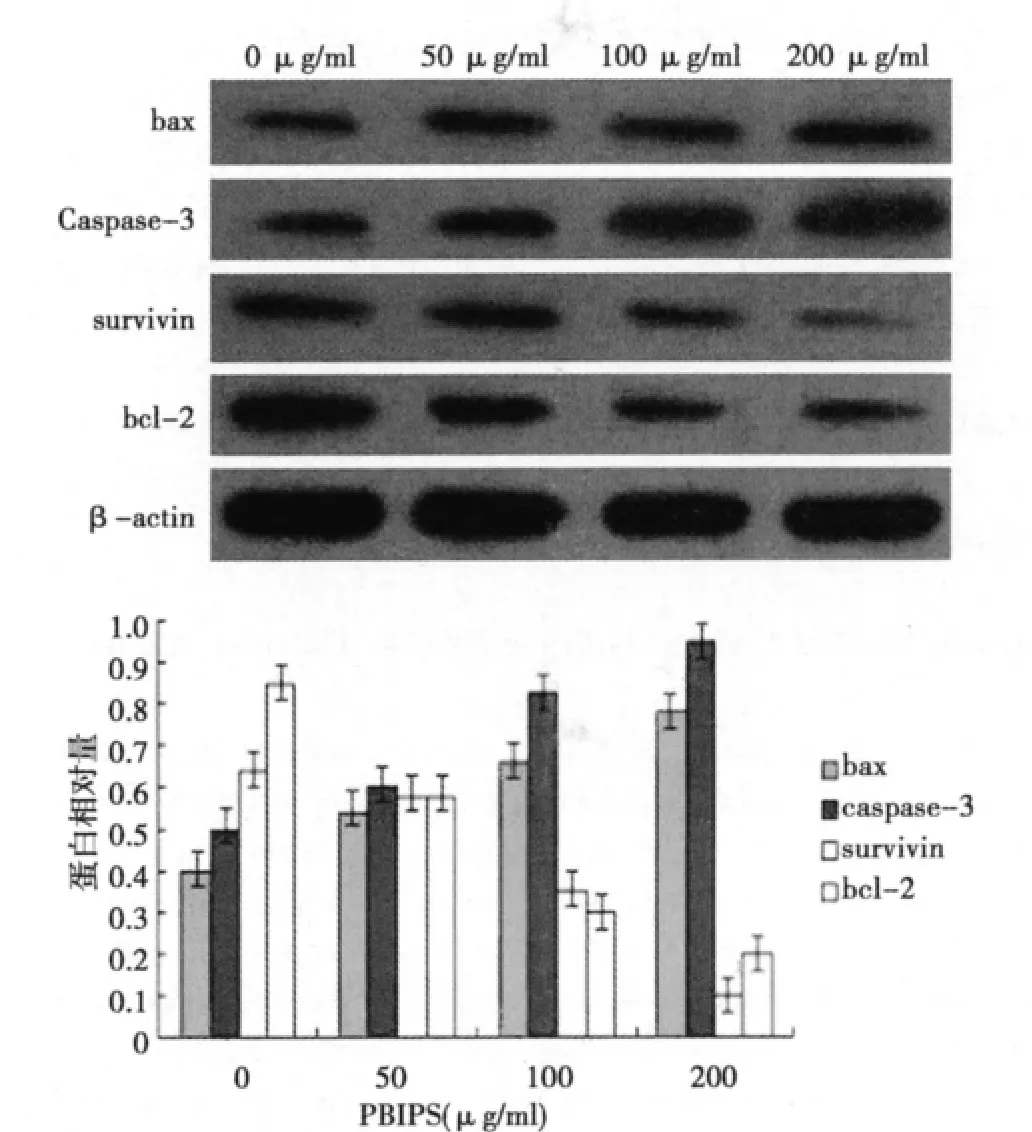
圖6 PBIPS對MCF-7細胞 survivin、caspase-3、bcl-2及bax蛋白表達的影響
3 討論
本研究結果顯示 PBIPS可以時間和劑量依賴性地抑制MCF-7細胞體外生長,其抑制作用是通過誘導MCF-7細胞凋亡實現的。細胞凋亡是一個非常復雜的細胞內信號傳導的過程,受多種因素精確地調控〔5〕。細胞凋亡過程中,對于凋亡通路起主要調節作用的有三類蛋白:(1)bcl-2蛋白家族,主要調節細胞線粒體膜的通透性,從而決定細胞色素c的釋放。本實驗所選用的bcl-2蛋白是抑制細胞凋亡的基因代表,主要是通過在線粒體外膜發揮作用,以維持膜的完整性,從而抑制細胞色素c的釋放,而bax蛋白是促進細胞凋亡的基因代表,其作用是擴張線粒體外膜的通透性,使凋亡相關蛋白如細胞色素c可以進入細胞質。細胞是否進入凋亡途徑,細胞中bcl-2與bax的比例扮演著重要角色,bax/bcl-2比值可以代表細胞凋亡能力〔6,7〕;(2)Caspase是凋亡機制的核心成分,擔任細胞凋亡的啟動和執行者的角色。Caspase是名副其實的“破壞者”,它們切斷細胞與周圍的聯系,拆散細胞骨架,阻斷細胞DNA復制和修復,干擾mRNA剪切,損傷DNA與核結構,使細胞降解為凋亡小體〔8〕;(3)尿亮氯酸氨基肽酶(IAP)蛋白,主要作用是調節Caspase活性。在凋亡信號刺激下,這三類蛋白相互作用,決定細胞是否進入凋亡程序〔9〕。
Survivin被認為是凋亡抑制蛋白(IAP)家族中作用最強的凋亡蛋白抑制因子。Survivin的過度表達抑制了細胞凋亡,有利于細胞的異常增殖和惡性轉化。Caspase-3是Caspase家族中重要的凋亡執行者之一,與DNA斷裂、染色質凝聚和凋亡小體的形成有關,抑制Caspase-3的活性或拮抗其功能可使細胞凋亡受抑。功能強大的凋亡抑制基因Survivin主要在凋亡通路的下游抑制Caspase-3發揮抗凋亡的效應〔10〕。為此,本文采用Western印跡檢測了相關凋亡蛋白Survivin和Caspase-3的表達情況,結果顯示Survivin在PBIPS誘導下出現了表達顯著下調,而致凋亡蛋白Caspase-3的表達顯著增加,從而導致MCF-7細胞凋亡。
bcl-家族成員的構成比例直接決定了線粒體外膜各種通道的開放程度,是調控細胞凋亡線粒體途徑的關鍵因素,采用Western印跡檢測了該家族中具有代表性的凋亡蛋白bcl-2和bax的表達情況,結果顯示,PBIPS作用后MCF-7細胞中抗凋亡蛋白bcl-2的表達顯著降低,促凋亡蛋白bax的表達顯著上調,表明MCF-7細胞凋亡與上述凋亡調控基因在翻譯水平上的變化有關。
1 侯 凈,王子良,楊 恭,等.EMSY在乳腺癌中的功能研究進展〔J〕.中國癌癥雜志,2012;22(4):300-7.
2 Zhao R,Xiang N,Domann FE,et al.Expression of p53 enhances seleniteinduced superoxide production and apoptosis in human prostate cancer cells〔J〕.Cancer Res,2006;66(4):2296-304.
3 高恩君,程卯生,王克華,等.鈀配合物抗癌活性研究進展〔J〕.中華醫學雜志,2006;6(2):236-9.
4 張亞宏,郭敬功,郭子華,等.白藜蘆醇通過激活 p38-p53通路誘導人乳腺癌 MCF-7細胞凋亡〔J〕.藥學學報,2011;46(11):1332-7.
5 Daniel JC,Smythe WR.The role of Bcl-2 family members in non-small cell lung cancer〔J〕.Semin Thorac Cardiovasc Surg,2004;16(1):19-27.
6 Levine B,Sinha S,Kroemer G.Bcl-2 family members:dual regulators of apoptosis and autophagy〔J〕.Autophagy,2008;4(5):600-6.
7 Danial NN.Bcl-2 family proteins:critical checkpoints of apoptotic cell death〔J〕.Clin Cancer Res,2007;13(24):7254-63.
8 Ming Sun,Yumei Zhao,Yi Gu,et al.Inhibition of nNos reduces ischemic cell death through down-regulating calpain and caspase-3 after experimental stroke〔J〕.Neurochem Int,2009;54(5-6):339-46.
9 Hunter AM,LaCasse EC,Korneluk RG,et al.The inhibitors of apoptosis(IAPs)as cancer targets〔J〕.Apoptosis,2007;12(9):1543-68.
10 Shin S,Sung BJ,Cho YS,et al.An anti-apoptotic protein human survivin is a direct inhibitor of caspase-3 and 7〔J〕.Biochemistry,2001;40(4):1117-23.

