MDR1基因+3435C/T基因型單核苷酸多態性對硼替佐咪治療的多發性骨髓瘤預后的影響
張 偉,董 理
(1.長春市中心醫院,吉林 長春130051;2.中國醫科大學附屬第四醫院)
多發性骨髓瘤 (multiple myeloma,MM)是常見漿細胞克隆性異常增生的血液系統惡性腫瘤[1]。其臨床特點是進行性的骨質破壞。臨床表現骨痛、高鈣血癥、病理性骨折、彌漫性骨質疏松等[2]。復發病例再次化療組與對照組治療無統計學意義,這可能是由耐藥性所引起的,可嚴重影響患者的生活質量和預后[3]。本文通過測序檢測多發性骨髓瘤患者MDR1基因+3435C/T的單核苷酸多態;應用Kaplan-Meier來確認 MDR1基因+3435C/T的單核苷酸多態性對患者生存期的影響及MDR1基因+3435C/T對硼替佐咪治療的多發性骨髓瘤者預后的影響。
1 對象與方法
1.1 對象 長春市中心醫院骨科及血液科2008至2011年經病理證實的多發性骨髓瘤標本89例。單純手術治療組45例,中位年齡60(40-76)歲,硼替佐咪化療治療組44例,中位年齡67(50-84)歲。
1.2 方法 從組織樣本中提取全基因組DNA,通過PCR檢測MDR1基因rs1045642序列。PCR引物: Forward:5′-CTTCGGAACGCTAAGAACAAACT-3′ 23bp; Reverse:5′-TCTGAGGTCTTCTCTCTGAAATC-3′23bp。
產物大小為:328bp[4]。PCR擴增循環參數:95℃預變性5min,接著進入循環,首先95℃變性30 s;然后按53℃復性40s;接著72℃延伸45s,循環33次后72℃延伸10min。產物通過軟件Chromas處理。經測序公司測序在+3435位點發現C/T單核苷酸基因多態性。
1.3 統計學分析
實驗數據用SPSS17.0統計學處理,組間樣本均數比較采用方差分析,以P<0.05作為有無顯著性差異的判斷標準。通過Kaplan-Meier方法以存活時間為非獨立變量,來檢驗當控制某一層因素后對其他研究因素不同水平的生存時間比較的影響分別進行分析,存活期的組間比較應用差異顯著性log-rank檢驗(生存期為患者第一次手術為起始)。
2 結果
2.1 MDR1基因序列分析
腫瘤進展機制研究提示,人群中不同個體之間的基因存在差異性或多態性,可能與多種疾病的發生發展有密切的關系。在89例骨髓瘤患者中,檢測MDR1基因rs1045642+3435位點的多態性,47例患者(52.8%)為 +3435C/T基因型,氨基酸改變為L1145M,比有些報道要高;42例患者(47.2%)為 +3435T/T型。并未檢測出+3435C/C基因型,測序見表1。

表1 C/T單核甘酸多態性測序結果
2.2 MDR1+3435C/T基因狀態對多發性骨髓瘤患者生存期的影響
89例骨髓瘤患者的平均生存期為40.4月。接受手術治療的患者(n=45)的平均生存期為38.2月,接受硼替佐咪治療的患者(n=44)的平均生存期為42.8月(P<0.05)。硼替佐咪治療的患者預后效果較好,這與文獻結果一致[5]。檢測 MDR1+3435C/T基因型患者的平均生存期為43.3月,MDR1+3435T/T基因型患者的平均生存期為37.5月(P=0.024)。MDR1+3435位點C/T基因型似乎對多發性骨髓瘤患者的生存期影響更大。(各組生存期見表2)
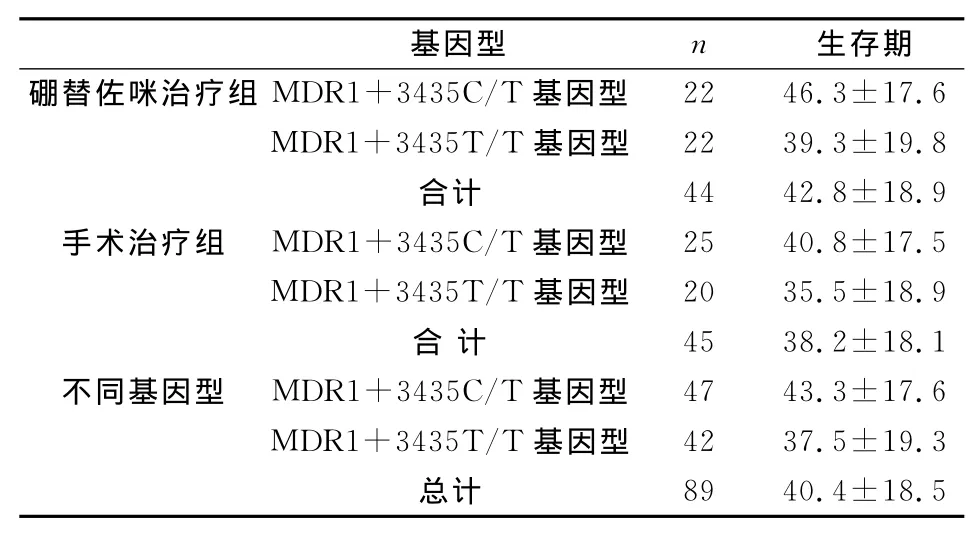
表2 89例患者經硼替佐咪治療與手術治療后的生存期(月)
2.3 MDR1+3435C/T基因狀態對經硼替佐咪治療的多發性骨髓瘤患者生存期的影響
在44例經硼替佐咪治療的患者的樣本中,有22例為MDR1+3435C/T基因型,22例是 MDR1+3435T/T基因型,其平均生存期分別為46.2月和39.3月(P=0.041)。數據顯示 MDR1+3435位點CT基因型對硼替佐咪用藥患者的生存期有顯著的影響。(各組生存期見表2)
3 討論
骨髓瘤是成人最常見的惡性腫瘤,是具侵襲性的腫瘤,診斷為多發性骨髓瘤的患者,平均生存期小于3年[6]。
骨髓瘤的發生和發展是一個多因素的結果,具體發病機制不完全清楚[7],骨髓細胞向瘤細胞的轉變也是一個復雜的過程。實驗表明有很多基因和蛋白參與了這一過程,導致細胞周期發生變化、信號傳導通路異常,從而導致細胞增殖和血管增生的異常,在骨髓瘤的發生和發展中起到一定作用[8]。
干細胞治療是骨髓瘤最有效方法,化療是重要的輔助治療手段,對放療敏感的患者,化療也是很好的聯合方法[9]。硼替佐咪雖然臨床應用后反應良好[10],同其他化療藥物一樣,多發性骨髓瘤對硼替佐咪也易產生耐藥性。目前研究認為CYP2C19基因和MDR1基因功能在對抗硼替佐咪耐藥有一定作用[11]。本研究提示 MDR1+3435位點C/T基因型似乎對多發性骨髓瘤患者的生存期影響更大。在44例接受硼替佐咪治療的患者樣本中,MDR1+3435位點C/T基因型患者(n=22)與 MDR1+3435位點T/T基因型患者(n=22)兩組樣本量相對平衡,發現兩組生存期統計學有顯著差異(P=0.041)。在89例骨髓瘤患者的研究中,MDR1+3435位點C/T基因型患者占52.8%,高于之前的研究[12],不能排除這種高頻性的表型由樣本數量較少或種族差異所引起的。
在少量樣本中,MDR1+3435C/T基因型的作用效果可能不能充分顯示,然而相對平衡的數據卻有利于對患者生存期的分析。在小樣本研究中,MDR1+3435位點C/T基因型的影響并沒有完全體現在患者的存活上。
[1]Sanford S,Deborshi R,Schindler M.Cell biological mechanisms of multidrug resistance in tumors[J].Proc Natl Acad Sci,1994,91:349.
[2]Fletcher JI,Haber M,Henderson MJ,et al.ABC transporters in can-cer:more than just drug efflux pumps[J].Nat Rev Cancer,2010,10(2):147.
[3]Coley HM.Overcoming multidrug resistance in cancer:clinical studies of p-glycoprotein inhibitors[J].Methods Mol Biol,2010,596:341.
[4]Ma P,Dong X,Swadley CL,et al.Development of idarubicin and doxorubicin solid lipid nanoparticles to overcome Pgp-mediated multiple drug resistance in leukemia[J].J Biomed Nanotechnol,2009,5(2):151.
[5]Borst P,Evers R,Kool M,Wijnholds J.The multidrug resistance protein family[J].Biochim Biophys Acta,1999,1461(2):347.
[6]Johnstone RW,Ruefli AA,Smyth MJ.Multiple physiological functions formultidrug transporter P-glycoprotein[J]?Trends Biochem Sci,2000,25(1):1.
[7]Pavek P,Fendrich Z,Staud F.Physiologic function of P-glycoprotein[J].Cesk Fysiol,2002,51(3):99.
[8]Zhu BT.A novel hypothesis for the mechanism of action of P-glycoprotein as amultidrug transporter[J].Mol Carcinog,1999,25(1):1.
[9]Chaudhary PM,Mechetner EB,Roninson IB.Expression and activity of themulti drug resistance P-glycoprotein in human peripheral blood lymphocytes[J].Blood,1992,80:2735.
[10]Grogan TM,Spier CM,Salmon SE,Matzner M,Rybski J,et al.P-glycoprotein expression in human plasma cell myeloma:correlation with prior chemo therapy[J].Blood,1993,81:490.
[11]Wuchter C,Leonid K,Ruppert V,et al.Clinical significance of P-glycoprotein expression and function for response to induction chemotherapy,relapse rate and overall survival in acute leukemia[J].Haemato logica,2000,85(7):711.
[12]Yamaguchi M,Mizutani M,Miwa H,et al.P-glycoprotein expression in hematological malignancies[J].Rinsho Ketsueki,1995,36(6):567.

