一種改良的尿毒癥腹膜透析大鼠模型*
聶振禹, 陳爭(zhēng)躍, 包蓓艷
(寧波市泌尿腎病醫(yī)院腎內(nèi)科, 浙江 寧波 315192)
·實(shí)驗(yàn)技術(shù)·
一種改良的尿毒癥腹膜透析大鼠模型*
聶振禹, 陳爭(zhēng)躍, 包蓓艷△
(寧波市泌尿腎病醫(yī)院腎內(nèi)科, 浙江 寧波 315192)
目的研制一種改良的尿毒癥大鼠腹膜透析模型。方法采用二次手術(shù)法切除大鼠5/6腎臟建立尿毒癥模型,造模后4周取尾靜脈血測(cè)肌酐值,以達(dá)到正常血肌酐值2~3倍者為尿毒癥大鼠模型;使用改良的硅膠腹透管置管制作腹膜透析大鼠模型,手術(shù)切口于背部,隧道出口于頸后兩耳中點(diǎn)下方2~3 cm處。24只SD大鼠隨機(jī)分為4組:A組(n=6),假手術(shù)組;B組(n=6),尿毒癥組,不插管也不透析;C組(n=6),尿毒癥插管組,插管但不透析;D組(n=6),尿毒癥高糖透析組,4.25%葡萄糖透析液透析2周。D組大鼠停止透析24 h后各組行腹膜功能檢查,測(cè)超濾量;透出液行白細(xì)胞計(jì)數(shù);腹膜組織行HE染色,測(cè)量腹膜間皮至肌層厚度。結(jié)果B、C、D組血肌酐值為A組的2~3倍,尿毒癥大鼠模型制作成功;D組超濾量較A、B、C組顯著減少(P<0.05);B、C、D組透出液白細(xì)胞計(jì)數(shù)略高于A組(P<0.05),但都未發(fā)現(xiàn)感染;HE染色顯示D組腹膜間皮至肌層厚度較A、B和C組顯著增加(P<0.05),高糖透析液刺激腹膜組織呈現(xiàn)明顯的慢性損傷病理特征。結(jié)論我們通過(guò)改良的導(dǎo)管插入法建立了一個(gè)理想的尿毒癥大鼠腹膜透析模型,該模型為研究腹膜透析功能保護(hù)奠定了實(shí)驗(yàn)基礎(chǔ)。
腹膜透析; 尿毒癥; 模型,動(dòng)物; 大鼠
腹膜透析(peritoneal dialysis,PD)是腎臟替代療法之一,雖然腹膜透析技術(shù)目前已取得了較快發(fā)展,但長(zhǎng)期腹透仍面臨著諸多挑戰(zhàn)。動(dòng)物模型在研究腹膜透析的生理、病理和臨床方面發(fā)揮著重要作用,理想的動(dòng)物模型可以充分模擬人類PD過(guò)程,提供腹膜結(jié)構(gòu)和功能信息,揭示腹透過(guò)程中腹膜轉(zhuǎn)運(yùn)、結(jié)構(gòu)變化和局部防御機(jī)制[1]。然而,對(duì)于研究腹膜透析的理想實(shí)驗(yàn)?zāi)P停绕涫情L(zhǎng)期腹膜透析,目前仍然沒(méi)有達(dá)成共識(shí)[2]。最近的研究表明,有多個(gè)因素影響腹膜功能結(jié)構(gòu),包括尿毒癥內(nèi)環(huán)境的改變,腹透液生物相容性等。此外,還存在一些如導(dǎo)管阻塞性及腹膜炎等重要的技術(shù)問(wèn)題,這些都可以導(dǎo)致腹膜結(jié)構(gòu)和功能改變[3]。為此,我們對(duì)現(xiàn)有的模型進(jìn)行了改良,以便能更好地用于腹膜透析研究。
材 料 和 方 法
1動(dòng)物
健康清潔級(jí)雄性Sprague-Dawley(SD)大鼠,體重280~300 g,由寧波大學(xué)實(shí)驗(yàn)動(dòng)物中心提供。
2自制腹膜透析管
導(dǎo)管由硅膠引流管(10F,蘇州鑫達(dá)醫(yī)療器材有限公司)制作,其內(nèi)緊密連接一次性靜脈輸液針接頭(上海康德萊集團(tuán)),肝素帽(蘇州碧迪醫(yī)療器械有限公司)匹配。插入腹腔內(nèi)部分有10個(gè)小孔(直徑1 mm),導(dǎo)管肝素帽端cuff由義齒基托樹(shù)脂(Ⅱ型) (上海醫(yī)療器械股份有限公司)制作(圓形,直徑1 cm)。導(dǎo)管的長(zhǎng)度可根據(jù)大鼠身長(zhǎng)調(diào)節(jié),見(jiàn)圖1。

Figure 1. The peritoneal dialysis catheter.
圖1腹膜透析管示意圖
3動(dòng)物模型和動(dòng)物分組
3.1尿毒癥大鼠模型的制作 本實(shí)驗(yàn)采用大鼠5/6腎臟切除法制作尿毒癥模型。大鼠適應(yīng)性喂養(yǎng)1周后抽取尾血測(cè)正常血肌酐值后即行左腎2/3切除術(shù)。10%水合氯醛腹腔注射麻醉大鼠,備皮、消毒,在背部觸摸左側(cè)腎臟位置,做長(zhǎng)約1.5 cm平行脊柱切口,逐層切開(kāi)皮膚、筋膜及肌層,暴露左腎。分離腎周脂肪組織,用帶針絲線結(jié)扎腎臟上1/3后切除,棉球壓迫止血。同法切除腎臟下1/3,無(wú)出血后復(fù)原剩余左腎,縫合肌層與皮膚,術(shù)后腹腔注射4×105U青霉素。1周后行右腎切除術(shù)。手術(shù)準(zhǔn)備同前,暴露右腎并分離出腎蒂后,直接結(jié)扎腎蒂,切除右腎,檢查結(jié)扎處無(wú)出血后縫合肌層與皮膚,術(shù)后腹腔注射4×105U青霉素。大鼠造模后4周取尾血測(cè)肌酐值,以達(dá)到正常血肌酐值2~3倍者為尿毒癥大鼠。
3.2尿毒癥大鼠腹透插管模型的制作 尿毒癥大鼠麻醉后取俯臥位固定,背部備皮、消毒,在原右側(cè)切口下方做長(zhǎng)約1 cm平行脊柱切口,切開(kāi)肌肉層至后腹腔,于后腹膜開(kāi)1個(gè)0.6 cm切口,作一荷包帶線。自切口處做皮下隧道,隧道出口選擇在大鼠兩耳連線中點(diǎn)下約2~3 cm處,將腹透管有孔一端從隧道出口穿入,在隧道針引導(dǎo)下至后腹腔,荷包扎緊開(kāi)口和腹透管,縫合肌層并固定腹透管。腹透管肝素帽端cuff固定至隧道出口皮下,縫合出口。術(shù)中抽取適量生理鹽水進(jìn)行腹腔灌洗,以確定荷包無(wú)滲漏,術(shù)后給予4×105U青霉素。插管成功1周后開(kāi)始透析,見(jiàn)圖2、3。

Figure 2. Surgical procedure: nephrectomy incisions (1, 2), catheter incision (3), tunnel exit (4) and subcutaneous tunnel (5).
圖2大鼠手術(shù)示意圖

Figure 3. Uremic rat model of peritoneal dialysis.
圖3尿毒癥腹膜透析大鼠模型
3.3動(dòng)物分組 雄性SD大鼠24只隨機(jī)分成4組:A組(n=6):假手術(shù)組,行雙側(cè)腎包膜剝除術(shù);B組(n=6):尿毒癥組,大鼠手術(shù)見(jiàn)方法3.2,不插管也不透析;C組(n=6):尿毒癥插管組,插管但不透析;D組(n=6):尿毒癥高糖透析組,插管透析,每天注入4.25%透析液(Baxter)20 mL,共2周。
4檢測(cè)方法
4.1腹膜功能檢查 D組大鼠停止透析24 h后各組動(dòng)物行腹膜功能測(cè)定:每只大鼠用0.5 mg/kg氯胺酮大腿肌肉注射麻醉后,腹腔注射4.25%透析液20 mL,90 min后處死大鼠留取血液標(biāo)本,同時(shí)沿腹白線剪開(kāi)腹壁,準(zhǔn)確量取腹腔透析液超濾量(ultrafiltration,UF)。
4.2細(xì)胞學(xué)檢查 透出液行白細(xì)胞計(jì)數(shù)。以透出液白細(xì)胞計(jì)數(shù)大于1 000/mm3診斷為腹腔感染[4]。腹腔感染者數(shù)據(jù)不納入實(shí)驗(yàn)結(jié)果分析。
4.3組織學(xué)檢查 收集完透析液后,觀察腹腔內(nèi)導(dǎo)管位置及包裹情況,取導(dǎo)管內(nèi)出口周圍腹膜組織(臟層腹膜)行HE染色,光鏡觀察。每張切片觀察5個(gè)視野,測(cè)量腹膜下厚度(即腹膜間皮至肌肉的垂直距離,含間皮下纖維組織),平均值作為判定厚度的標(biāo)準(zhǔn)。
5統(tǒng)計(jì)學(xué)處理
數(shù)據(jù)以均數(shù)±標(biāo)準(zhǔn)差(Mean±SD)表示,組間比較采用單因素方差分析,組間兩兩比較采用q檢驗(yàn),由SPSS 13.0統(tǒng)計(jì)軟件包完成,以P<0.05為差異有統(tǒng)計(jì)學(xué)意義。
結(jié) 果
1模型一般情況
1.1尿毒癥大鼠模型的制作結(jié)果 第1次手術(shù)切除左腎2/3,無(wú)大鼠死亡。第2次手術(shù)切除右腎,術(shù)后1周內(nèi)B、D組各死亡1只。存活大鼠傷口均愈合良好,B、C、D組體重增長(zhǎng)較A組遲緩,尿量明顯增加。B、C、D組血肌酐值為A組的2~3倍,尿毒癥大鼠模型制作成功,見(jiàn)表1。
1.2尿毒癥大鼠腹透模型的制作結(jié)果 C、D組插管后切口愈合均良好,C、D組各有1只大鼠抓壞肝素帽,重新調(diào)整管帽位置后未再出現(xiàn)抓管情況。C組1只大鼠導(dǎo)管被大網(wǎng)膜部分包裹,D組1只大鼠導(dǎo)管被大網(wǎng)膜全部包裹,但所有大鼠導(dǎo)管引流通暢,均未出現(xiàn)堵管情況。
2腹膜功能檢查
與A組比較,B、C組UF輕微減少,D組UF明顯減少(P<0.05),見(jiàn)表1。
3細(xì)胞學(xué)檢查
與A組比較,B、C、D組透出液白細(xì)胞數(shù)增加(P<0.05),且D組較B、C組透出液白細(xì)胞數(shù)增加(P<0.05),所有大鼠均未出現(xiàn)腹膜炎,見(jiàn)表1。
4組織學(xué)檢查
與A組比較,B、C組間皮細(xì)胞層數(shù)增多,腹膜輕微增厚(P<0.05);D組腹膜間皮細(xì)胞增生,間皮下纖維組織增生明顯,腹膜微血管增多,間質(zhì)有炎癥細(xì)胞浸潤(rùn),腹膜增厚顯著(P<0.05) ,見(jiàn)圖4、表1。

Figure 4. Histological changes of parietal peritoneum in each group (HE staining,×100).
圖4各組腹膜形態(tài)的HE染色
表1各組大鼠的血肌酐、超濾量、透出液白細(xì)胞數(shù)和腹膜下厚度
Table 1. Levels of serum creatinine (SCr), ultrafiltration (UF), dialysate white blood cell (WBC) count and the distance from an intact mesothelium to the muscle (d) in each group(Mean±SD.n=21)
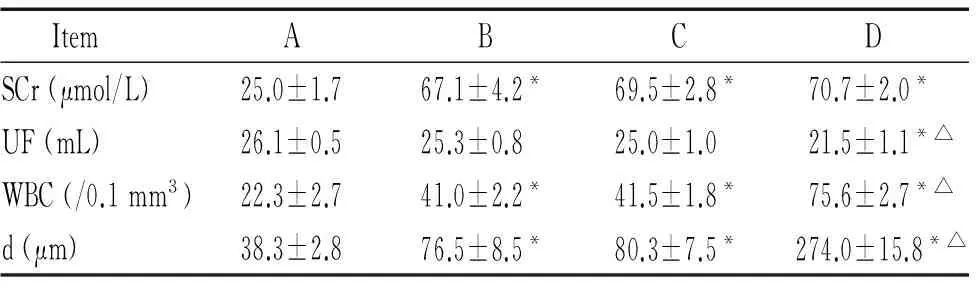
ItemABCDSCr(μmol/L)25.0±1.767.1±4.2*69.5±2.8*70.7±2.0*UF(mL)26.1±0.525.3±0.825.0±1.021.5±1.1*△WBC(/0.1mm3)22.3±2.741.0±2.2*41.5±1.8*75.6±2.7*△d(μm)38.3±2.876.5±8.5*80.3±7.5*274.0±15.8*△
*P<0.05vsgroup A;△P<0.05vsgroup B.
討 論
隨著腹膜透析技術(shù)的不斷完善和開(kāi)展,采用腹膜透析技術(shù)治療的患者日益增多。然而,在腹膜透析過(guò)程中,腹膜功能和結(jié)構(gòu)改變與尿毒癥狀態(tài)及長(zhǎng)期接觸腹膜透析液密切相關(guān)。目前,腹膜硬化、營(yíng)養(yǎng)不良、微炎癥狀態(tài)等因素制約著腹膜透析的發(fā)展[5]。
動(dòng)物模型在研究腹膜功能保護(hù)方面具有重要作用。建立一種簡(jiǎn)便、成功率高的腹膜透析模型,顯得尤為重要。由于大鼠相對(duì)廉價(jià)易得、生命力強(qiáng),為多數(shù)研究者采用,但是大鼠愛(ài)磨牙,抓咬管帽,甚至能拖出并咬壞腹透管道,引起感染。因此,隧道出口、透析管帽和手術(shù)方式,成為決定模型能否成功建立的重要因素。
我們使用的硅膠腹透管制作簡(jiǎn)單,cuff組織相容性好,置于皮下,保護(hù)管道不易拖出;管道柔軟,便于手術(shù);肝素帽可以反復(fù)穿刺換液;隧道出口選擇在后背頸部,管帽不易被老鼠咬壞,進(jìn)行腹透時(shí)也便于操作。由于腹透管從前腹腔插入會(huì)引起腹膜明顯的炎癥反應(yīng)[6],所以我們選擇從后腹腔插管,以減輕對(duì)腹膜的刺激。結(jié)果表明,背部置管的手術(shù)方式操作簡(jiǎn)便,對(duì)腹膜刺激小,大鼠恢復(fù)快。置入帶cuff的腹透管及隧道出口于后背頸部,大鼠耐受性好,保證實(shí)驗(yàn)的順利進(jìn)行。
同時(shí),我們的實(shí)驗(yàn)發(fā)現(xiàn),每日腹腔注射20 mL 4.25%高糖透析液的大鼠(D組),透析2周,腹膜間皮細(xì)胞出現(xiàn)明顯增生和形態(tài)學(xué)改變,腹膜微血管增多,間皮下纖維組織增生顯著。這些結(jié)果表明,我們制作的模型具有明顯的腹膜組織慢性損傷的病理特征,能很好地模擬尿毒癥早期臨床病理生理過(guò)程,是一個(gè)較好的動(dòng)物模型,能為深入尿毒癥腹膜透析治療提供研究基礎(chǔ)。
[1] McIntyre CW. Update on peritoneal dialysis solutions[J]. Kidney Int, 2007, 71(6):486-490.
[2] Topley N. Animal models in peritoneal dialysis: more questions than answers? [J].Perit Dial Int, 2005, 25(1):33-34.
[3] 牛紅心, 周偉東, 龍海波, 等. 預(yù)防性大網(wǎng)膜部分切除對(duì)腹膜透析導(dǎo)管功能障礙發(fā)生的影響[J]. 中國(guó)病理生理雜志, 2010, 26(6):1177-1180.
[4] Peng YM, Shu ZJ, Xiao L, et al. A new non-uremic rat model of long-term peritoneal dialysis[J]. Physiol Res, 2011, 60(1):157-164.
[5] De Vriese AS, Tilton RG, Mortier S, et al. Myofibroblast transdifferentiation of mesothelial cells is mediated by RAGE and contributes to peritoneal fibrosis in uraemia[J]. Nephrol Dial Transplant, 2006, 21(9):2549-2555.
[6] Flessner MF, Credit K, Henderson K, et al. Peritoneal changes after exposure to sterile solutions by catheter[J]. J Am Soc Nephrol, 2007, 18(8):2294-2302.
Animproveduremicratmodelofperitonealdialysis
NIE Zhen-yu, CHEN Zheng-yue, BAO Bei-yan
(DivisionofNephrology,NingboUrologyandNephrologyHospital,Ningbo315192,China.E-mail:baobeiyan2007@sina.com)
AIM: To develop a modified uremic rat model of peritoneal dialysis.METHODSA 5/6 subtotal nephrectomy was performed during 2 operative procedures to establish a uremic rat model. A modified silicon catheter was inserted into the peritoneal cavity with an incision in the back of the rats. The tunnel exit was made in the skin of the posterior neck, 2~3 cm below the middle of the 2 ears. Twenty-four Sprague-Dawley rats were divided into 4 groups. Group A (n=6) was subjected to sham operation. Group B (n=6) was subjected to nephrectomy without silicon catheter insertion or peritoneal dia-lysis. Group C (n=6) was subjected to nephrectomy with silicon catheter insertion, but no peritoneal dia-lysis. Group D (n=6) was subjected to nephrectomy with silicon catheter insertion and
daily peritoneal injections through the catheter using 4.25% glucose-based dialysis solution for 2 weeks. Twenty-four hours after dialysis in group D, the rats in all groups received peritoneal equilibration test. The ultrafiltration volume, the white blood cell (WBC) counts in peritoneal effluent and the thickness of the mesothelium-to-muscle layer of peritoneum were also measured.RESULTSSerum levels of creatinine in group B, group C and group D were 2~3 times higher than that in group A (P<0.05), suggesting the successful establishment of uremic rat model. The ultrafiltration volume in group D decreased significantly as compared with group A, group B and group C (P<0.05). The WBC counts in peritoneal effluent in group B, group C and group D were slightly higher than that in group A (P<0.05). However, no episode of infection in any group was observed. Hematoxylin-eosin staining demonstrated a dramatic increase in the thickness of the mesothelium-to-muscle layer of peritoneum exposed to high glucose (group D) as compared with group A, group B and group C (P<0.05). Peritoneal tissue showed significant pathological features of chronic injury induced by high glucose dialysis fluid.CONCLUSIONWe established an ideal uremic rat model of peritoneal dialysis by a modified catheter insertion method.
Peritoneal dialysis; Uremia; Models, animal; Rats
R363
A
10.3969/j.issn.1000- 4718.2013.11.036
1000- 4718(2013)11- 2109- 04
2013- 07- 06
2013- 09- 27
寧波市醫(yī)學(xué)科技計(jì)劃(No.2010A18)
△通訊作者 Tel: 0574-83039291; E-mail: baobeiyan2007@sina.com
- 中國(guó)病理生理雜志的其它文章
- 上調(diào)miR-187* 表達(dá)對(duì)人結(jié)腸癌細(xì)胞株增殖活性的影響*
- 磷酸化MEK2(Thr394)在結(jié)直腸癌中的表達(dá)及其臨床意義*
- S100A6通過(guò)PI3K/Akt信號(hào)通路促進(jìn)人骨肉瘤細(xì)胞143B增殖和遷移*
- 骨髓基質(zhì)細(xì)胞介導(dǎo)的微環(huán)境對(duì)人肝癌細(xì)胞株SMMC-7721的作用以及機(jī)制研究*
- 高齡老年人體位性低血壓與心左室結(jié)構(gòu)和功能的相關(guān)性研究
- 心力衰竭家兔心室動(dòng)作電位時(shí)程整復(fù)性變化對(duì)室性心律失常的影響

