去甲氧基姜黃素對人膀胱癌T24細胞增殖及凋亡的影響研究
倪曉辰,陳硯凝,武新慧,張愛莉,趙志紅
膀胱癌是我國泌尿系統最常見的惡性腫瘤,近年來膀胱癌的發病率呈顯著增加趨勢。膀胱癌的治療目前仍以手術治療為主,但是由于膀胱癌術后極易復發,且復發后腫瘤具有向更高級別惡性程度發展的趨勢,嚴重影響了患者的預后,為膀胱癌的臨床治療帶來極大挑戰,所以研究預防其復發的理想藥物具有重大的臨床意義。去甲氧基姜黃素(demethoxycurcumin,DMC)對人膀胱癌的作用尚不清楚。本研究觀察了DMC對膀胱癌T24細胞增殖及凋亡的影響,并初步探討了其誘導T24細胞凋亡的分子機制,為進一步研究DMC治療膀胱癌提供了理論依據。
1 材料與方法
1.1 細胞培養與藥物準備 人膀胱癌T24細胞株用含10%胎牛血清(FBS)的RPMI-1640培養基培養,待細胞生長達90%融合后,用消化液〔含0.25%胰蛋白酶、0.02%乙二胺四乙酸(EDTA)、磷酸鹽緩沖液(PBS)〕消化傳代,至細胞生長達80%融合時進行實驗。將DMC粉末充分溶解于二甲基亞砜(DMSO)中,制備成濃度為160 μM的儲液,等分裝10份后置于-20 ℃避光保存備用。將細胞分為實驗組和對照組,實驗組細胞加入不同濃度的DMC進行孵育,對照組加入等體積DMSO進行孵育。
1.2 3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴鹽(MTT)實驗 將T24細胞用消化液消化,并吹打成單細胞懸液,并將約100 μl的細胞懸液(約1×104個細胞)接種于96孔板各孔中,貼壁后實驗組分別加入不同濃度的DMC(10、20、40、80、160 μM)刺激48 h。對照組使用0.1%(體積比)的DMSO孵育相同時間。倒置顯微鏡觀察后每孔加入20 μl MTT(5 mg/ml)溶液,并于37 ℃下孵育3 h,然后棄去培養液,每孔各加入DMSO 150 μl,混勻后于570 nm處比色測定。以上各組設6個復孔,重復3次。
1.3 流式細胞學分析 將各組細胞用消化液徹底消化并吹打成單細胞懸液,1 000 r/min離心5 min,離心半徑為16 cm。用PBS漂洗數次后,將細胞重懸在500 μl結合緩沖液中,之后各組加入5 μl的Annexin V 和 10 μl的碘化丙啶(PI)。染色后用流式細胞儀(FCM)檢測各組細胞的凋亡率。細胞凋亡采用Annexin V/ PI雙染凋亡檢測試劑盒進行檢測。
1.4 Western印跡分析 采用Western印跡法檢測增殖細胞核抗原(proliferating cell nuclear antigen,PCNA)(Santa cruz)、細胞周期抑制蛋白p27(cell signaling)、Caspase 3(cell signaling)及其底物多聚ADP-核糖聚合酶(poly ADP-ribose polymerase,PARP)(cell signaling)、p-mTOR(Ser2448)/mTOR(cell signaling)等蛋白的變化。采用凝膠成像分析軟件Quantity One對待測條帶的灰度與內參照(β-actin)條帶灰度的比值進行相對定量分析。
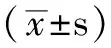
2 結果
2.1 DMC抑制T24細胞增殖 MTT顯示,實驗組用不同濃度的DMC孵育48 h后,細胞增殖活力均低于對照組,差異有統計學意義(P<0.05,見圖1)。Western印跡法顯示,用不同濃度的DMC(20、40、80 μM)處理T24細胞48 h,PCNA相對表達量均低于對照組,p27相對表達量均高于對照組,差異有統計學意義(P<0.05,見表1);且隨DMC濃度的增加PCNA相對表達量逐漸減低,p27相對表達量逐漸增高。

注:與對照組比較,*P<0.05,△P<0.01
圖1 不同濃度DMC對T24 細胞增殖活力的影響
Figure1 Effects of different concentrations of DMC on the proliferation of T24 cells
2.2 DMC誘導T24細胞凋亡 流式細胞學檢測發現,不同濃度DMC(20、40、80 μM)處理T24細胞48 h后,細胞發生明顯的凋亡,細胞凋亡率均高于對照組,差異有統計學意義(P<0.05,見圖2)。Western印跡法顯示,不同濃度DMC(20、40、80 μM)處理T24細胞48 h后,pro-caspase 3、cleaved-caspase 3、pro-PARP、cleaved-PARP的相對表達量與對照組比較,差異均有統計學意義(P<0.05,見表2)。
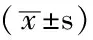
Table1 Comparison of relative expression of PCNA and p27 in control group and different concentrations DMC groups

組別PCNAp27對照組1 00±0 101 00±0 0820μM組0 81±0 02?1 96±0 14?40μM組0 57±0 03?△3 48±0 16?△80μM組0 42±0 03?△▲5 31±0 09?△▲F值69 80697 40P值<0 05<0 05
注:PCNA=增殖細胞核抗原;與對照組比較,*P<0.05;與20 μM組比較,△P<0.05;與40 μM組比較,▲P<0.05

注:與對照組比較,*P<0.01
圖2 不同濃度DMC對T24細胞凋亡率的影響
Figure2 Effects of different concentrations of DMC on apoptosis in T24 cells
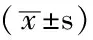
Table2 Comparison of relative expression of pro-caspase 3,cleaved-caspase 3,pro-PARP and cleaved-PARP in control group and different concentrations DMC groups

組別pro-caspase3cleaved-caspase3pro-PARPcleaved-PARP對照組1 00±0 041 00±0 131 00±0 051 00±0 0520μM組1 01±0 063 35±0 22?0 97±0 051 02±0 0140μM組0 82±0 03?4 47±0 15?0 90±0 214 55±0 29?80μM組0 25±0 05?6 37±0 15?0 73±0 04?5 10±0 21?F值198 5546 826 9442 4P值<0 05<0 05<0 05<0 05
注:與對照組比較,*P<0.05
2.3 DMC抑制mTOR的活化 用濃度為40 μM的DMC分別刺激T24細胞0、15、30、60和120 min,采用Western印跡法檢測與細胞增殖密切相關的mTOR通路磷酸化的變化顯示,不同時間點p-mTOR的相對表達量比較,差異有統計學意義(P<0.05);且刺激30、60、120 min時的p-mTOR的相對表達量均低于0 min時,差異有統計學意義(P<0.05)。不同時間點mTOR的相對表達量比較,差異無統計學意義(P>0.05,見表3)。
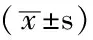
Table3 Comparison of relative expression of p-mTOR ang mTOR in different times

時間(min)p-mTORmTOR01 00±0 01 1 00±0 05151 00±0 02 1 00±0 05300 79±0 03?0 99±0 04600 77±0 04?1 00±0 031200 37±0 03?0 97±0 04F值305 600 27P值<0 05>0 05
注:與0 min比較,*P<0.05
3 討論
多年來,膀胱癌一直是我國泌尿系統最常見的惡性腫瘤,發病率呈逐年上升趨勢,且復發率高[1]。膀胱癌術后常用膀胱灌注化學藥物預防復發,但效果不甚理想且局部反應較大。研究證實,姜黃素對于膀胱癌、前列腺癌、結腸癌及乳腺癌等多種腫瘤均具有抑制性[2-3],能夠顯著減少腫瘤細胞數,縮小腫瘤細胞體積。但姜黃素對膀胱癌的作用尚不清楚。
DMC作為姜黃素的結構類似物,也同樣具有抗腫瘤效應[4],可強烈抑制前列腺癌細胞的增殖[5]。其穩定性較傳統姜黃素更強,能夠顯著延長藥物的作用時間和體內t1/2。本研究發現,實驗組用不同濃度的DMC孵育48 h后,細胞增殖活力均低于對照組,提示DMC能夠顯著抑制T24細胞的增殖活力,且具有劑量及時間依賴性。PCNA參與DNA的合成過程,是常用的細胞增殖標志物,該蛋白的表達量與細胞的增殖狀態密切相關[6]。p27是細胞周期抑制物,在增殖活躍的細胞中,該蛋白表達量下調,并成為腫瘤治療的潛在靶點[7]。本研究發現,用不同濃度的DMC(20、40、80 μM)處理T24細胞48 h,PCNA相對表達量均低于對照組,p27相對表達量均高于對照組;且隨DMC濃度的增加PCNA相對表達量逐漸減低,p27相對表達量逐漸增高,提示DMC能夠下調PCNA的表達量,上調p27表達量。因此,推測DMC抑制T24細胞增殖的機制可能與該化合物下調PCNA及上調p27的表達量有關。
誘導惡性腫瘤細胞凋亡是抗腫瘤藥物作用的重要機制之一。姜黃素可以通過Caspase非依賴性方式誘導PC-3細胞發生凋亡[8]。本研究發現,在DMC處理的T24細胞中,細胞凋亡率高于對照組,且隨給藥濃度的增加及時間的延長而增加。Caspase 3是Caspase凋亡途徑中的主要執行者,前體Caspase 3被剪切后形成有功能的剪切體[9]。PARP是Caspase 3的底物,其與DNA修復等有關,當Caspase 3激活后,PARP即被剪切,從而發揮功能[9]。本研究發現,不同濃度DMC(20、40、80 μM)處理T24細胞48 h后,pro-caspase 3、cleaved-caspase 3、pro-PARP、cleaved-PARP的相對表達量與對照組比較有明顯差異,由于有活性的Caspase 3剪切體表達量增加,該酶的底物PARP剪切體表達量也顯著增加,因此DMC誘導的T24細胞凋亡可能與該化合物誘導激活Caspase 3依賴的凋亡通路有關。mTOR通路在腫瘤增殖與生長、維持代謝與穩態、參與凋亡與自噬等多種生物學過程中起到重要作用[10]。本研究還發現,用濃度為40 μM的DMC分別刺激T24細胞0、15、30、60、120 min,采用Western印跡法檢測與細胞增殖密切相關的mTOR通路磷酸化的變化顯示,不同時間點p-mTOR的相對表達量有明顯差異,且刺激30、60、120 min時的p-mTOR的相對表達量均低于0 min時;不同時間點mTOR的相對表達量無明顯差異。說明在給予DMC(40 μM)刺激30 min后,可顯著抑制mTOR的磷酸化水平,因此DMC可能通過抑制mTOR的磷酸化而發揮對膀胱癌的抑制作用,提示DMC抑制T24細胞增殖的分子機制可能與抑制mTOR通路活化有關。
綜上所述,本研究發現DMC可通過多個靶點對膀胱癌細胞發揮顯著的抗腫瘤活性,對于臨床上膀胱癌的治療有較廣闊的應用價值,為今后開發新一代抗腫瘤藥物提供了新的思路。然而DMC在動物體內是否也同樣有類似的抗腫瘤效果仍需進一步研究證實。
1 吳階平.吳階平泌尿外科學 [M].山東:山東科學技術出版社,2004:965-966.
2 Teiten MH,Gaascht F,Cronauer M,et al.Anti-proliferative potential of curcumin in androgen-dependent prostate cancer cells occurs through modulation of the wingless signaling pathway[J].Int J Oncol,2011,38(3):603-611.
3 Lee YK,Park SY,Kim YM,et al.Regulatory effect of the AMPK-COX-2 signaling pathway in curcumin-induced apoptosis in HT-29 colon cancer cells[J].Ann N Y Acad Sci,2009,1171:489-494.
4 Yodkeeree S,Ampasavate C,Sung B,et al.Demethoxycurcumin suppresses migration and invasion of MDA-MB-231 human breast cancer cell line[J].Eur J Pharmacol,2010,627(1/3):8-15.
5 Ni X,Zhang A,Zhao Z,et al.Demethoxycurcumin inhibits cell proliferation,migration and invasion in prostate cancer cells[J].Oncol Rep,2012,28(1):85-90.
6 López de Saro FJ.Regulation of interactions with sliding clamps during DNA replication and repair[J].Curr Genomics,2009,10(3):206-215.
7 He W,Wang X,Chen L,et al.A crosstalk imbalance betwee p27(Kip1) and its interacting molecules enhances breast carcinogenesis[J].Cancer Biother Radiopharm,2012,27(7):399-402.
8 Hilchie AL,Furlong SJ,Sutton K,et al.Curcumin-induced apoptosis in PC3 prostate carcinoma cells is caspase-independent and involves cellular ceramide accumulation and damage to mitochondria[J].Nutr Cancer,2010,62(3):379-389.
9 Cohen GM.Caspases:the executioners of apoptosis[J].Biochem J,1997,326(Pt 1):1-16.
10 Polivka J Jr,Janku F.Molecular targets for cancer therapy in the PI3K/AKT/mTOR pathway [J].Pharmacol Ther,2014,142(2):164-175.

