靶向干擾前列腺源性ETS 因子促進HT29 細胞的增殖與侵襲
張毅強 師帥帥 郭改娥 裴晉紅 汪軍梅 蘇 嬌 (長治醫學院生物化學教研室,長治 046000)
前列腺源性轉錄因子(Prostate-derived Ets factor,PDEF)是Libermann[1]在前列腺特異性抗原基因中發現的ETS(E-twenty-six transformation specific)家族轉錄因子[2]。ETS 因子正常存在于細胞的一些生理和病理過程中[3-6],控制著靶基因的表達,而這些靶基因調控著細胞的增殖、分化、凋亡。因此ETS 因子是十分重要的轉錄因子。已有研究表明在某些腫瘤的發生過程中伴隨著多種ETS 因子的表達失調[7,8],因此ETS 因子可能在腫瘤的產生過程中起到了關鍵性的作用[9-11]。PDEF 作為ETS 家族轉錄因子的一員,其在腫瘤中的作用近年來受到了重視,尤其是發現在結直腸組織中其表達可以促進分泌性祖細胞向杯狀細胞分化,因此推斷結直腸癌的發生可能與PDEF 的表達有關[12]。本文在前期研究的基礎上,構建干擾質粒,干擾在HT29 細胞中高表達的PDEF 基因,觀察對HT29 細胞株的生物學行為的影響,為進一步研究結直腸癌的發病機制及靶向治療奠定基礎。
1 材料與方法
1.1 材料 E.coli DH5α 克隆菌株及結直腸癌HT29細胞株(PDEF 高表達,為非侵襲性結直腸腺癌細胞株)為我室留存,DMEM 高糖培養基購自Gibco 公司。PDEF 真核shRNA 干擾質粒GV102(sense5'-GGCCGCUUCAUUAGGUGGCUTT-3',antisense5'-AGCCACCUAAUGAAGCGGCCTT-3'),購自上海吉凱基因有限公司。質粒小量提取試劑盒購自Omega 公司,LipofectamineTM2000 轉染試劑及TRIzol 購于美國Invitrogen 公司。四甲基偶氮唑藍[3-(4,5-Dimethylthiazol-2-yl)2、5-diphenyltetra-zolium,MTT]、Boyden chamber含8 μm 濾膜購自索萊寶公司,matrigel 購自美國BD公司。鼠抗人PDEF 單克隆抗體購自Abcam 公司,鼠抗人β-actin 多克隆抗體及HRP 標記的山羊抗小鼠IgG 購自Santa Cruz 公司。ECL 低背景化學發光試劑盒購自康為世紀公司。
1.2 方法
1.2.1 細胞培養 結直腸癌細胞HT29 常規培養于含10%胎牛血清、100 U/ml 的青霉素、100 mg/L 鏈霉素的DMEM 高糖培養基中,置37℃、5%CO2培養箱內培養。
1.2.2 shRNA 瞬時轉染HT29 細胞株 實驗分組分別為正常對照組(細胞未經任何處理)、空白對照組(僅轉染空質粒)和shRNA 組(轉染特異干擾shRNA)。收集對數生長期細胞接種于6 孔培養板中,待細胞長至70%融合時,將5 μl Lipofectamine 2000 與10 μl GV102 或空白對照質粒(空質粒)分別稀釋于終體積為500 μl 無血清無抗生素的DMEM 高糖培養基中,室溫避光放置20 min,用無血清無抗生素DMEM 高糖培養基沖洗細胞3 次后,緩慢加入已稀釋好的脂質體與質粒DNA 混合液,補充無血清培養基至2 ml,使混合液均勻分布于培養基中。培養6 h 后補加胎牛血清至終濃度為20%,18 h 后換完全培養基繼續培養。24 h 后觀察轉染結果。
1.2.3 RT-PCR 檢測干擾前后PDEF 基因mRNA 的表達 細胞對數生長期取出6 孔板中的轉染HT29 細胞,DEPC 水洗3 次后每孔加入1 ml TRIzol,吹打細胞,移入1.5 ml EP 管中,按照TRIzol 說明進行細胞總RNA 提取。取1 μl 抽提的RNA 用DEPC 水稀釋50 倍后,以DEPC 水做空白對照,測定RNA 濃度。反轉錄過程按TaKaRa 試劑說明書進行操作。引物序列為:PDEF 上游引物:5'-TTACAAGAAGGGCATCATCC-3',下游引物:5'-GAAGGTCAGAGCAGCAGAGC-3',擴增產物為188 bp,GAPDH 上游引物:5'-TCCTCTGACTTCAACAGCGACA-3',下游引物:5'-TTCCTCTTGTGCTCTTGCTGG-3'擴增產物為202 bp。引物由上海生工生物工程技術服務有限公司合成。PCR 循環條件為:95℃預變性10 min;95℃變性30 s,55℃退火30 s,72℃延伸1 min,30 個循環;72℃延伸10 min。結果進行統計學分析。
1.2.4 Western blot 檢測干擾前后PDEF 蛋白的表達 提取細胞總蛋白,吸棄培養液,用1 ×PBS 洗滌3次。加入RIPA 裂解液,冰上裂解5 min。用細胞刮子將細胞碎片和裂解液移至EP 管中,4℃、12 000 r/min,離心20 min,其上清為提取的蛋白。將上清液小心轉移至新EP 管中,考馬斯亮藍法測定蛋白濃度定量后分別加入5 ×SDS-PAGE 上樣緩沖液,沸水煮5 min。上樣進行聚丙烯凝膠電泳,半干電轉將蛋白條帶轉移到PVDF 膜(0.22 μm)上,用含5%脫脂奶粉的封閉液封閉1.5 h,一抗(小鼠抗人PDEF,稀釋度1∶1 000)4℃孵育過夜,HRP 標記的兔抗鼠IgG 的二抗(1∶1 000)二抗孵育2 h,用TBST 洗膜后,ECL 化學發光試劑顯色,β-actin 作為內參,圖像分析系統測定灰度值。
1.2.5 MTT 法檢測細胞的增殖情況 胰酶消化對數生長期細胞,用含10%胎牛血清的DMEM 培養基吹打成單細胞懸液,以每孔104個細胞接種于96 孔培養板上,每孔體積100 μl,置于37℃、5%CO2培養箱培養,每組6 孔,分別在第1、2、3、4、5天以MTT 法檢測其吸光度(A)值。每孔中加入20 μl MTT(5 mg/ml)液繼續培養4 h,吸去上清液,加入150 μl/孔DMSO,震蕩10 min,使結晶充分溶解。用酶標儀在490 nm 波長比色測定每孔A 值,繪制生長曲線。
1.2.6 Transwell 侵襲實驗 將50 μl,1∶3稀釋的Matrigel 膠均勻平鋪于24 孔Transwell 小室8 μm 的PC 膜上,避免產生氣泡,將板置37℃培養箱30 min聚合成凝膠備用。用無血清的DMEM 培養液調整細胞濃度為1 ×105ml-1,上室分別加入200 μl 的細胞懸液,24 孔板下室加入每孔500 μl 含10%胎牛血清的DMEM 培養液,每組各3 孔,隨后將裝有Transwell 小室的培養板置入培養箱中培養24 h,吸棄上室液體、取出小室,以濕棉簽擦去聚碳酸酯微膜上的膠,進行蘇木精和結晶紫染色,沖洗后封片,于倒置顯微鏡下觀察穿過膜的細胞數目。
1.3 統計學分析 應用SPSS13.0 軟件進行統計分析,數據以±s 表示,服從正態分布的數據,用多組間比較,符合方差齊性的,用方差分析。P <0.05 表示差異有統計學意義。
2 結果
2.1 shRNA 干擾質粒在HT29 細胞中的表達 通過LipofectamineTM2000 轉染試劑將干擾質粒轉染HT29細胞。由于shRNA 組GV102 帶有EGFP 標記,轉染成功后可見綠色熒光蛋白表達。圖1B 為轉染36 h后,熒光顯微鏡下觀察的結果,可見綠色熒光蛋白的表達,說明干擾質粒成功轉染入HT29 細胞株,圖1A為未轉染質粒組,無綠色熒光蛋白表達。
2.2 實時定量PCR 檢測PDEF 基因mRNA 表達的抑制情況 將上述3 組細胞培養48 h 后分別提取總RNA,逆轉錄為cDNA,表達情況用熒光實時定量PCR 技術檢測,以GAPDH 作為內參,每組重復3 次。經2-△△CT分析與空白對照組相比,空白對照組為2-△△CT值 為0.99±0.09,shRNA 組 為0.67±0.07。shRNA 組與正常對照組相比,PDEF 基因mRNA 表達水平降低34%,有統計學意義(P <0.05),而正常對照組和空白對照組相比無統計學差異(P >0.05),可以說明轉染干擾質粒的細胞中PDEF 基因mRNA 的表達受到抑制(圖2)。
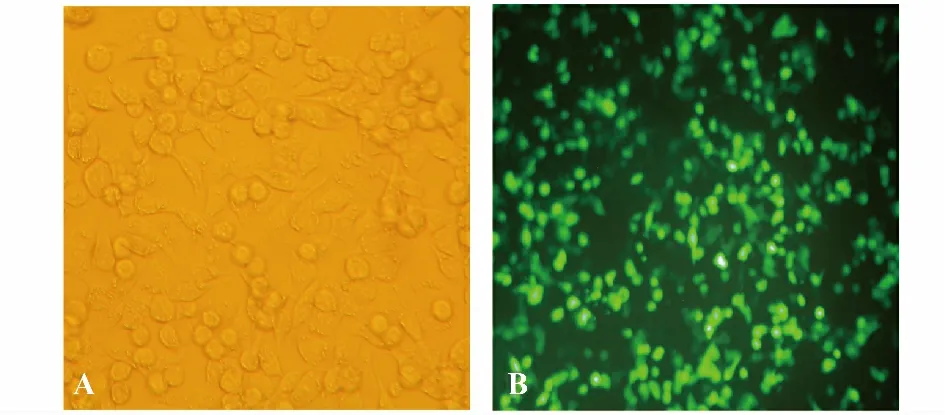
圖1 熒光顯微鏡觀察HT29 細胞轉染效果圖(×100)Fig.1 Transfer efficiency into HT29 cells under fluorescent microscope(×100)
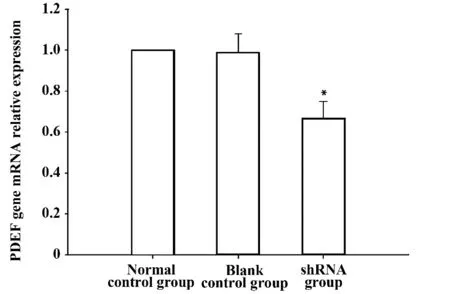
圖2 實時熒光定量PCR 檢測PDEF 基因mRNA 相對表達統計分析圖Fig.2 Statistical analysis diagram real-time fluorescent quantitative PCR detection PDEF gene mRNA relative expression
2.3 Western blot 檢 測PDEF 蛋白表達情況 Western blot 顯示正常對照組、空白對照組及shRNA 組各組灰度比值分別為:0.86±0.03,0.85±0.03,0.52±0.01(圖3B)。shRNA 組與正常對照組相比,PDEF 蛋白表達降低(圖3A),灰度分析顯示,shRNA 組與正常對照組相比,細胞中PDEF 蛋白水平下調(圖3A),有統計學意義(P <0.05)。空白對照組和正常對照組相比無統計學差異(圖3A)(P >0.05)。
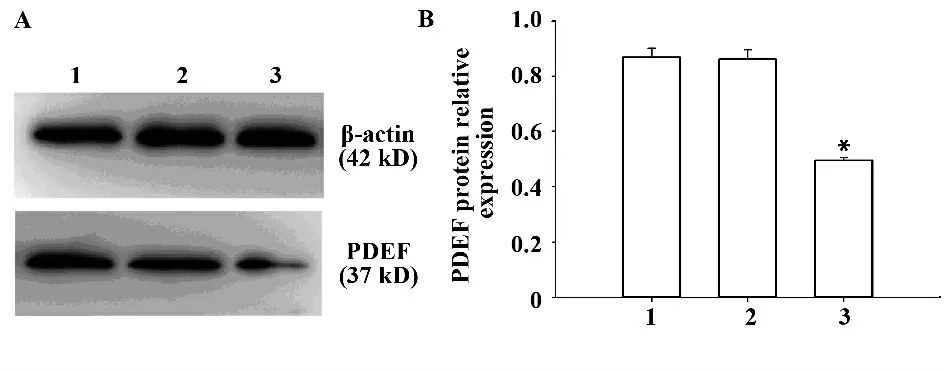
圖3 Western blot 分析PDEF 蛋白的表達Fig.3 Western blot analysis PDEF protein expression
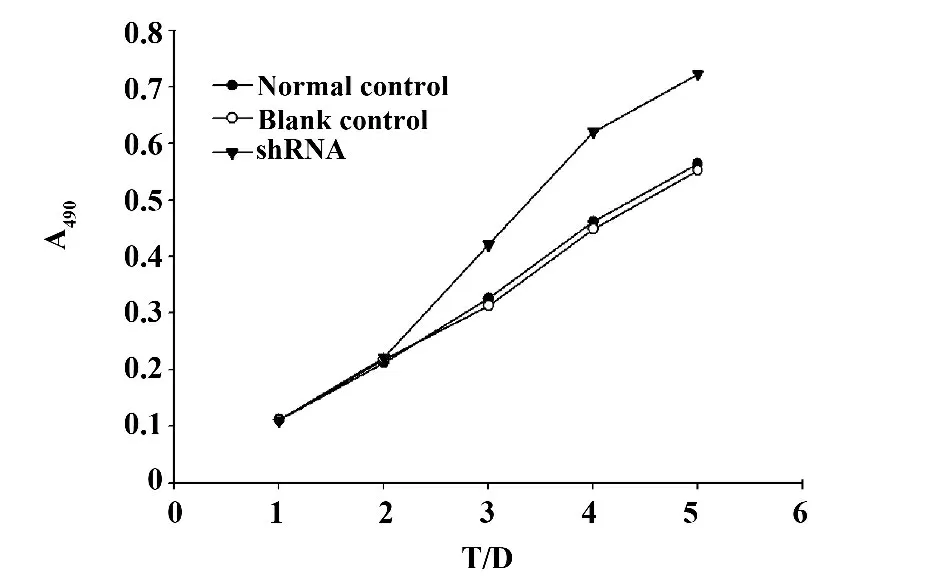
圖4 shRNA-PDEF 對HT29 細胞增殖的影響Fig.4 Effects of shRNA-PDEF on HT29 cell proliferation
2.4 干擾質粒對HT29 細胞增殖的影響 分別于細胞生長的第1、2、3、4、5 天,加入MTT,繼續培養生成藍色的formazan 結晶,加入DMSO 溶解formazan 結晶,酶標儀測定490nm處的光密度OD值,formazan結晶的生成量僅與活細胞數目成正比。OD 值越高反應細胞增殖能力越強。本實驗中shRNA 組OD值在細胞生長的第3 天開始與空白對照組相比,OD值明顯增高,表明細胞的增殖能力明顯增強,差異有統計學意義(P <0.05),而正常對照組與空白對照組OD 值無明顯差別(P >0.05),結果表明PDEF 基因沉默能促進腫瘤細胞的增殖(圖4)。
2.5 Transwell 侵襲實驗結果 HT29 細胞轉染干擾質粒后48 h,Transwell 侵襲實驗結果顯示,正常對照組、空白對照組、shRNA 組,各組穿膜細胞數分別為:28.66±2.08、31±6.24、77.33±7.76(圖5)。穿過Matrigel 膠的干擾組細胞數目(圖6)顯著高于正常對照組的細胞(圖6),shRNA 組平均每高倍視野侵出Matrigel 膠的細胞數與正常對照組相比顯著增加,差異有統計學意義(P <0.05),空白對照組平均每高倍視野侵出Matrigel 膠的細胞數(圖6)與正常對照組(圖6)相比無顯著差異(P >0.05),結果表明干擾PDEF 基因表達后,HT29 細胞的侵襲能力增強。
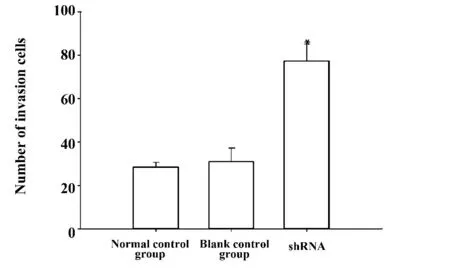
圖5 各組HT29 穿膜細胞數Fig.5 Numbers of invasion HT29 cells in each group

圖6 HT29 細胞Transwell 侵襲實驗光鏡照片(×200)Fig.6 HT29 cell Transwell experiment using photos (×200)
3 討論
結直腸癌是常見的消化道腫瘤之一,其發病率呈逐年上升的趨勢[13]。對于該疾病的治療已經有了很大的進展,但治療方法特異性低,導致了治療效果欠佳。因此研究對于該疾病的較特異的治療方案是提高大腸癌患者生存率的關鍵。因而,尋找結直腸癌特異的治療方法具有重要的意義。
PDEF 是個新發現的EST 家族的轉錄因子,相對分子質量為37 500 Da[14],定位于6 號染色體短臂上(6P21.3),PDEF 中存在許多磷酸化位點,可能參與多條信號轉導通路,已有研究報道,在一些腫瘤的形成過程中[15-17],伴隨著PDEF 的表達失調,這表明PDEF 因子具有較強的腫瘤相關性特點[18-21]。本研究在該課題前期研究的基礎上,進一步干擾PDEF 基因的表達可能為結腸癌的治療提供新的思路。
本文通過shRNA 技術沉默人結直腸癌細胞株HT29 中PDEF 基因的表達,觀察該基因沉默后HT29 細胞生物學行為如細胞增殖和侵襲的改變。RT-PCR、Western blot 結果表明干擾PDEF 基因后HT29 細胞中PDEF 基因mRNA 及蛋白的表達水平與正常對照組和空白對照組相比均降低,差異有統計學意義(P <0.05)。細胞生長曲線分析表明,shRNA 組與正常對照組、空白對照組相比細胞增殖能力加強(P <0.05)。
本實驗在體外證明了PDEF 在結直腸癌細胞中發揮了潛在的抑癌作用,抑制其表達促進了HT29細胞的增殖與侵襲能力。雖然本研究體外實驗結果支持PDEF 在結直腸癌中的抑癌作用,但其具體的發病機制還有待研究,進一步的組織學水平和體內實驗有待開展。PDEF 作為轉錄因子,很可能是影響了某種靶基因的表達,而該靶基因必定在細胞的增殖分化等生理過程中發揮著重要的作用,因此尋找PDEF 作用的靶基因也是下一步研究工作的重點,這有望為結直腸癌的治療提供新的靶點,將有可能為結直腸癌的靶向治療提供新的途徑。
[1]Oettgen P,Finger E,Sun Z,et al.PDEF,a novel prostate epithelium-specific ets transcription factor,interacts with the androgen receptor and activates prostate-specific antigen gene expression[J].J Biol Chem,2000,275(2):1216-1225.
[2]Deves C,Renck D,Garicochea B,et al.Analysis of select members of the E26 (ETS)transcription factors family in colorectal cancer[J].Virchows Arch,2011,458(4):421-430.
[3]Noah TK,Kazanjian A,Whitsett J,et al.SAM pointed domain ETS factor (SPDEF)regulates terminal differentiation and maturation of intestinal goblet cells[J].Exp Cell Res,2010,316 (3):452-465.
[4]Meadows SM,Myers CT,Krieg PA.Regulation of endothelial cell development by ETS transcription factors[J].Semin Cell Dev Biol,2011,22(9):976-984.
[5]Buchwalter G,Hickey MM,Cromer A,et al.PDEF promotes luminal differentiation and acts as a survival factor for ER-positive breast cancer cells[J].Cancer Cell,2013,23(6):753-767.
[6]Schaefer JS,Sabherwal Y,Shi HY,et al.Transcriptional regulation of p21/CIP1 cell cycle inhibitor by PDEF controls cell proliferation and mammary tumor progression[J].J Biol Chem,2010,285(15):11258-11269.
[7]Sood AK,Kim H,Geradts J.PDEF in prostate cancer[J].Prostate,2012,72(6):592-596.
[8]Sood AK.PDEF and PDEF-induced proteins as candidate tumor antigens for T cell and antibody-mediated immunotherapy of breast cancer[J].Immunol Res,2010,46(1-3):206-215.
[9]Pal M,Koul S,Koul HK.The transcription factor sterile alpha motif(SAM)pointed domain-containing ETS transcription factor (SPDEF)is required for E-cadherin expression in prostate cancer cells[J].J Biol Chem,2013,288(17):12222-12231.
[10]Steffan JJ,Koul HK.Prostate derived ETS factor (PDEF):a putative tumor metastasis suppressor[J].Cancer Lett,2011,310(1):109-117.
[11]顧婷婷,谷圣美,金 偉,等.ETS2 在乳腺癌細胞中調控CXCR4 轉錄的機制研究[J].中國癌癥雜志,2013,23(11):892-899.
[12]Gregorieff A,Stange DE,Kujala P,et al.The ets-domain transcription factor SPDEF promotes maturation of goblet and paneth cells in the intestinal epithelium[J].Gastroenterology,2009,137(4):1333-1345.
[13]Zavoral M,Suchanek S,Majek O,et al.Colorectal cancer screening:20 years of development and recent progress[J].World J Gastroenterol,2014,20(14):3825-3834.
[14]Wasylyk B,Hagman J,Gutierrez-Hartmann A.Ets transcription factors:nuclear effectors of the Ras-MAP-kinase signaling pathway[J].Trends Biochem Sci,1998,23(6):213-216.
[15]Ghadersohi A,Odunsi K,Zhang S,et al.Prostate-derived Ets transcription factor as a favorable prognostic marker in ovarian cancer patients[J].Int J Cancer,2008,123(6):1376-1384.
[16]Mukhopadhyay A,Khoury T,Stein L,et al.Prostate derived Ets transcription factor and Carcinoembryonic antigen related cell adhesion molecule 6 constitute a highly active oncogenic axis in breast cancer[J].Oncotarget,2013,4(4):610-621.
[17]Johnson TR,Koul S,Kumar B,et al.Loss of PDEF,a prostate-derived Ets factor is associated with aggressive phenotype of prostate cancer:regulation of MMP 9 by PDEF[J].Mol Cancer,2010,9:148.
[18]Turner DP,Findlay VJ,Kirven AD,et al.Global gene expression analysis identifies PDEF transcriptional networks regulating cell migration during cancer progression[J].Mol Biol Cell,2008,19(9):3745-3757.
[19]Sabherwal Y,Mahajan N,Helseth DL,et al.PDEF downregulates stathmin expression in prostate cancer[J].Int J Oncol,2012,40(6):1889-1899.
[20]Turner DP,Findlay VJ,Moussa O,et al.Mechanisms and functional consequences of PDEF protein expression loss during prostate cancer progression[J].Prostate,2011,71(16):1723-1735.
[21]Feldman RJ,Sementchenko VI,Gayed M,et al.Pdef expression in human breast cancer is correlated with invasive potential and altered gene expression[J].Cancer Res,2003,63 (15):4626-4631.