從教材到教學的研究——以“共價鍵”為例
卓高峰魏樟慶
(1浙江省樂清市第三中學浙江樂清325600;2浙江省樂清中學浙江樂清325600)
蘇教版《化學2》專題1“微觀結構與物質多樣性”,從原子核外電子排布入手,介紹了元素周期律,引入到微粒間的相互作用,最終從微觀結構層次上認識物質的多樣性。“共價鍵”屬于微粒間的相互作用力,了解微粒間存在的相互作用力,可以幫助學生認識原子是怎樣構成物質,學會從化學鍵的角度認識化學反應,幫助學生建立物質多樣性與微觀結構的關系的基本觀念。
一、三套教材中共價鍵內容的編排特點
1.魯科版《化學2》教材中共價鍵內容的編排特點
魯科版《化學2》第2章“化學鍵與化學反應”,其中第1節“化學鍵與化學反應”包括兩部分內容:化學鍵與化學反應中的物質變化和化學鍵與化學反應中的能量變化。教學次序為:化學鍵→離子鍵→共價鍵→離子化合物與共價化合物→化學鍵與化學反應中的能量變化。
化學反應伴隨著物質變化與能量變化,教材通過分析電解水的本質是舊化學鍵的斷裂、新化學鍵的形成,再分析氫氣、氯氣生成氯化氫,解釋氫原子、氯原子為什么能結合形成氯化氫分子,建立“共價鍵是原子間通過共用電子對形成的化學鍵”的基本概念,滲透化學反應與共價鍵(化學鍵)之間的關系。
2.人教版《化學2》教材中共價鍵內容的編排特點
人教版《化學2》第1章“物質結構元素周期律”,其中第3節“化學鍵”包括兩部分內容:離子鍵和共價鍵。教學次序為:離子鍵(離子化合物)→共價鍵(共價化合物)→化學鍵→分子間作用力和氫鍵(科學視野)→化學鍵與化學反應中能量的變化關系(另一章節)。
元素的原子通過相互作用形成豐富多彩的物質,教材分析H、Cl的原子結構,解釋H2、Cl2、HCl的形成,建立“共價鍵是原子間通過共用電子對所形成的相互作用”的基本概念,最后用化學鍵的觀點解釋化學反應。
3.蘇教版教材中共價鍵內容的編排特點
蘇教版《化學2》第1章“微觀結構與物質的多樣性”,其中第2單元“微粒之間的相互作用力”包括三部分內容:離子鍵、共價鍵和分子間作用力。教學次序為:化學鍵→離子鍵(離子化合物)→共價鍵(共價化合物)→分子間作用力→氫鍵(拓展視野)→化學反應中的熱量變化(專題2內容)。
構成物質的基本微粒有原子、分子、離子等,這些微粒通過一定的相互作用力彼此結合。由微粒之間的相互作用,導入離子鍵、共價鍵、分子間作用力。教材以形成氯化氫為例,兩種非金屬元素相互化合時,形成共用電子對,共用電子對會受到原子核的吸引,建立“共價鍵是原子間通過共用電子對所形成的強烈的相互作用”的基本概念,強調物質的微粒性以及微粒之間的相互作用,淡化化學反應與化學鍵的關系。
二、“共價鍵”教學案例分析
公開發表的有關“共價鍵”的教學設計并不多,出現較多的都只是教學片斷。姚淑霞老師的教學設計《化學鍵概念教學的創新嘗試》曾發表在《化學教學》2009年第7期,在化學鍵的教學中,用比較法對“共價鍵”的教學做了較好的設計。教學思路如下:
(1)創設情境,提出問題。呈現各種各樣物質的圖片,提出以氯元素為例,氯可以形成哪些物質?
(2)探究氯原子達到穩定結構的可能途徑:電子得失、形成共用電子對。
(3)比較法形成離子鍵和共價鍵概念。從原子達到穩定結構的可能途徑→形成離子鍵的過程→形成共價鍵的過程→比較離子鍵和共價鍵的形成→深化離子鍵和共價鍵的概念。
(4)提出化學鍵概念。
其中,對共價鍵概念的形成教學細節如下:
[提出問題]氫原子和氯原子結合形成氯化氫的微觀過程是怎樣的?怎樣用電子式表示氯化氫分子?怎樣用電子式表示氫原子和氯原子結合形成氯化氫分子的微觀過程?
[引導學生概括]在氫原子和氯原子之間不能發生電子得失。從微觀角度看,氫原子和氯原子化合時,它們各拿出一個最外層電子共用,形成一對共用電子對,從而結合在一起。這種相互作用屬于共價鍵。
[師生小結]

?
本案例中選擇學生熟悉的氯為例,把離子鍵的形成和共價鍵的形成整合成一節課。在一般的教學中,第一課時學習離子鍵,第二課時再學習共價鍵。而通過這樣整合的教學,能夠把離子鍵的學習成果及時地遷移到共價鍵的學習中去,易于比較離子鍵和共價鍵的異同點,當堂為學生提供主動學習的機會,使教學邏輯更加鮮明,也使教學時間更加節約。
三、“共價鍵”教學論問題分析
1.兩種認知觀點
一是認為物質是微粒構成的,微粒之間存在相互作用力。雖然學生在初中的自然科學中對物質的構成微粒有一定的認知基礎,但對微粒間的相互作用缺少深層次的理解。蘇教版《化學2》舉例2個氯原子為什么能結合成1個氯分子,1個氯原子和1個氫原子為什么能結合成1個氯化氫分子,然后將共價鍵的概念固著在原子核和共用電子對上,當原子形成共價鍵時,是原子最外層電子發生了重排,建構“共價鍵是原子間通過共用電子對所形成的強烈的相互作用”的基本觀念。
二是認為化學反應是微粒的重組及微粒間相互作用力的變化。魯科版《化學2》認為化學反應是舊化學鍵的斷裂與新化學鍵的形成的過程,以電解水為例,電解時基本微粒發生變化,同時化學鍵也發生變化,構建化學鍵與化學反應的基本觀念。
2.學生認識發展障礙點分析
(1)如何讓學生建立“構成物質的微粒及微粒間的相互作用”這一認識
高一學生已經了解了物質是由分子、原子、離子構成的,知道化學反應的本質是分子再分、原子重新組合,但并不清楚分子再分、原子重新組合的原因,并不清楚這些微粒之間是通過怎樣的相互作用構成物質的。換言之,學生從宏觀組成上已經認識了一些無機物,但從微觀角度還不清楚這些物質中存在的微粒形式和相互作用。[4]
對于氯化氫是由什么微粒構成,多數認為氫離子和氯離子(根據氫氯的化合價或從氯化氫在水中能電離出氫離子和氯離子判斷)、氫原子和氯原子,不知道它是由氯化氫分子構成。如果對氯化氫的微粒構成不清楚,學生就無法準確理解共價鍵的作用方式以及共價化合物的形成過程。
(2)如何讓學生理解原子對共用電子對的作用
氯化鈉晶體中,鈉離子與氯離子為什么能牢牢地結合在一起?學生容易從離子鍵的定義中得出結論:陰陽離子間的靜電作用?(容易錯誤地理解為靜電吸引)。但在氯化氫分子中氫原子和氯原子為什么能牢牢地結合在一起?學生從共價鍵文字表述中很難理解“原子對共用電子對的作用”。是因為沒有從微粒的電性思考問題:共用電子對帶負電荷、原子核帶正電荷,從而有靜電作用,產生鍵能和鍵長(原子核間的距離)。
學生在學習共價鍵時,還可能會對共用電子對的理解出現困難,氫和鈉都在IA族,最外層都只有一個電子,為什么氫原子不容易失去電子,而是以共用電子對的方式結合形成化合物呢?需要幫助學生解決共價鍵的形成條件。
四、基于觀念建構的教學設計
1.以觀念建構為本的教學內容分析
“微粒觀”是本節內容的核心觀念,物質是微粒構成的,微粒之間存在相互作用力;化學反應是微粒的重組及微粒間相互作用力的變化。知識間的層級關系如下:
2.以觀念建構為本的教學設計
以蘇教版《化學2》專題1第二單元“共價鍵”為例(片段)。
[問題引入](1)寫出H、Na、Cl三種元素在元素周期表的位置及原子結構示意圖。
(2)寫出由這3種元素組成的物質及其構成微粒。

?
設計意圖:重點考查構成物質的微粒。因為物質的微粒構成是學習化學鍵的基礎,也是能否學好共價鍵的關鍵因素。
[討論1]鈉原子與氯原子如何形成氯化鈉?鈉離子與氯離子為什么能牢牢地結合在一起?
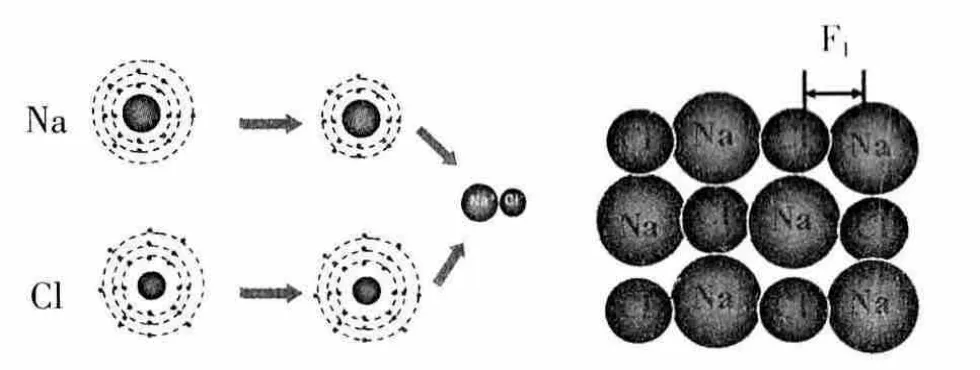
回憶:當鈉原子與氯原子相遇時,鈉原子容易失去最外層的1個電子,成為帶正電的鈉離子,而氯原子容易得到1個電子,成為帶負電的氯離子,這兩個陰、陽離子通過靜電作用,形成了氯化鈉晶體。圖示的作用力F1就是離子鍵。
設計意圖:以氯化鈉為例,理解離子鍵是陰陽離子的靜電作用,離子鍵是一種用力。并將離子鍵的學習成果及時地遷移到共價鍵的學習中去,為學習共價鍵做好方法鋪墊。
[討論2](1)氫原子與氫原子如何形成氫分子?氫分子中兩個氫原子為什么能牢牢地結合在一起?
(2)氫原子核帶什么電荷,共用電子對帶什么電荷?共價鍵的本質是什么?
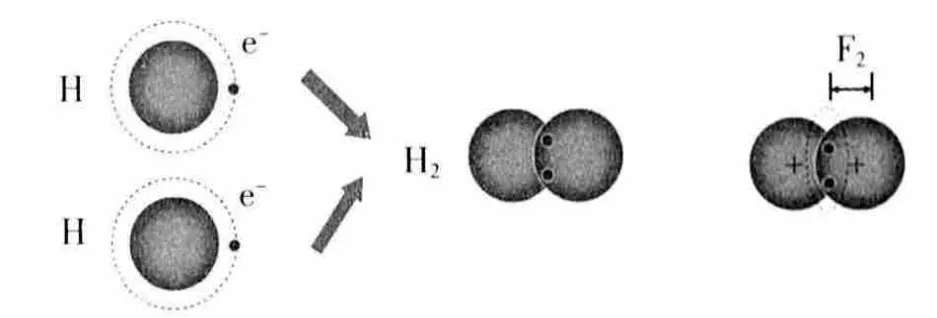
(3)氫原子和氯原子為什么可以形成氯化氫分子?
(4)哪些元素可以形成共價鍵?成鍵微粒是什么?它們是如何成鍵的?
設計意圖:以H2為例,深刻理解共價鍵是帶正電的原子核與帶負電的共用電子對之間的靜電作用,包括原子核與原子核之間的相互作用、電子與電子之間的相互作用,還有原子核與共用電子對之間的相互作用,共價鍵也是一種作用力。并以H2為例,推廣到其它非金屬原子形成共價鍵的過程,從而歸納共價鍵的本質、成鍵元素、成鍵微粒。
[歸納]共價鍵的形成?
五、討論及建議
蘇教版《化學2》專題1中“共價鍵”的內容主要包括共價鍵的概念,共價分子的類型與表示方法,淡化了從微觀角度即從化學鍵角度認識化學反應。教材中以氯化氫分子為例形成共價鍵概念,在氯化氫的形成過程中,氫原子從哪里來?氯原子從哪里來?化學反應的本質又是什么?未做進一步的闡述,若在教學中立足在生成氯化氫本質的層面略加擴展,就能夠幫助學生更好更完整地從微粒觀角度理解化學反應。
教材對共價鍵表示方法的學習,主要是停留在能夠用電子式表示共價分子的結構的層面上。雖然通過介紹典型分子(如HCl、Cl2、H2O、NH3、CH4)的電子式、結構式、球棍模型和比例模型,讓學生們能夠體會到原子為了形成穩定結構,原子間通過共用電子對而形成靜電作用的形式。對于自然界中豐富多彩的物質結構形式,這樣的認識依舊是具體而零散的,缺乏對原子形成物質的過程中的基本結構形式的整體認識。在教學過程中,如果能將“共價鍵”教學的立足點在原有的基礎上再向原子組合形成宏觀物質的行為層面略加擴展,即從典型分子(如HCl、Cl2、H2O、NH3、CH4)的結構解釋中抽取出常見原子(C、N、O、H和鹵素原子)在形成共價鍵時的基本成鍵方式、基本幾何構型,更能讓學生從微粒觀的角度感受到這種結合方式是物質世界中最基本的結構形式。
[1]王磊.普通高中課程標準實驗教科書:化學2(必修)[M].北京:山東科技出版社,2006
[2]宋心琦.普通高中課程標準實驗教科書:化學2(必修)[M].北京:人民教育出版社,2006
[3]王祖浩.普通高中課程標準實驗教科書:化學2(必修)[M].南京:江蘇教育出版社,2006
[4]張琦,谷黎芳,韓雪,楊艷紅.化學鍵概念的學生調研及教學策略[J].化學教育,2012,(2):12-15
[5]姚淑霞.化學鍵概念教學的創新嘗試[J].化學教學,2009,(7):51-54
[6]江敏.感受自然界的魅力—“共價鍵”的教學實踐與思考[J].中學化學教學參考,2011,(8):16-20

