光催化降解活性染料K-GL的動力學及其鹽效應
湯善康,耿啟金,劉剛,王笑,楊認武
(1濰坊學院化學化工與環境工程學院,山東 濰坊 261061;2北京金隅紅樹林環保技術有限責任公司,北京 100013)
活性染料結構復雜,生物降解性較低,大多都具有潛在毒性,其在印染廢水中含量高、色度深、水質變化波動大,對水生態系統及其邊界環境危害日益暴露。目前國內外對于染料廢水的傳統處理方法主要有吸附法、絮凝法、生物法、化學氧化法,電解法以及一些優化組合工藝等[1]。但對于染料廢水,采用傳統工藝難以達到理想的效果,因而開發高效、低能耗、適用范圍廣和有深度氧化能力的化學污染物清除技術具有廣闊的前景。
自從1972年Fujishima和Hondo[2]報道了在受輻照的 TiO2上可以持續發生水的氧化還原反應以來,水中污染物的光催化氧化過程成為國內外環境科學的研究熱點。大量研究[3-8]表明,染料、表面活性劑、有機鹵化物、農藥、油類、氰化物等都能有效地進行光催化降解反應而脫色、去毒、礦化為無機小分子物質,從而消除對環境的污染。
盡管科研工作者已經開展了染料的光催化降解研究工作,但是目前主要集中在染料的降解過程,如納米 TiO2的摻雜改性以及納米TiO2催化劑的附載方面,而對染料所處環境中不同鹽的類型和濃度及其對光催化降解動力學影響未作深入的研究。
本工作以活性翠蘭K-GL為研究目標,運用多相光催化降解技術系統地探討了染料濃度、催化劑用量對 K-GL降解動力學的影響,考察了 Cl?和SO42?無機陰離子離子對光催化降解K-GL的影響,進一步闡述納米TiO2光催化降解K-GL的動力學規律,為光催化技術在實際中的應用提供可靠依據。
1 實驗部分
1.1 實驗儀器及設備
722N可見分光光度計,上海精密科學儀器有限公司;TU-1810型紫外可見分光光度計,北京譜析分析儀器有限公司;恒溫磁力攪拌器,深圳天南海北有限公司;紫外殺菌燈管,功率25W,最大發射波長254nm,上海歐城實業有限責任公司。
1.2 染料K-GL結構與光催化劑
活性翠蘭 K-GL(取自濰坊第二印染廠,未作純化處理)的分子結構見圖 1,溶液的最大吸收波長在610nm處,在其最大吸收波長下工作曲線方程為A=0.00483+13.705C。實驗使用的光催化劑納米二氧化鈦為Degussa P25(購于Degussa公司上海分理處)。
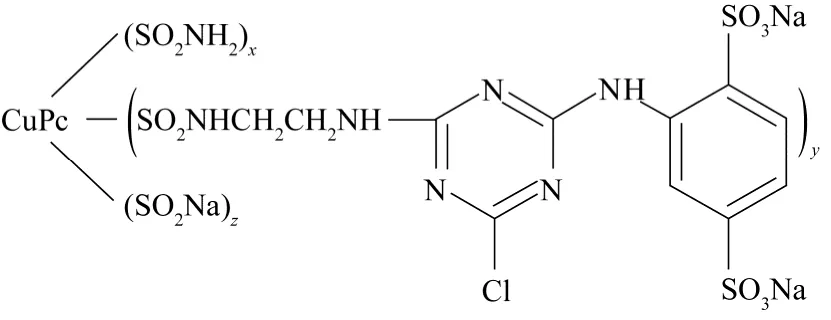
圖1 活性翠蘭K-GL的分子結構(其中x+y+z=3.5~4)
1.3 光催化實驗裝置
TiO2光催化降解反應在在鼓泡流化床光催化反應器中進行。反應裝置主要包括位于中心套管圓心處的紫外燈管以及由石英玻璃管外壁、有機玻璃管內壁及其底部圍成的反應池(體積為 1.1L,池高500mm,環隙10mm)、氣泵、液泵、貯液槽組成。氣泵向反應池底部通入空氣,通過氣體分布器分散鼓泡,使TiO2催化劑與染料溶液混合均勻,并用液泵使染料溶液在貯槽(體積為4L)和反應池間循環流動,實驗裝置如圖2所示。
1.4 實驗步驟與分析方法
取一定體積的染料溶液,先固定染料初始濃度,用紫外燈照射進行降解,測定最佳催化劑加入量,然后用同樣的方法分別測定在其他條件最優情況下的最佳染料初始濃度,最后測定Na2SO4和NaCl分別在不同濃度下對光催化降解效率的影響。
在一定的濃度范圍內,吸光度A與溶液濃度C成線形關系,濃度越高,吸光度越大。因此可以通過測定吸光度來計算染料的濃度,進而通過式(1)計算染料的降解率η。
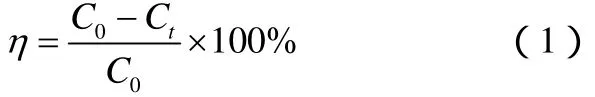
式中,C0為降解前溶液的濃度,g/L;Ct為降解后溶液的濃度,g/L。
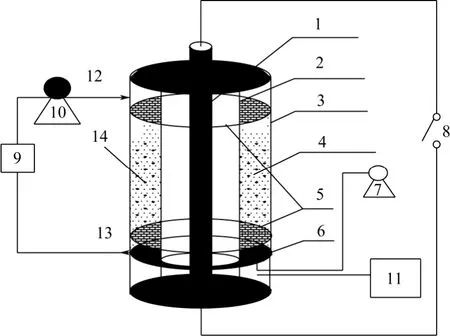
圖2 實驗裝置簡圖
配置一定濃度的染料溶液,取 4L加到反應容器內,加入一定量的納米TiO2分散均勻后的溶液,用磁力攪拌器攪拌,暗反應40min達到吸附-脫附平衡后在紫外光照射下進行降解反應。每隔25min取一次樣,以蒸餾水作為參比液,用722型可見分光光度計測其在最大吸收波長下的吸光度,然后通過吸光度-濃度工作曲線將吸光度換算成濃度,并用式(1)計算染料的降解率。為消除實驗誤差,實驗重復操作3次,實驗相對誤差小于2%,且具有較好的重復性。
2 結果與討論
2.1 影響光催化降解染料的因素
2.1.1 TiO2添加量
一定濃度的染料溶液在紫外光輻照 4h的條件下,體系中TiO2濃度與染料溶液降解率的關系如圖3。由圖3可見,固定時間降解率先會隨著催化劑用量的增加而上升,但在投加量過大時,反應速率反而減小。這說明,當TiO2投入量過少時,光源產生的光子不能被完全轉化為化學能,使得光子能量沒能得到充分的利用,降解率較低;適當增加催化劑TiO2的含量可產生更多的活性中心,增大反應的固液接觸面積,加快反應速率;但當TiO2投入量過多時,催化劑相互覆蓋,造成顆粒對光的屏蔽散射,從而影響溶液的透光率。因此,對于活性翠蘭K-GL,最佳催化劑添加量為0.122g/L。
2.1.2 染料初始濃度
采用梯度濃度的染料溶液進行光催化降解,得到各個濃度下的降解率-時間曲線,如圖4所示。由圖4可見,降解率隨濃度的增加而降低且降低幅度較大,在較低濃度時,前 125min降解率很高,但隨時間延長降解效果變差。染料濃度較高的情況下,溶液的色度較高,嚴重影響了紫外光的透過效率,使光催化降解K-GL的效率降低。
2.1.3 無機鹽Na2SO4
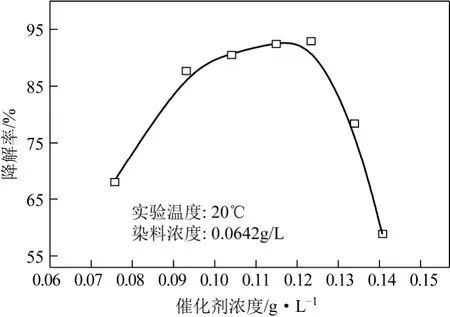
圖3 K-GL染料降解率與催化劑投入量的關系
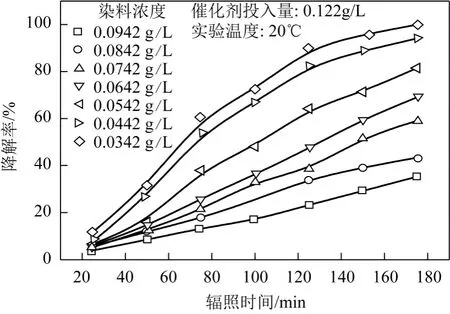
圖4 染料濃度對光催化降解K-GL的影響
無機鹽對光催化降解活性翠蘭K-GL的影響明顯,本實驗選用了較低催化劑添加量和適中的染料濃度進行實驗研究。在反應器內加入濃度為0.0362g/L的 K-GL溶液 4 L,并加入濃度為0.0463g/L的TiO2催化劑,研究了Na2SO4梯度濃度下染料降解率隨時間的變化規律,如圖5所示。
由圖5可見,NaSO4對K-GL光催化降解效率的影響較復雜,加入少量的無機鹽時,反應體系中SO42?會對活性翠蘭的降解其促進作用,且在 SO42?濃度較低(≤10g/L)時,存在最佳濃度4.482g/L;當 SO42?濃度超過 10g/L后,SO42?對 K-GL光催化降解的促進作用隨濃度的增加而升高,在16.950g/L時染料降解率可以提高2倍以上。
2.1.4 無機鹽NaCl
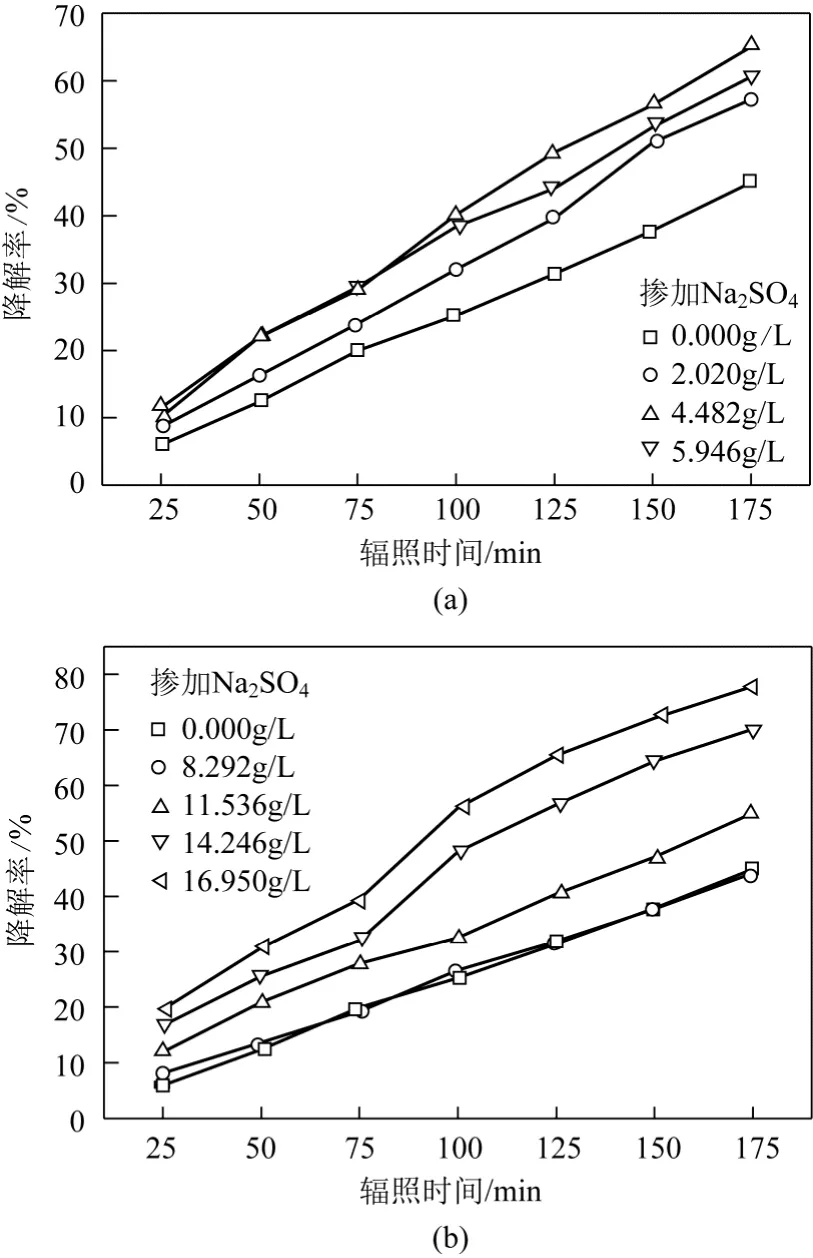
圖5 Na2SO4濃度對光催化降解染料K-GL的影響
在相同的條件下進行K-GL的光催化降解,得到在梯度 NaCl濃度下染料降解率隨時間的變化趨勢,如圖6所示。
由圖6可見,NaCl的加入對染料降解作用隨著濃度的波動變化較大,但在整體上 NaCl對 K-GL光催化降解起抑止作用。其中,較低濃度(≤ 4g/L)時NaCl抑制作用并不明顯,NaCl濃度在5g/L左右時抑止作用增加較大,且隨時間增加效果越明顯。
2.2 光催化降解動力學規律
2.2.1 濃度對光催化動力學的影響
將隨時間變化的 K-GL濃度繪制出 ln(C/C0)-t曲線,并對ln(C/C0)-t曲線進行線性回歸分析,如圖7所示,其線性相關系數R2均在0.96以上。由此可見,TiO2光催化降解活性翠蘭K-GL反應符合一級動力學規律,光催化降解K-GL反應的表觀反應速率常數kapp與K-GL濃度的關系如圖8所示。
由圖8可見,光催化降解反應的表觀速率常數隨活性翠蘭的濃度增加而減小,但降幅隨濃度的增加而減小。由此說明染料濃度升高時,溶液色度增加,影響了紫外光的透過率,從而使染料光催化降解的反應速率降低。
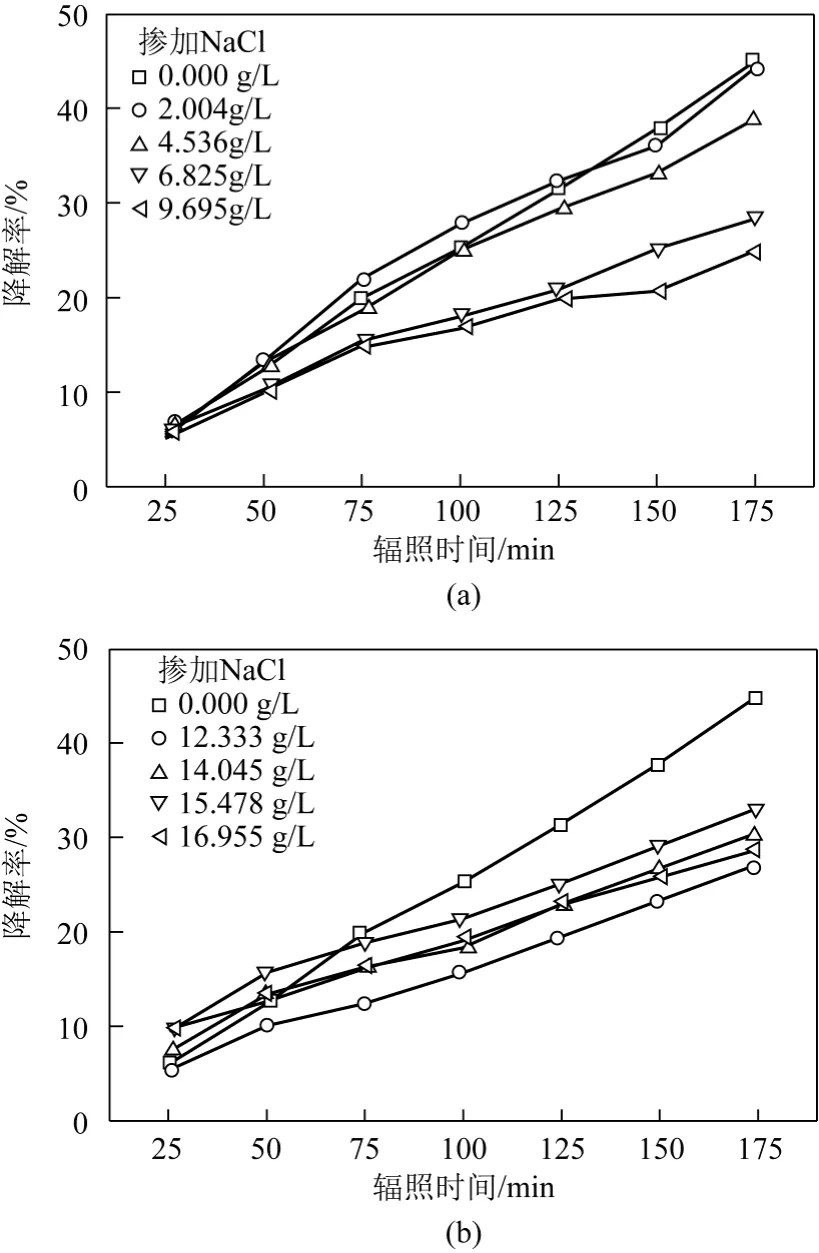
圖6 NaCl濃度對光催化降解染料K-GL的影響
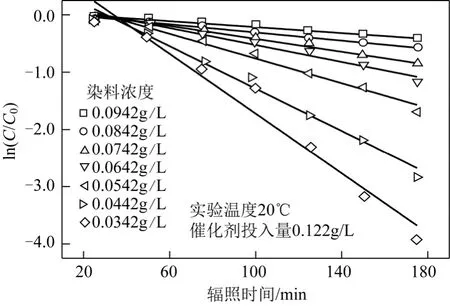
圖7 染料濃度下對光催化降解K-GL動力學的影響
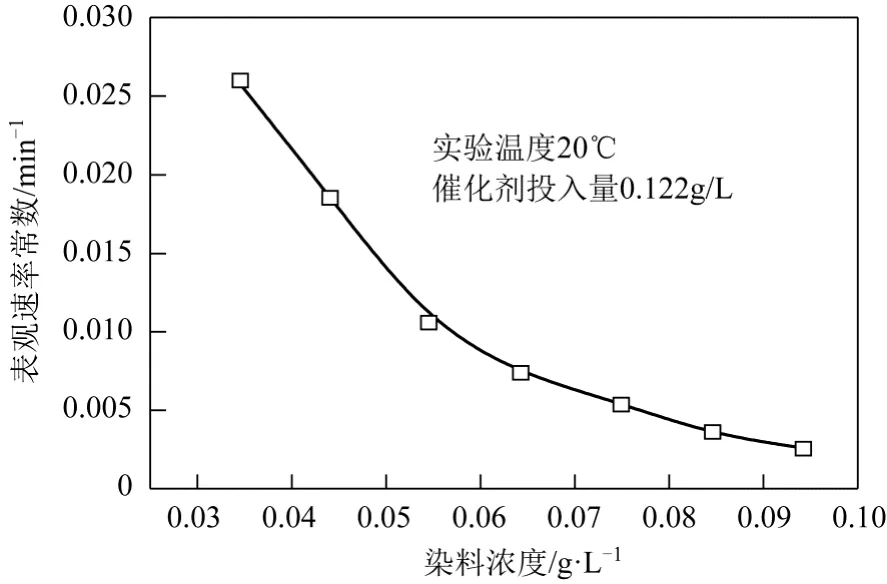
圖8 光催化降解反應表觀速率常數與染料K-GL濃度的關系
2.2.2 無機鹽對光催化動力學的影響
為考察無機鹽NaSO4和NaCl對活性翠蘭K-GL染料降解的動力學影響規律,分別將不同 Na2SO4和 NaCl添加量下的 K-GL降解反應繪制出ln(C/C0)-t曲線,對其進行線性回歸分析,如圖9和圖10所示,其線性相關系數R2均大于0.96,符合一級動力學規律,從而可得在不同無機鹽添加量下光催化降解 K-GL反應的表觀反應速率常數kapp。
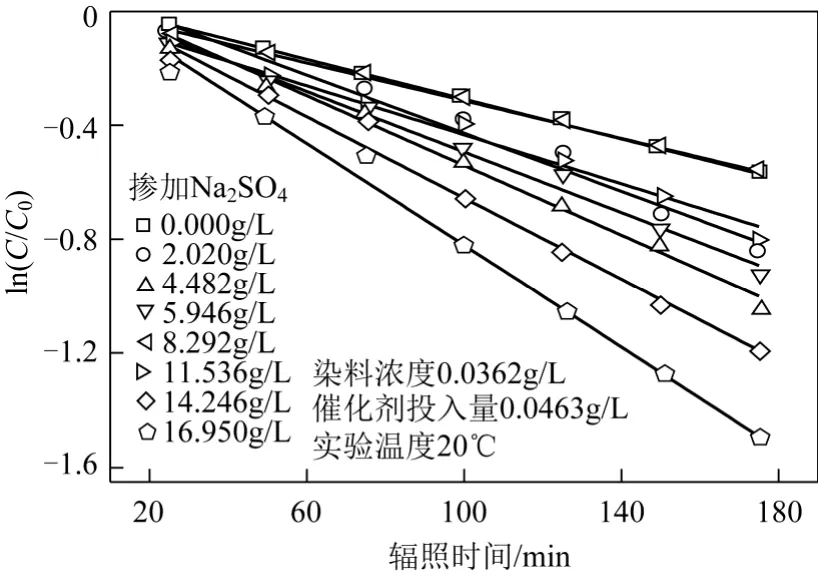
圖9 Na2SO4添加量對光催化降解動力學的影響
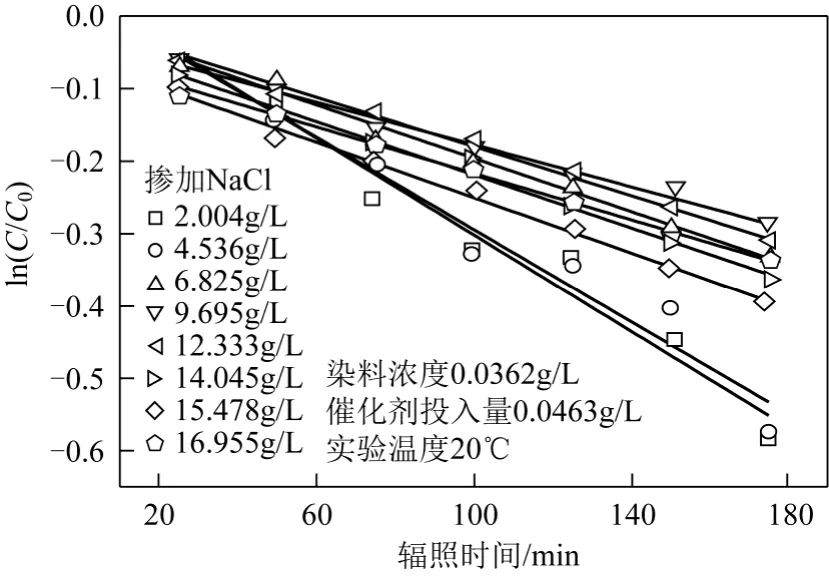
圖10 NaCl摻加量對光催化降解K-GL動力學的影響
將光催化體系中 Na2SO4不同摻加量對光催化降解活性翠蘭K-GL反應表觀速率常數的影響進行對比,如圖11所示。由圖11可見,光催化體系中的Na2SO4對于染料K-GL的降解表現出明顯的促進作用,并且在其濃度較低時(≤10g/L),對應于Na2SO4摻加量為 4.482g/L存在最大的表觀速率常數 0.00613min?1;而對應于 Na2SO4摻加量為8.292g/L存在最小的表觀速率常數 0.00331min?1。由此可推測摻加 Na2SO4無機鹽后會產生復雜的反應機理:Na2SO4對光催化降解的作用機理可能符合吸附模型[9],Na+在 TiO2表面和染料上的官能團之間起到了架橋作用,如圖11所示;當Na2SO4濃度超過最佳值后,SO42?在催化劑表面的吸附與染料的吸附間產生競爭,使反應速率下降;隨著 Na2SO4濃度繼續增加,SO4–·自由基機理[9-10]可能占據了主導作用,SO4–·與OH·共同參與氧化還原反應,提高了反應速率。
染料吸附模型見圖12。由圖12可見,光催化體系中的NaCl對于K-GL染料的降解表現出明顯的抑止作用,推測機理為:大量 Cl–吸附到催化加表面,形成≡Ti—Cl內層配合物[11-12],可能阻礙了染料分子在催化劑表面的吸附。
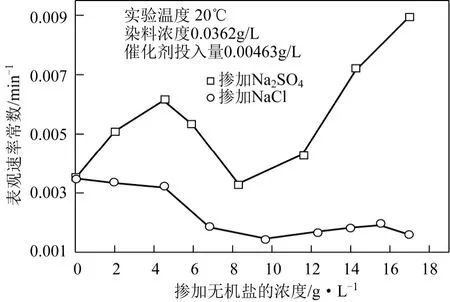
圖11 摻加無機鹽對光催化反應表觀速率常數的影響
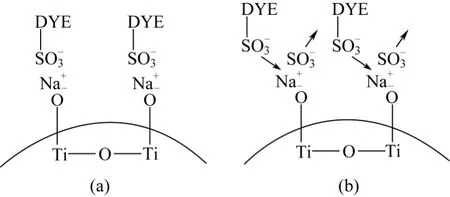
圖12 染料吸附模型示意圖[9]
3 結 論
通過對光催化降解活性艷藍K-GL染料的實驗研究,可以得出以下結論。
(1)對于TiO2光催化降解活性翠蘭K-GL反應,K-GL的光催化降解速率隨初始濃度的升高而降低,催化劑 TiO2的最適濃度為 0.122g/L;TiO2光催化降解活性翠蘭反應符合一級動力學規律。
(2)Na2SO4摻加量對光催化降解染料的影響復雜,可能與吸附模型和SO4–·自由基機理相關;而NaCl摻加對光催化降解染料K-GL的影響,可能競爭吸附有關,對降解反應起抑止作用。
[1]陳嬋維,付中田,于洪蕾,等.染料廢水處理技術進展[J].實用技術,2010,10(3):37-40.
[2]Fujishima A,Honda K.Electrochemical photolysis of water at a semiconductor electrode[J].Nature,1972,238:37-38.
[3]陽海,周碩林,尹明亮,等.克百威光催化降解動力學的研究[J].中國環境科學,2013,33(1):82-87.
[4]孫秀云,王連軍,徐林,等.納米二氧化鈦光催化降解斯蒂酚酸影響因素的研究[J].環境工程,2003,21(3):76-78.
[5]孫藝飛,李曉波,關建建,等.TiO2/ACFs催化劑光催化降解染料廢水活性研究[J].環境科學與技術,2012,35(5):102-105.
[6]朱丹,王瑛瑛,廖紹華,等.UV-TiO2-Fenton-活性炭處理敵百蟲農藥廢水的研究[J].云南大學學報,2013,35(1):87-92.
[7]李萱萱.高級氧化技術在處理染料廢水中的應用[J].化工進展,2012,31(s2):219-222.
[8]任南琪,周顯嬌,郭婉茜,等.染料廢水處理技術研究進展[J].化工學報,2013,64(1):84-94.
[9]Geng Qijin,Cui Wenwen.Adsorption and photocatalytic degradation of reactive brilliant Red K-2BP by TiO2/AC in bubbling fluidized bed photocatalytic reactor[J].Ind.Eng.Chem.Res.,2010,49(22):11321-11330.
[10]Al-Rasheed Radwan,Cardin David J.Photocatalytic degradation of humic acid in saline waters.Part 1.Artificial seawater:Influence of TiO2,temperature,pH,and air-flow[J].Chemosphere,2003,51(9):925-933.
[11]Wang Z H,Yuan R X,Guo Y G,et al.Effects of chloride ions on bleaching of azo dyes by Co2+/oxone regent:Kinetic analysis[J].Journal of Hazardous Materials,2011,190(1-3):1083-1087.
[12]Yuan Ruixia,Sadiqua N,Wang Zhaohui,et al.Photocatalytic degradation and chlorination of azo dye in saline wastewater:Kinetics and AOX formation[J].Chemical Engineering Journal,2012,192(1):171-178.

