薯蕷皂苷元對人胃癌BGC-823和SGC-7901細胞生物學行為的影響
吳媛媛,崔國興,馬鐵梁,丁偉良,葛志軍,唐志安
(江蘇大學附屬宜興醫院1.消化內科,2.中心實驗室,3.重癥醫學科,4.中醫科,江蘇宜興214200)
薯蕷皂苷元對人胃癌BGC-823和SGC-7901細胞生物學行為的影響
吳媛媛1,崔國興1,馬鐵梁2,丁偉良2,葛志軍3,唐志安4
(江蘇大學附屬宜興醫院1.消化內科,2.中心實驗室,3.重癥醫學科,4.中醫科,江蘇宜興214200)
目的:觀察薯蕷皂苷元對人胃癌BGC-823和SGC-7901細胞增殖、侵襲、遷移和凋亡過程的影響并探討其機制。方法:采用薯蕷皂苷元處理體外培養的BGC-823和SGC-7901細胞,用MTT法、Transwell實驗檢測細胞的增殖、遷移、侵襲能力。用免疫印跡法檢測BGC-823和SGC-7901細胞中凋亡相關蛋白BAX、凋亡抑制基因Bcl-2和MAPK信號通路的Erk1/2、JNK、p38三個通路中相關蛋白的表達。結果:經薯蕷皂苷元處理后,BGC-823和SGC-7901細胞的增殖、遷移和侵襲能力明顯降低,凋亡相關蛋白BAX明顯升高,Bcl-2的表達明顯降低;p-p38表達水平明顯降低,但JNK、p-JNK、Erk1/2、p-Erk1/2和p38的表達無明顯變化。結論:薯蕷皂苷元可能通過MAPK通路中的p-p38通路影響人胃癌BGC-823和SGC-7901細胞的生物學行為。
薯蕷皂苷元;胃癌細胞;MAPK通路
胃癌發病年齡逐年趨于年輕化,死亡率在全球排第2位,且具有明顯的地域性,中日韓為高發區[1-3]。目前應用中醫藥治療胃癌被廣泛關注,中藥能緩解各種類型胃癌的臨床癥狀,減輕放、化療的不良反應,提高治療率,延長患者的生存時間。MAPK信號通路是常見的細胞增殖、侵襲、遷移和凋亡相關信號轉導通路的匯集點,在造血系統腫瘤、上皮性腫瘤、絨癌等的發生發展中發揮著重要的作用[4-5]。
菝葜,別名金剛藤,菝葜屬,有祛風利濕、消腫解毒、抗炎鎮痛等藥理活性。薯蕷皂苷元是菝葜中主要的活性成分[6-7]。為了解薯蕷皂苷元是否對胃癌細胞的增殖、侵襲、遷移和凋亡能力起作用,并進一步探討這一作用是否與MAPK信號通路有關,我們觀察了薯蕷皂苷元處理后人胃癌BGC-823和SGC-7901細胞增殖、侵襲、遷移和凋亡能力的變化,旨在為胃癌治療尋找不良反應少,具有更好治療效果的天然抗癌植物藥提供線索。
1 材料與方法
1.1 主要材料
人胃癌BGC-823和SGC-7901細胞由南京醫科大學周建偉教授饋贈;胎牛血清購自杭州四季青公司;雙抗(含青霉素10萬U/L、鏈霉素100mg/L的青鏈霉素)購自南通碧云天公司;RPMI 1640培養基(Hyclone公司);Transwell小室、基質膠(美國BD公司);兔抗人JNK、p-JNK、Erk1/2、p-Erk1/2、p38、pp38抗體(美國Cell Signaling公司);兔抗人Bcl-2相關X蛋白(Bcl-2-associated X protein,BAX)和B細胞白血病/淋巴瘤相關蛋白(B cell leukemia/lymphoma 2,Bcl-2)抗體(英國Abcam公司);甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗體購自碧云天公司;薯蕷皂苷元購于Sigma-Aldrich公司(貨號:S8534-25MG)。
1.2 細胞培養
人胃癌BGC-823和SGC-7901細胞,用含10%胎牛血清和雙抗(含青霉素10萬U/L、鏈霉素100 mg/L的青鏈霉素)的RPMI 1640培養基置于37℃、5%CO2、飽和濕度的培養箱中培養,胰酶消化傳代。
1.3 MTT法檢測兩種胃癌細胞增殖能力
取對數生長期的細胞,用0.25%胰蛋白酶消化,將細胞以1×105/孔的密度接種于96孔板,每孔設5個復孔,等貼壁后,加入質量濃度分別為6.25、12.5、25、50μg/mL的薯蕷皂苷元(藥物組),并設陰性對照組(只有培養液,無薯蕷皂苷元),分別培養24、48、72 h,開始MTT反應,570 nm波長下檢測光密度(D)值。根據D值繪制細胞生長曲線,比較處理前后細胞生長速度的變化。
1.4 Transwell侵襲實驗檢測細胞侵襲和遷移力
在24孔板的Transwell小室加基質膠100μL,鋪于培養小室濾膜上制作人工基底膜(無基底膜測遷移能力,有基底膜測侵襲能力),將100μL密度為2×105/mL的細胞懸液加入上室,600μL含體積分數為10%胎牛血清的RPMI1640培養基加入下室。培養箱中分別孵育24、48、72 h后進行Giemsa染色,200倍光鏡下隨機選擇9個視野計數穿膜細胞數。
1.5 蛋白質印跡法檢測凋亡及MAPK信號通路代表性蛋白的表達
取對數生長期細胞,用0.25%胰蛋白酶消化,將細胞以1×105/孔的密度接種于6孔板。待細胞貼壁后,加入薯蕷皂苷元使其終質量濃度為50 μg/mL。提取細胞總蛋白,BCA法檢測蛋白濃度,隨后電泳,濕法轉膜,一抗使用BAX、Bcl-2、Erk1/2、JNK、p38、p-Erk1/2,p-JNK,p-p38抗體,二抗使用AP標記的堿性磷酸酶,ECL顯影,底片掃描儀拍照。
1.6 統計學方法
2 結果
2.1 薯蕷皂苷元對胃癌細胞增殖能力的影響
薯蕷皂苷元作用于BGC-823和SGC-7901細胞24、48、72 h后,用MTT法檢測細胞增殖能力。從圖1可見,隨薯蕷皂苷元質量濃度的增大,細胞增殖能力逐漸下降,差異有統計學意義(P<0.05),但各時間點間差異無統計學意義。
2.2 薯蕷皂苷元對胃癌BGC-823和SGC-7901細胞遷移和侵襲能力的影響
Transwell實驗結果顯示,經50μg/mL薯蕷皂苷元處理后,藥物組胃癌BGC-823和SGC-7901細胞穿膜細胞數明顯減少,即遷移及侵襲能力明顯降低,與陰性對照組比較,差異均有統計學意義(P<0.05,圖2)。
2.3 薯蕷皂苷元對胃癌細胞凋亡相關蛋白表達的影響
薯蕷皂苷元處理胃癌BGC-823和SGC-7901細胞后,蛋白質印跡法檢測結果發現,薯蕷皂苷元處理后的BGC-823和SGC-7901細胞的BAX蛋白表達明顯增強(P<0.01),而Bcl-2蛋白的表達明顯降低,差異具有統計學意義(P<0.05)。見圖3。
2.4 MAPK 3條通路代表性蛋白磷酸化和非磷酸化的表達
對MAPK 3條通路的代表性蛋白進行免疫印跡分析,結果發現經薯蕷皂苷元處理后,兩種胃癌細胞中p-p38的表達明顯下降(P<0.05,圖4),而其非磷酸化水平(p38)無明顯變化,且其他兩條通路JNK和Erk1/2以及磷酸化的JNK和Erk1/2亦無明顯變化(圖4)。
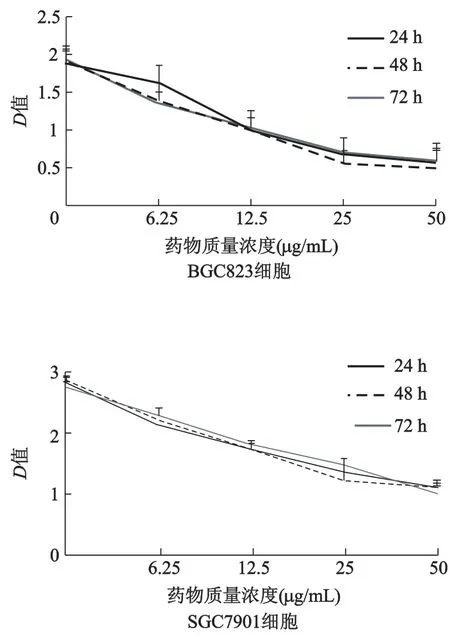
圖1 不同質量濃度薯蕷皂苷元處理后BGC-823和SGC-7901細胞的生長曲線
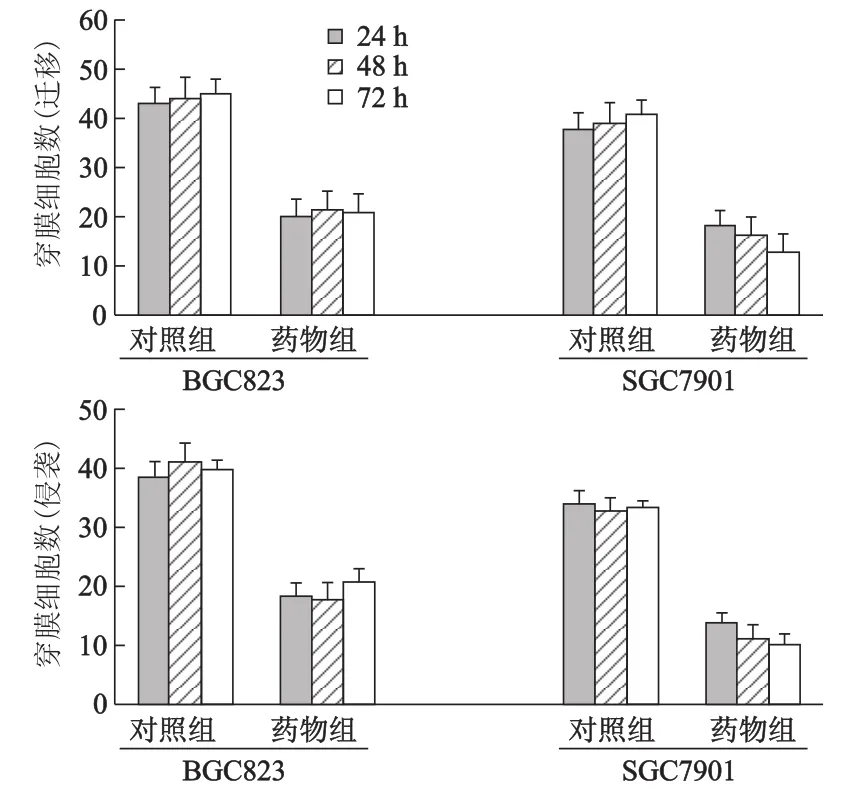
圖2 薯蕷皂苷元對BGC-823和SGC-7901細胞遷移和侵襲的影響
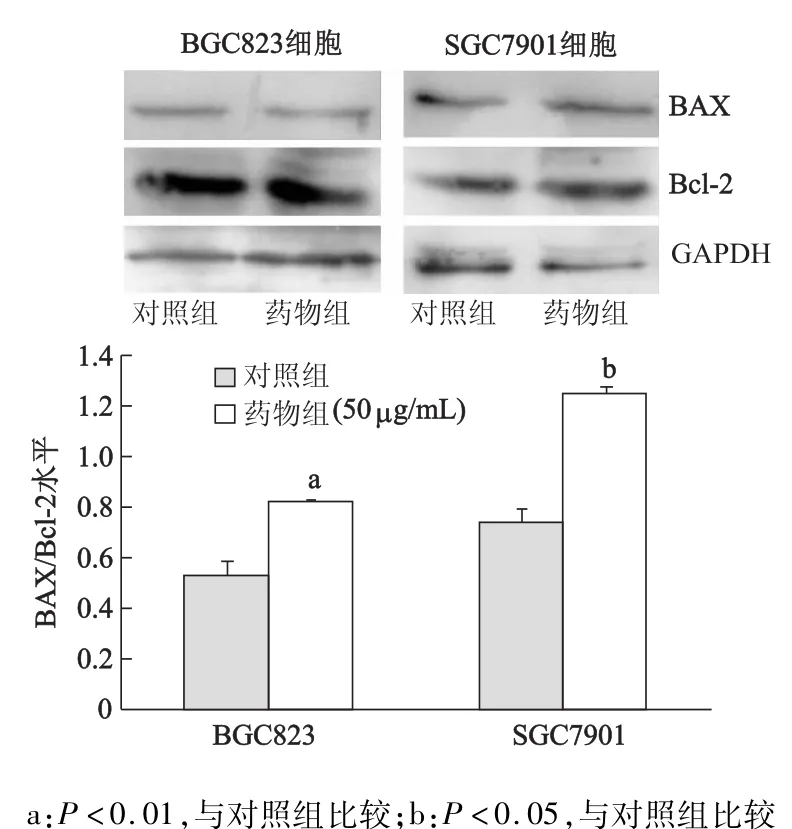
圖3 薯蕷皂苷元處理后BGC-823和SGC-7901細胞BAX蛋白和Bcl-2蛋白的表達
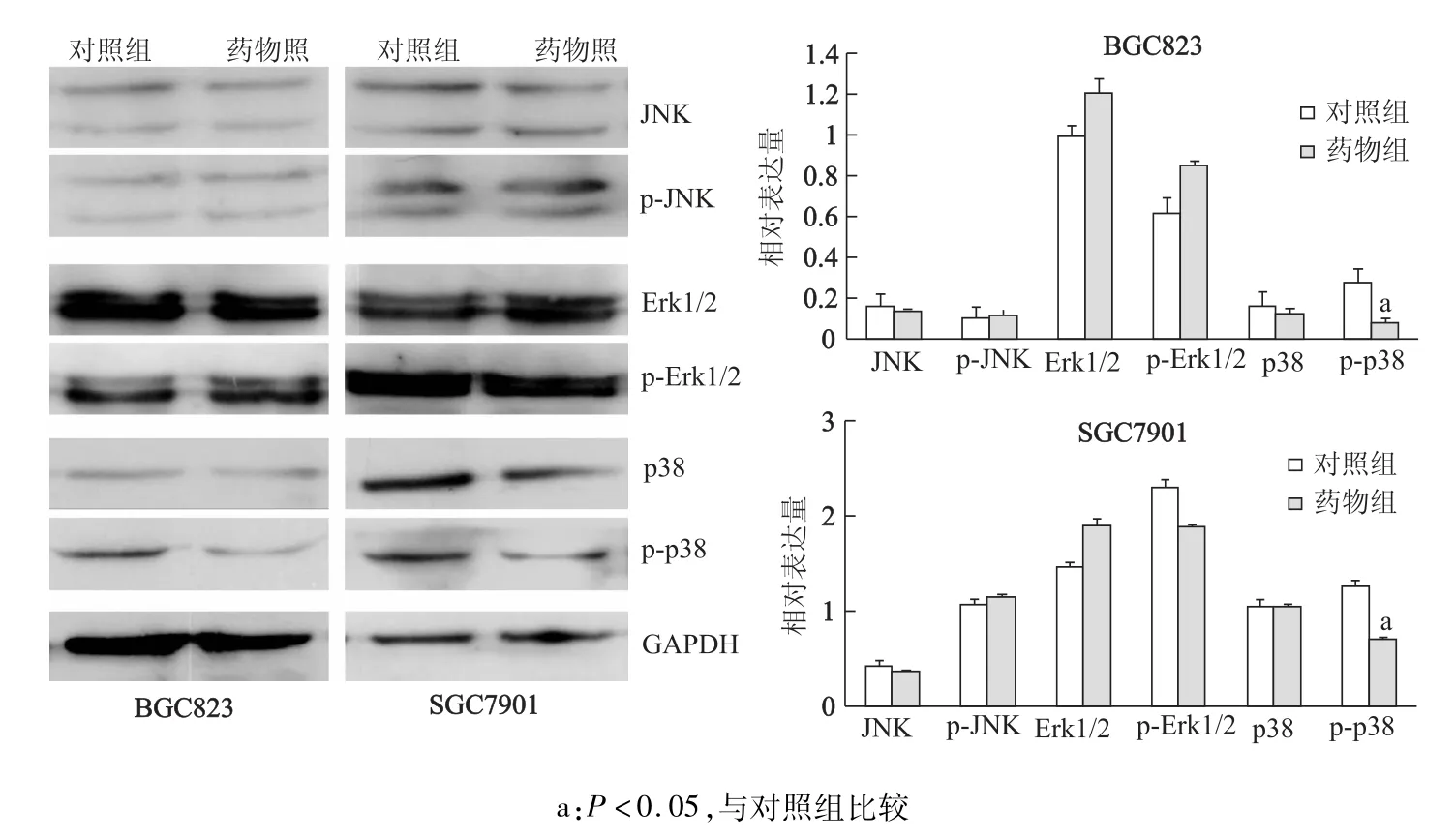
圖4 薯蕷皂苷元處理后MAPK通路中各通路蛋白表達水平
3 討論
薯蕷皂苷元等中藥提取物已廣泛應用于婦科慢性炎癥的治療以及調節免疫、活血化瘀、抗腫瘤等[8-11]。本實驗使用薯蕷皂苷元對胃癌細胞進行處理,發現其對胃癌細胞的增殖、凋亡、遷移、侵襲能力有一定的影響。
研究發現薯蕷皂苷元有抗腫瘤活性,對肝癌SMMC-7721、胃腺癌MGC-803、人宮頸癌HeLa細胞的抑制作用強于長春新堿(VCR)[12]。另外,有研究發現其對胃癌BGC-823細胞的增殖有抑制作用,并可誘導細胞凋亡[13]。我們的實驗結果同樣顯示薯蕷皂苷元對BGC-823和SGC-7901細胞有相似的影響。
MAPK信號通路與腫瘤細胞的增殖、侵襲、遷移和凋亡密切相關,對腫瘤的生長增殖起至關重要的作用[14]。在真核細胞中,主要有Erk1/2、JNK、p38等通路,調節細胞增殖、分化、發育、凋亡及炎癥反應等[15]。實驗表明,抑制p38或ERK1/2均可抑制胃癌MGC-803細胞的體外生長與遷徙[16]。另外p38信號傳導通路參與胃癌的發生,而且其表達水平還與胃癌的惡性程度呈正相關[17-18]。使用MEK抑制劑PD98059可以抑制肝癌細胞Ras-MAPK信號轉導[19]。在薯蕷皂苷元處理后的食管癌細胞中,pp38蛋白的表達水平明顯降低[20]。本研究中薯蕷皂苷元處理后的胃癌細胞中,p-p38蛋白表達水平明顯降低,而p38和其他兩條通路JNK和Erk1/2的表達無明顯變化,提示在胃癌中,薯蕷皂苷元可能通過p38通路的磷酸化激活起作用,從而調節BGC-823和SGC-7901細胞的增殖、凋亡、遷移和侵襲。
綜上所述,薯蕷皂苷元在胃癌BGC-823和SGC-7901細胞的增殖、凋亡、遷移和侵襲過程中可能是通過p38通路起作用。這將為尋找新的治療胃癌的天然抗癌藥提供一定的線索。
[1] 周云,趙丹.胃癌內科治療現狀[J].鄭州大學學報:醫學版,2009,44(5):938-942.
[2] 秦叔逵,龔新雷.晚期胃癌化療的現狀和新進展[J].臨床腫瘤學雜志,2006,11(9):641-652.
[3] 孫秀娣,牧人,周有尚,等.中國胃癌死亡率20年變化情況分析及其發展趨勢預測[J].中華腫瘤雜志,2004,26(1):4-9.
[4] Kyriakis JM,Avruch J.Sounding the alarm:Protein kinase cascades activated by stress and inflammation[J].J Biol Chem,1996,271(40):24313-24316.
[5] Zhang XQ,Zhao XS,Pang ZJ,etal.Role of p38 pathway in PMA-induced in vitro invasion of JAR human choriocarcinoma cell line[J].Di Yi Jun Yi Da Xue Xue Bao,2003,23(8):792-794.
[6] 聶凌,鴻林淑,英寧正.薯蕷屬植物中薯蕷皂苷元的研究進展[J].中國生化藥物雜志,2004,25(5):318-320.
[7] 張蓮萍,于國平,劉焱文.不同產地菝葜不同部位薯蕷皂苷元的含量比較[J].湖北中醫學院學報,2007,9(3):50-51.
[8] 陳東生,呂永寧,王杰.菝葜的抗炎作用[J].中國醫院藥學雜志,2000,20(9):544-545.
[9] 呂永寧,陳東生,付磊,等.菝葜三種提取物活血化瘀藥理作用研究[J].中國藥科大學學報,2001,32(6):448-450.
[10] 陳東生,華小黎.菝葜的研究現狀[J].中藥材,2006,29(1):90-93.
[11] 文朝陽,豐平,丁相海,等.復方菝葜抑瘤機理的實驗研究[J].北京中醫,2001(4):44-45.
[12] 李忌,陳俊杰,巨勇,等.天然甾體皂苷化合物的抗腫瘤活性[J].天然產物研究與開發,1996,11(1):14-17.
[13] 廖子君,張曉明,郭亞煥,等.菝葜皂苷元對胃癌BGC-823細胞增殖、凋亡影響的實驗研究[J].現代腫瘤醫學,2010,18(6):1085-1087.
[14] Johnson GL,Lapadat R.Mitogen-activated protein kinase pathwaysmediated by ERK,JNK,and p38 protein kinases[J].Science,2002,298(5600):1911-1912.
[15] Lawrence MC,Jivan A,Shao C,et al.The roles of MAPKs in disease[J].Cell Res,2008,18(4):436-442.
[16] 宋婷閣,擺茹,黃菱,等.抑制MAPK信號通路對胃癌細胞MGC-803生長遷徙的影響[J].寧夏醫科大學學報,2013,35(6):631-634.
[17] 鄧立力,鄧洪濱,呂慧芳,等.STAT3和p38在胃癌組織中的表達及意義[J].中國腫瘤臨床,2008,35(4):202-205.
[18] 費正華,姜藻.蛋白酶體抑制劑DCI對胃癌細胞P38α信號的調節[J].實用醫學雜志,2008,22(4):322-325.
[19] 宋霆婷,姜玉華,李妙玉,等.PD98059對肝癌細胞Ras-MAPK信號轉導的作用[J].實用醫學雜志,2005,21(5):446-448.
[20] 林杰,談永飛,馬鐵梁,等.薯蕷皂苷元通過MAPK通路對食管癌細胞Eca109的調控[J].世界華人消化雜志,2013,21(35):3977-3982.
Diosgenin affect human gastric cancer BGC-823 and SGC-7901 cells through MAPK pathways
WU Yuan-yuan1,CUIGuo-xing1,MA Tie-liang2,DINGWei-liang2,GE Zhi-jun3,TANG Zhi-an4
(1.Department of Gastroenterology,2.Central Laboratory,3.Department of Critical Care Medicine,4.Department of Traditional Chinese Medicine,the Affiliated Yixing Hospital of Jiangsu University,Yixing Jiangsu 214200,China)
Objective:To discuss the role of diosgenin in the proliferation,invasion,migration and apoptosis of human gastric cancer BGC-823 and SGC-7901 cells via MAPK signaling pathways.M ethods:Human gastric cancer cell lines BGC-823 and SGC-7901 were cultured in vitro and treated with diosgenin.Proliferation rate,cellmigration and invasion weremeasured by MTTmethod via Transwell assay.And protein expression of apoptosis-associated protein(AAP)BAX,apoptosis inhibitor protein Bcl-2 and Erk1/2,JNK and p38 proteins of MAPK pathways were measured by Western Blot.Results:When BGC-823 and SGC-7901 cellswere treated with diosgenin,the proliferation,migration and invasion of BGC-823 and SGC-7901 cellswere significantly decreased.The apoptosis of both cellswas enhanced to a certain extent.As to the correlation of gastric cancer cells and MAPK pathways,we found that p-p38 protein expression level after diosgenin treated was dramatically down-regulated;however,the expression levels of Erk1/2,JNK,p38,p-Erk1/2 and p-JNK were negligible.Conclusion:Diosgenin might affect the proliferation,invasion,migration and apoptosis of human gastric cancer BGC-823 and SGC-7901 cells through p-p38 ofMAPK pathways.
diosgenin;gastric cancer cells;MAPK pathways
R541.75
A
1671-7783(2014)03-0207-04
10.13312/j.issn.1671-7783.y140037
吳媛媛(1986—),女,江蘇宜興人,醫師,主要從事胃腸腫瘤研究。
2014-02-27 [編輯] 陳海林

