茶多酚對人結腸癌細胞株Caco-2凋亡及RhoA蛋白活性的影響
董麗華, 朱 旭, 姜仕柱, 李琪毅
(1. 三峽大學仁和醫院 消化內科, 湖北 宜昌, 443001; 2. 重慶市渝北區人民醫院 外二科, 重慶, 401120)
結腸癌是消化系統常見的惡性腫瘤之一,其早期確診率不高,被發現時大多已經出現肝、肺、骨等全身轉移。手術切除是治療結腸癌的主要方法,但術后約70%的患者遠期生存率不高。結腸癌細胞株Caco-2在結腸癌組織中表達較高,且具有較的強轉移能力[1]。研究[2]報道,RhoA蛋白活性增強可以促進腫瘤轉移的發生。茶多酚是茶葉的主要成分,具有很強的抗氧化功能和調控致癌因子,對腫瘤形成的各個階段都有預防和抑制作用[3]。本實驗通過探討茶多酚對人結腸癌細胞株Caco-2凋亡及RhoA蛋白活性的影響,以期為結腸癌的早期診斷及治療提供理論依據。
1 材料與方法
1.1 主要試劑
人結腸癌細胞株Caco-2(美國ATCC公司),98%的茶多酚(湖南綠蔓生物科技有限公司),DMEM血清及四甲基偶氮唑藍(MTT)(上海實生細胞生物技術有限公司),碘化丙啶(南京大治生物科技有限公司),DMEM培養基及胰蛋白酶(Gibco公司),RhoA活性測定試劑盒(Cytoskeleton公司),凝膠電泳儀(美國Bio-RAD公司)。
1.2 方法
1.2.1 人結腸癌細胞株Caco-2培養與分組:取出凍存的人結腸癌細胞株Caco-2細胞,快速解凍,加入DMEM培養基,取對數生長期的Caco-2細胞,加入磷酸鹽緩沖液(PBS)漂洗,胰蛋白酶消化。混勻后離心,懸浮后移入培養瓶,臺盼藍染色細胞計數,接種后常規培養。培養至對數生長期再傳代后,分為實驗組和對照組。實驗組分4組,分別加入濃度為25、50、100及200 μmol/L的茶多酚,對照組加入等體積的RPMI-1640培養液,分別培養12、24、36、48及72 h后檢測。
1.2.2 形態學觀察:光鏡及HE鏡下觀察生長狀態良好的細胞和加入茶多酚后細胞的不同形態。
1.2.3 MTT法測定不同濃度茶多酚在不同作用時間對結腸癌細胞株Caco-2增殖的影響:取對數生長期細胞,以1×104/mL的密度接種于96孔培養板,移入恒溫細胞培養箱中,使其貼壁生長,分別用不同濃度的茶多酚(25、50、100和200 μmol/L)處理細胞12、24、36、48及72 h。上機前4 h培養板每孔加入MTT 20 μL, 然后棄去孔內液體,每孔加入150 μL DMSO,振蕩10 min,使結晶物充分溶解,終止培養;選擇490~570 nm波長處,在酶聯免疫檢測儀上測定各孔光吸收值并記錄結果。以不同時間為橫坐標,以(1-實驗組光吸收值/對照組光吸收值)作為縱坐標,繪制腫瘤細胞的生長抑制曲線,計算細胞增殖抑制率(IR), IR=(1-實驗組A值/對照組A值)×100%。
1.2.4 流式細胞術(FCM)檢測細胞凋亡指數:將Caco-2細胞培養于6孔板,加入10%小牛血清和DMEM高糖培養基,置于37 ℃、5% CO2培養箱中培養。孵育24 h后加入茶多酚,濃度分別為25、50、100及200 μmol/L; 另設對照組。加藥48 h后,細胞作FCM樣品制備,分別收集各組細胞,用預冷的70%乙醇固定24 h; 檢測前細胞懸液用0.01 mmoL PBS洗滌2次,棄上清液;細胞沉淀中加入150 μL RNA酶A(0.1 mg/mL), 重懸細胞, 4 ℃避光孵育30 min;再加入120 μL PI染液至終濃度為0.1 mg/mL, 混勻, 4 ℃避光孵育10 min; 將細胞懸液混勻,用200目尼龍膜過濾細胞到流式細胞管,以去除細胞團塊,上機檢測。
1.2.5 人結腸癌Caco-2 DNA的提取:取對數期生長的Caco-2細胞,以1×104/mL密度接種于6孔板中培養,24 h后分別加入等量生理鹽水和25、50、100及200 μmol/L濃度的茶多酚溶液,培養24 h后離心,加入200 μL細胞裂解液,重懸細胞后至濃度為100 μg/mL。60 ℃水浴4 h后,離心,取上清液,加入酚:氯仿:異戊醇500 μL;再離心,取上清液,加入2倍體積無水酒精,混勻,出現白色絮狀物即為DNA,離心、沉淀、溶解于無菌純水中,備用。
1.2.6 瓊脂糖凝膠電泳:取10 μL備用的Caco-2 DNA,加入6×上樣緩沖液,混勻后加到新鮮配制的2%瓊脂糖凝膠點樣孔中,在90 V/h電壓中電泳、拍照。
1.2.7 RhoA活性測定:采用Pull-down方法,按照RhoA活性測定試劑盒說明,按1∶500抗RhoA抗體應用Wsetern blot方法檢測5組不同處理Caco-2細胞的總RhoA及RhoA蛋白。
2 結 果
2.1 不同濃度茶多酚在不同作用時間對結腸癌細胞株Caco-2增殖的影響
分別培養12、24、36、48和72 h后,50、100及200 μmol/L濃度組的細胞增殖活A值明顯低于對照組,差異有統計學意義(P<0.05); 25 μmol/L濃度組在培養24 h后細胞增殖活A值亦明顯低于對照組,差異有統計學意義(P<0.05), 說明茶多酚對Caco-2細胞有抑制作用,且隨著藥物濃度的升高,對Caco-2細胞增殖抑制作用逐漸增強,見表1; 不同濃度組細胞生長抑制率隨著時間的延長有升高趨勢,見圖1。
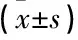
表1 不同濃度茶多酚在不同作用時間對結腸癌細胞株Caco-2增殖的影響
與對照組比較,*P<0.05。
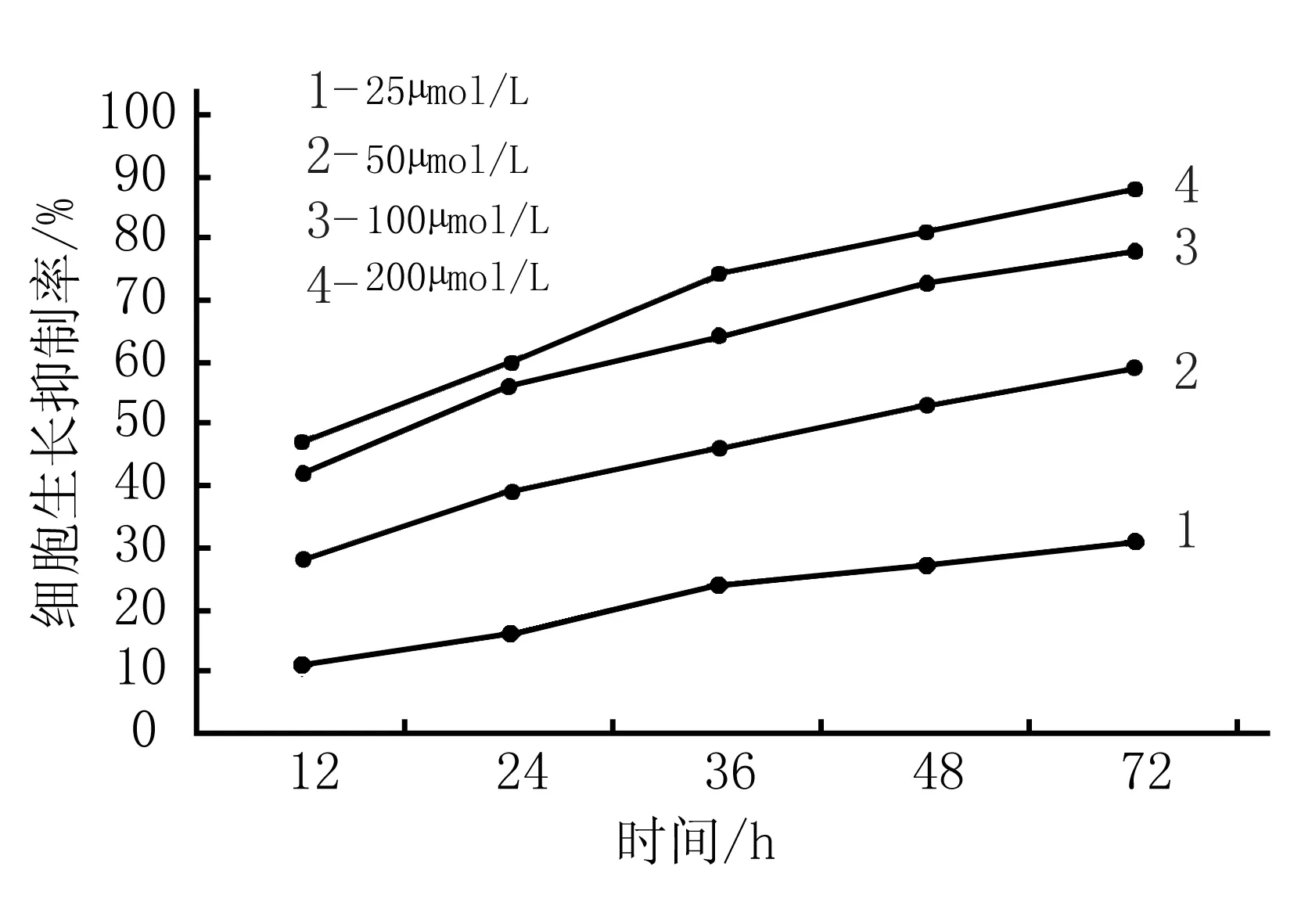
圖1 不同濃度組細胞生長抑制率隨時間的變化
2.2 FCM檢測細胞凋亡指數
Caco-2細胞與茶多酚共同孵育24 h后,隨著藥物濃度的增加,細胞凋亡指數亦增高。25、50、100和200 μmol/L濃度組的細胞凋亡指數分別為(26.31±1.49)%、(45.22±1.32)%、(66.14±1.62)%和(75.32±1.64)%, 均明顯高于對照組(5.12±1.15)%(P<0.01)。
2.3 茶多酚對人結腸癌Caco-2細胞DNA的影響
提取人結腸癌Caco-2細胞DNA, 進行瓊脂凝膠電泳,由于細胞凋亡程度不同,因此在電泳時凋亡細胞的DNA條帶表現呈彌散狀分布及梯狀條帶,被認為是典型的凋亡指標,說明茶多酚能促進人結腸癌細胞株Caco-2的凋亡,且隨著濃度的增加對細胞生長抑制增加(圖2)。

DNA電泳條帶從左到右依次為DNA Marker、25、50、100及200 μmol/L
2.4 RhoA蛋白活性檢測結果
各組細胞均在相對分子質量為30 000處可見1條與RhoA相符的清晰條帶,每組細胞均包括RhoA蛋白及活性RhoA蛋白2個條帶,各組間RhoA總蛋白表達無差別,但與對照組比較,其活性RhoA蛋白水平下調。通過對總RhoA表達量來校正,以活性RhoA與總RhoA比值進行分析,差異有統計學意義(P<0.05)。見圖3。
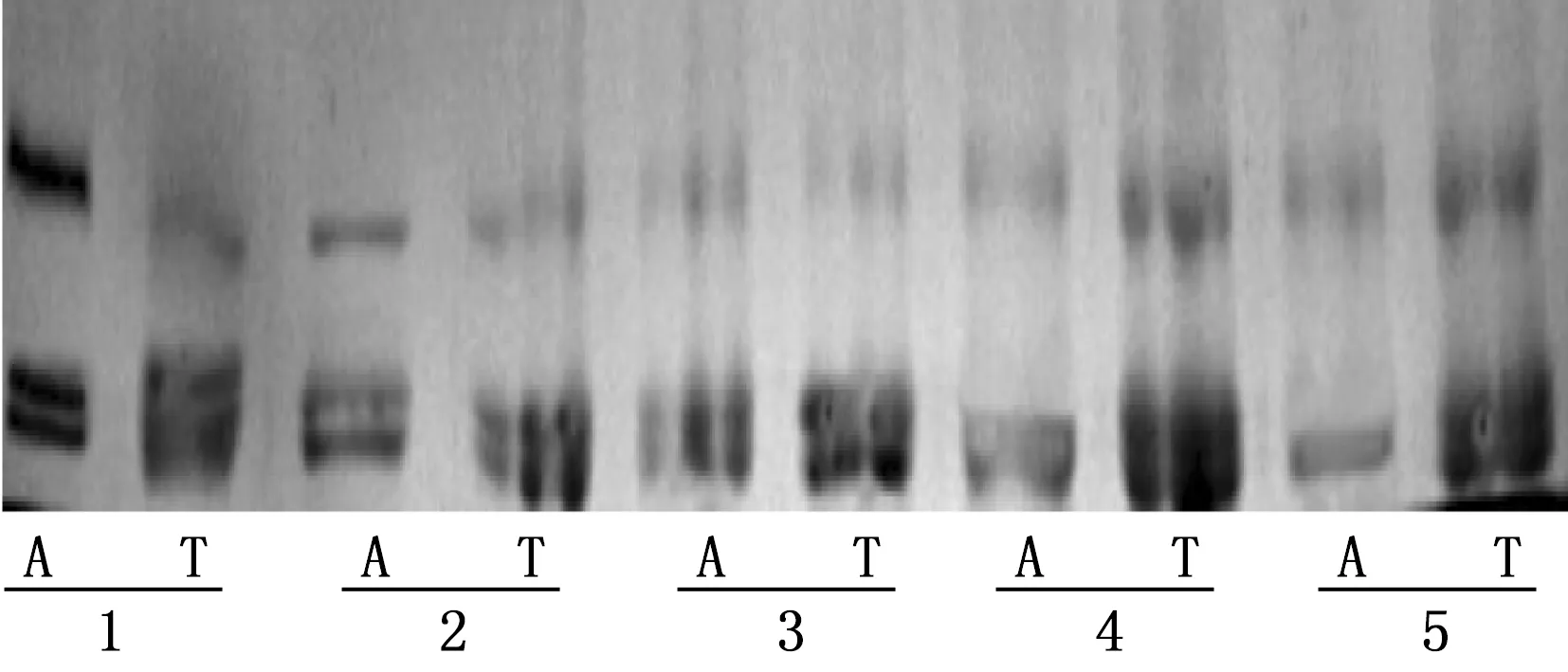
1. 對照組; 2. 25 μmol/L組; 3. 50 μmol/L組; 4. 100 μmol/L組; 5. 200 μmol/L組; A. 活性RhoA蛋白; T. 總RhoA蛋白
3 討 論
茶多酚具有抗氧化、清除自由基、調節致癌因子及抑制腫瘤血管生成等作用,能夠預防和治療多種腫瘤[4],但其抗癌機制尚不明確。Wang等[5]研究發現,茶多酚可顯著降低荷瘤小鼠血清丙二醛(MDA)含量,提高超氧化物歧化酶(SOD)和谷胱甘肽過氧化物酶的活性,提示茶多酚可通過增強體內抗氧化酶的活性、抑制脂質過氧化反應而產生抗癌作用。Caco-2細胞來源于人結腸癌上皮細胞,能分化形成具有小腸上皮細胞微絨毛結構,表達多種蛋白載體和酶,在結腸癌轉移的組織中,其表達增高,并且在轉移的過程中,發揮著重要的作用。Li等[6]研究表明,抑制結腸癌細胞株Caco-2活性,促進其凋亡,可抑制結腸癌細胞的轉移。Shimizu等[7]研究表明,茶多酚復合體及主要兒茶素單體對氧自由基的消除率達98%以上,在一定范圍內呈量效關系。徐靜等[8]研究表明,結腸癌細胞株Caco-2凋亡,與誘導劑(熊去鵝膽酸)濃度及時間呈正向相關性。Singh等[9]對茶多酚通過Fas相關死亡域蛋白(FADD)依賴方式介導細胞凋亡進行了實驗研究,發現不同濃度的茶多酚能誘導 DNA 片段化,并與劑量相關;高濃度的茶多酚(>800 mg/mL)能夠導致腫瘤細胞凋亡和細胞溶解。
本實驗發現,茶多酚和Caco-2細胞共孵育12 h后,50、100和200 μmol/L濃度組的細胞增殖活A值分別為(0.1052±0.0192)、(0.0975±0.0154)和(0.0912±0.0134), 明顯低于對照組(0.01239±0.0154); 25 μmol/L濃度組在培養24 h后比較,細胞增殖活A值為(0.1072±0.0124), 亦明顯低于對照組(0.1236±0.0146); 隨著作用時間的延長,各藥物濃度組細胞增殖活性呈降低趨勢,說明茶多酚能有效抑制結腸癌細胞Caco-2增殖,且具有時間和濃度依賴性。
GU等[10]研究發現,結腸癌中RhoA活性增加與腫瘤淋巴結轉移有關。RhoA屬于Rho家族蛋白的Rho亞家族成員,與Ras蛋白相同,是重要的細胞內信號分子,可通過多種信號途徑參與調節細胞的生長、凋亡和細胞周期。Yang等[11]通過RNAi技術沉默RhoA的表達,抑制體內結腸直腸癌細胞的生長。Wang等[12]研究表明, RhoA可以調節多種轉錄因子的活性,是改變細胞骨架組裝,調控細胞遷移,參與腫瘤轉移的關鍵因子,同時還可促進腫瘤血管的生成。王德盛等[13]應用siRNA于血管內皮細胞,發現RhoA在mRNA和蛋白水平均下調,凋亡細胞上升4倍,內皮細胞生長被強烈抑制,且內皮細胞的遷移能力被抑制,并有劑量依賴效應,內皮細胞的乳頭狀腔管形成能力也下降。此外,大量體外研究[14-16]發現,RhoA參與腫瘤細胞的黏附、收縮和移動、黏附結合的解除、基質的降解及對血管和淋巴脈管系統侵入等過程的調控,涉及腫瘤侵襲和轉移的各個環節中。本實驗中提取人結腸癌Caco-2 細胞DNA, 進行瓊脂凝膠電泳,結果顯示凋亡的Caco-2細胞DNA條帶表現呈彌散狀分布及梯狀條帶,進一步行RhoA蛋白活性檢測,結果顯示濃度組間RhoA總蛋白表達無差別,但與對照組比較,其活性RhoA蛋白水平下調,提示通過利用茶多酚抑制Caco-2細胞中RhoA表達,可以抑制腫瘤細胞的生長、增殖,促進腫瘤細胞凋亡。
[1]Da C, Gu Y, Duan W, et al. Silencing Med19 expression on proliferation and apoptosis of colon cancer Caco-2 cells[J]. Chin J Cancer Biother, 2013, 20(2): 177.
[2]Yang K Y, Chen D J, Li X R , et al. Inhibitory effect of RhoA gene silencing on growth of LoVo colon cancer cells in vivo[J]. Chinese Journal of General Surgery, 2011, 20(4): 383.
[3]陳淑珍, 甄永蘇. 茶多酚的分子作用靶點及其在抗腫瘤藥物實驗治療中的作用[J]. 藥學學報, 2013, 48(1): 1.
[4]Chen S Z, Zhen Y S. Molecular targets of tea polyphenols and its roles of anticancer drugs in experimental therapy[J]. Acta Pharmaceutica Sinica, 2013, 48 (1): 1.
[5]Wang J, Chen XY, Hou L, et al. Effects of tea polyphenols on the expression of MMP-2 and TIMP-2 in Lewis lung carcinoma xenografted in C57BL/6 mice[J]. Progress in Modern Biomedicine, 2012, 12(10): 1837.
[6]Li J N, Li X, Qian J M, et al. Effects of K-ras gene mutation on colon cancer cell line caco-2 metastasis by regulating E-cadherin/β-catenin/p120 protein complex formation and RhoA protein activity[J]. Acta academiae medicinae sinicae, 2010, 32(1): 46.
[7]Shimizu M, Adachi S, Masuda M, et al. Cancer chemoprevention with green tea catechins by targeting receptor tyrosine kinases[J]. Mol Nutr Food Res, 2011, 55(6): 832.
[8]徐靜, 楊大明, 沈琴, 等. 熊去氧膽酸對結腸癌細胞株Caco-2增殖及凋亡的影響[J]. 江蘇醫藥, 2008, 6(34): 614.
[9]Singh B N, Shankar S, Srivastava R K. Green tea catechin, epigallocatechin-3-gallate (EGCG): mechanisms, perspectives and clinical applications[J]. Biochem Pharmacol, 2011, 82(12): 1807.
[10]Gu Y, Yang Y, Duan W, et al. Expression and prognostic significance of RhoA in gastric cancer cell nucleus[J]. China Cancer, 2012, 21(3): 230.
[11]Yang W, Kang J, Wang X, et al. Comparison between lentivirus and plasmid as shRNA vector targeting RhoA gene of ovary cancer cell line HO8910[J]. Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi, 2013, 29(5): 473.
[12]Wang H, Zhao G, Liu X, et al. Silencing of RhoA and RhoC expression by RNA interference suppresses human colorectal carcinoma growth in vivo[J]. J Exp Clin Cancer Res, 2010, 29: 123.
[13]王德盛, 何勇, 孫偉, 等. RNAi對肝癌細胞RhoA基因表達和侵襲轉移影響的研究[J]. 中華腫瘤防治雜志, 2011, 18(14): 1061.
[14]Zhao G, Liu W H, Wang T, et al. Small interfering RNA-mediated RhoA silencing optimizes the culture of fetal liver stem cells[J]. Zhongguo Zuzhi Gongcheng Yanjiu, 2012, 16(10): 1803.
[15]Wang B Q, Wang D, Zhang J J, et al. Zhongguo Zuzhi Gongcheng Yanjiu yu Linchuang Kangfu, 2011, 15(10): 1832.
[16]Xu X T, Song Q B, Yao Y, et al. Inhibition of RhoA/ROCK signaling pathway promotes the apoptosis of gastric cancer cells[J]. Hepatogastroenterology. 2012, 59(120): 2523.

