Nicastrin在阿爾茨海默病轉基因小鼠腦內星形膠質細胞中的表達
邱榮暉, 林 仁, 趙小貞, 王 瑋, 朱元貴
阿爾茨海默病(Alzheimer’s disease, AD)發病機制目前尚未明確。其中,β-淀粉樣蛋白(β-amyloid, Aβ)的毒性學說是其重要的發病機制之一。當Aβ沉積在神經元或血管時,其毒性可促使神經元變性或凋亡,導致腦血管淀粉樣變性或老年斑的發生,引起神經元或突觸損傷等一系列AD的病理變化。Aβ由β淀粉樣前體蛋白(amyloid precursor protein, APP)通過β分泌酶和γ分泌酶切割產生。單過性跨膜蛋白(Nicastrin,NCT)是γ分泌酶復合體的重要亞基,參與γ-分泌酶的組裝及穩定[1-2]。過度表達的Nicastrin增加Aβ生成,但并不增強γ-分泌酶的切割活性[3]。神經膠質細胞已被證實參與AD的發病過程。異常Aβ的聚集可激活星形膠質細胞,而激活的星形膠質細胞反過來促進Aβ的沉積,從而形成惡性循環[4]。Aβ是通過神經元的毒性作用間接影響星形膠質細胞,或是APP經γ-分泌酶切割形成的Aβ直接影響星形膠質細胞,目前尚不明確。本研究擬應用形態學研究方法,以同窩5×FAD轉基因小鼠為研究對象,觀察NCT及Aβ在星形膠質細胞中的分布與表達,探討其在AD發病機制中的作用。
1 材料與方法
1.1動物及試劑 同窩七月齡雌性小鼠7只(美國Mary Jo Lad教授惠贈),體質量(40±3)g,經RT-PCR基因型鑒定APPK70N/M671L(Swedish)+I716V(Florida) +V717I(London)+PS1M146L+L286V(即5×FAD,由福建醫科大學附屬協和醫院神經內科曾玉琦博士完成),其中野生型小鼠3只,突變型4只。一抗:Guinea Pig anti-Nicastrin(加拿大Chemicon公司);Rabbit Anti-β-Amyloid 1~42(北京博奧森生物技術有限公司);Mouse Anti-GFAP(中國邁新生物公司)。二抗:CY3, Goat anti-Rabbit IgG(中國碧云天公司);CY5, Donkey anti-Guinea Pig IgG(加拿大Chemicon公司);FITC,Goat anti-Mouse IgG(中國碧云天公司)。激光共聚焦顯微鏡(SP5,德國Leica公司)。
1.2方法 小鼠用4%多聚甲醛經左心室灌注固定、取腦、石蠟包埋,10 μm連續冠狀切片。連續切片隔十取一,行Nicastrin(1∶400 PBS稀釋)、Aβ(1∶200 PBS稀釋)和GFAP(1∶100 PBS稀釋)免疫熒光三標染色,以PBS代替一抗為陰性對照;二抗CY3、CY5、FITC均按1∶500 PBS稀釋。應用激光共聚焦顯微鏡分別在CA1、CA3、DG三個腦區中固定選取3個不重疊視野進行拍照后,觀察三者的位置關系,出現黃白色或綠白色視為三者共定位,出現粉紅色或紫色視為NCT、Aβ共定位。應用Leica AF Lite軟件計算熒光值進行半定量分析。應用38×38小格,每小格0.5 cm×0.5 cm的測試網格對GFAP、NCT、Aβ陽性聚集物三者的共定位數行體視學計數。即分別將各腦區不同位置的的照片置于網格底面,計數各共定位的陽性物與網格十字交叉的重疊數量。
1.3統計學處理 所有照片在共聚焦激光掃描顯微鏡相同的條件下獲取。對Aβ、NCT、GFAP測平均熒光強度值和共定位陽性物體視學計數后應用SPSS 17.0統計軟件包行t檢驗分析,P<0.05為差別有統計學意義。
2 結 果
2.1Aβ、NCT、GFAP的位置關系 在野生型和突變型小鼠的CA1、CA3、DG區的錐體細胞層中均可見Aβ在細胞內均勻表達。此外,在突變型CA1和DG區的錐體細胞層周圍或錐體細胞層中,可見較多由Aβ在細胞外聚積成斑塊,在CA3區的斑塊較少。在突變型的上述區域同時可見大小不一的NCT免疫反應陽性物表達,而在野生型中僅可見少量NCT免疫反應陽性物出現。在突變型中大部分Aβ陽性聚集物與NCT和GFAP共定位,在它們周圍有GFAP包繞,且GFAP增多,小部分Aβ陽性聚集物僅與GFAP共存。圍繞Aβ陽性聚集物周圍的GFAP突起向斑塊集中,但Aβ陽性反應物聚集處突起減少或消失。另外,可見部分NCT陽性反應物僅與Aβ共表達,部分NCT陽性反應物單獨存在于突變型的上述腦區中(圖1)。
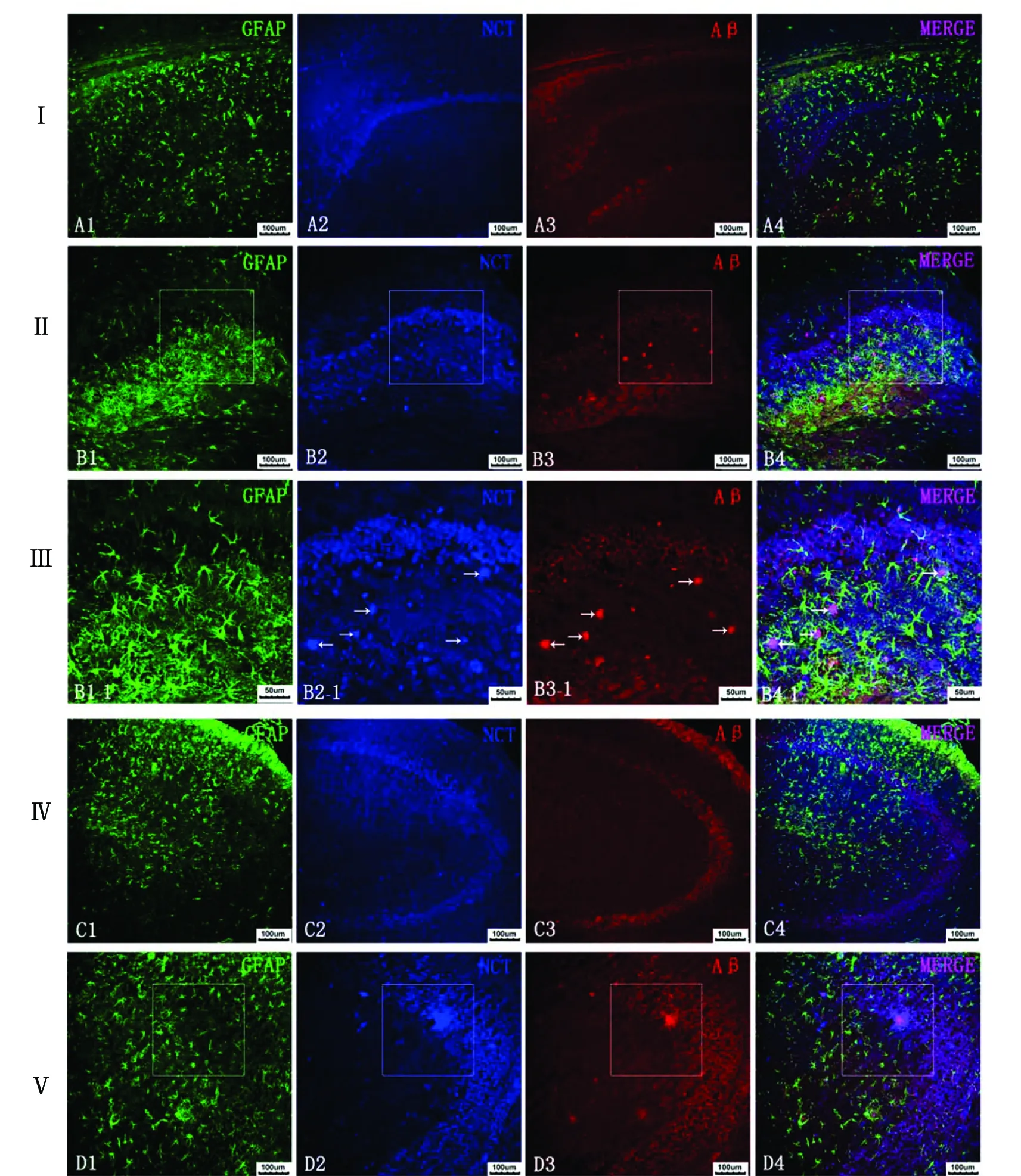
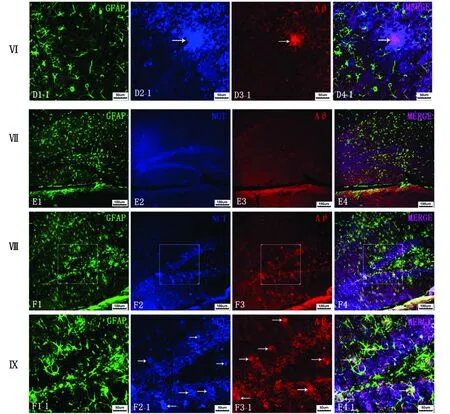
A:野生型小鼠CA1區;B:突變型小鼠CA1區;C:野生型小鼠CA3區;D:突變型小鼠CA3區;E:野生型小鼠DG區;F:突變型小鼠DG區. →:免疫反應陽性物。Ⅰ,Ⅱ,Ⅳ,Ⅴ,Ⅶ,Ⅷ:bar=100 μm,Ⅲ,Ⅵ,Ⅸ:bar=50 μm.
2.2Aβ、Nicastrin、星形膠質細胞在野生型小鼠與突變型小鼠海馬區的分布差異 分別對野生型和突變型CA1、CA3、DG腦區中的Aβ、Nicastrin、星形膠質細胞熒光半定量后,行組間t檢驗分析。CA1區的t值分別為-3.837,-2.367,-3.413;CA3區的t值分別為-2.291,-6.150,-3.539;DG區t值分別為-3.769,-7.698,-3.616,差別均有統計學意義(P<0.05,圖2);突變型各腦區中Aβ、Nicastrin、星形膠質細胞的熒光強度均大于野生型海馬相應區域。
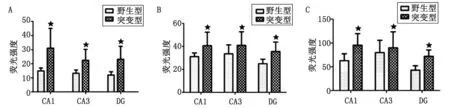
CA1:小鼠海馬第一亞區;CA3:第三亞區;DG:齒狀回. A:膠質纖維酸性蛋白; B:β-淀粉樣變; C:單過性跨膜蛋白. 與野生型小鼠比較,★:P<0.05.
2.3野生型與突變型小鼠海馬中NCT、GFAP和Aβ共表達量差異 在突變型小鼠CA1、CA3和DG均可見NCT、GFAP和Aβ三者的免疫反應陽性物共定位。野生型中偶爾可見上述三者共定位。經體視學方法分別對2組CA1、DG和CA3三個腦區中共定位的陽性免疫反應物計數后,行組間t檢驗分析。3個腦區的t值分別為-5.478,-4.475,-5.415,差別均有統計學意義(P<0.05,圖3);突變型CA1、DG和CA3中各陽性共定位計數均多于野生型小鼠海馬的各相應腦區。

CA1:小鼠海馬第一亞區;CA3:第三亞區;DG:齒狀回. GFAP:膠質纖維酸性蛋白;Aβ:β-淀粉樣變;NCT:單過性跨膜蛋白. 組間比較,★:P<0.05.
3 討 論
研究表明,星形膠質細胞除了具有與小膠質細胞共同構成神經系統的框架細胞、對神經元營養支持的作用外[5],其在神經突觸發生、突觸調節、突觸可塑性中也發揮重要作用[6],目前GFAP常作為其主要的標記物。另據報道,在AD的發病過程中星形膠質細胞可產生Aβ,且能對細胞外的Aβ進行內化和攝取,從而在Aβ的清除中起到某種作用[7-9]。本實驗可見,突變型小鼠CA1、CA3、DG等腦區的星形膠質細胞標記物GFAP熒光強度增高,且發現有聚集成斑塊的Aβ免疫反應陽性物分布于上述腦區。同時,Aβ免疫反應陽性聚集物周圍星形膠質細胞表達增多且緊密圍繞。此外,突變型小鼠CA1、CA3、DG中NCT表達增多,且部分與Aβ共定位于星形膠質細胞的標記物GFAP中。結合體視學對Aβ、NCT、GFAP陽性物共定位數統計結果,推測在AD轉基因小鼠腦的星形膠質細胞中有γ-分泌酶表達,星形膠質細胞中的Aβ可能是由其中的γ-分泌酶剪切APP形成。但有學者認為,AD時神經元中的Aβ活化星形膠質細胞,活化的星形膠質細胞產生和釋放的神經遞質與毒性代謝產物影響神經元的興奮性,進而促進AD的發展[10]。但據本實驗結果,結合GFAP標記陽性的星形膠質細胞的數量與記憶障礙和神經元減少密切相關的報道[11],可推測AD中星形膠質細胞的損傷可能是由表達于其本身的Aβ的毒性反應和后繼炎性反應引起。損傷后的星形膠質細胞無法保護神經元并使之與Aβ分離,從而促進AD的發展。
參考文獻:
[1] Sesele K,Thanopoulou K,Paouri E,etal. Conditional inactivation of nicastrin restricts amyloid deposition in an Alzheimer’s disease mouse model[J].AgingCell,2013,12(6):1032-1040.
[2] Annaert W,De Strooper B. A cell biological perspective on Alzheimer’s disease[J].AnnuRevCellDevBiol,2002,18:25-51.
[3] DaRocha-Souto B,Scotton T C,Coma M,etal. Brain oligomeric beta-amyloid but not total amyloid plaque burden correlates with neuronal loss and astrocyte inflammatory response in amyloid precursor protein/tau transgenic mice[J].JNeuropatholExpNeurol,2011,70(5):360-376.
[4] Wang S,Li J,Xia W,etal. Marine-derived acidic igosaccharide sugar chain specifically inhibits neuronal cell injury mediated by beta-amyloid-induced astrocyte activationinvitro[J].NeurolRes,2007,29(1):96-102.
[5] Laird F M,Cai H,Savonenko A V,etal. BACE1, a major determinant of selective vulnerability of the brain to amyloid-beta amyloidogenesis, is essential for cognitive, emotional, and synaptic functions[J].JNeurosci,2005,25(50):11693-11709.
[6] Blackburn D,Sargsyan S,Monk P N,etal. Astrocyte function and role in motor neuron disease: a future therapeutic target[J]?Glia,2009,57(12):1251-1264.
[7] Jung E S,An K,Hong H S,etal. Astrocyte-originated ATP protects Abeta(1-42)-induced impairment of synaptic plasticity[J].JNeurosci,2012,32(9):3081-3087.
[8] Ji B,Maeda J,Sawada M,etal. Imaging of peripheral benzodiazepine receptor expression as biomarkers of detrimental versus beneficial glial responses in mouse models of Alzheimer’s and other CNS pathologies[J].JNeurosci,2008,28(47):12255-12267.
[9] Perez S E, Nadeem M, Sadleir K R,etal. Dimebon alters hippocampal amyloid pathology in 3xTg-AD mice[J].IntJPhysiolPathophysiolPharmacol,2012,4(3):115-127.
[10] Scuderi C,Valenza M,Stecca C,etal. Palmitoylethanolamide exerts neuroprotective effects in mixed neuroglial cultures and organotypic hippocampal slices via peroxisome proliferator-activated receptor-alpha[J].JNeuroinflammation,2012,9(9):49-55.
[11] Murphy M P,Das P,Nyborg A C,etal. Overexpression of nicastrin increases Abeta production[J].FASEBJ, 2003,17(9):1138-1140.

