局部血管內低劑量促紅細胞生成素和聯合tPA注射對大鼠腦缺血的影響
王榮亮 趙海蘋 武曉寧 高金環 吉訓明 羅玉敏
(首都醫科大學宣武醫院腦血管病研究室,北京市老年病醫療研究中心,北京100053)
重組組織纖溶酶原激活劑(tissue plasminogen activator,tPA)用于急性缺血性卒中的治療已經持續很多年,但其治療時間窗較短,有腦出血等嚴重合并癥,使其在臨床使用上受到嚴格的限制[1-2]。因此,延長tPA的治療時間窗和減少其引發腦出血的不良反應,擴展tPA在臨床的應用范圍是目前研究的重點。
基礎研究及臨床研究[3-5]表明,重組人類促紅細胞生成素(recombinant human erythropoietin,rhEPO)對缺血性卒中患者有較好的治療效果。然而,rhEPO很難通過血腦脊液屏障(blood brain barrier,BBB),需要大劑量、多次注射才能達到治療效果,但這種方式可因其促紅細胞生成的活性而產生多種不良反應。本課題組之前的研究[6]表明,在rhEPO中增加一個艾滋病病毒(human immunodeficiency virus,HIV)來源的蛋白轉導結構域TAT,在不影響其生物活性的前提下,可以顯著地增加rhEPO跨越BBB的能力,為減少rhEPO的治療劑量提供了新的思路,但通過這種方法構建的融合蛋白(EPO-TAT)在臨床應用中的安全性還有待進一步研究。此外,本研究還發現大鼠腦缺血-再灌注后,通過大腦中動脈局部血管內注射低劑量EPO,可以起到良好的神經保護作用[7],對于卒中患者是一種潛在的治療策略。
研究[8-10]證實,高劑量注射 EPO(2 500~5 000 IU/kg)聯合tPA同時注射,在大腦中動脈閉塞(middle cerebral artery occlusion,MCAO)后表現出很嚴重的不良反應,例如血腦脊液屏障通透性增加、腦出血及死亡。本研究認為這些不良反應與注射EPO的起始時間、劑量和注射方式有關。因此,本文主要研究通過大腦中動脈局部血管內低劑量EPO聯合tPA注射,是否可以減少tPA單獨使用的不良反應及其可能的機制。
1 材料和方法
1.1 動物分組及實驗材料
成年雄性Sprague-Dawley大鼠,體質量280~320 g,購自北京維通利華實驗動物公司〔實驗動物許可證號:SCXK(京)2008-0001〕。實驗所使用的所有動物均經過首都醫科大學宣武醫院實驗動物委員會批準。恒溫條件下飼養,實驗前一晚禁食但不禁水。所有化學試劑購買于美國Sigma公司。rhEPO購于沈陽陽光藥業股份有限公司(沈陽,中國)。實驗前采用數字表法隨機分為5組,每組10只:(1)假手術組;(2)[tPA+NS]2 h組;(3)[tPA+NS]4 h組;(4)[tPA+EPO]2 h組;(5)[tPA+EPO]4 h組。NS代表0.9%(質量分數)氯化鈉注射液,2 h和4 h代表腦缺血時間。
1.2 大鼠腦缺血模型的制作
大鼠腦缺血模型采用血管內線栓模型[11],大鼠稱體質量后用4%恩氟烷誘導麻醉,應用小動物呼吸機及麻醉機,1% ~2%(體積分數)恩氟烷混合70%(體積分數)N2O和30%(體積分數)O2維持麻醉,術中監測肛溫、血糖、血氣及血壓,將各項指標維持在正常范圍。選擇右側大腦中動脈,所應用的線栓(北京沙東生物技術有限公司)頭部直徑為0.38 mm,將其插入頸內動脈,至距頸內動脈和頸外動脈分叉處約1.8~1.9 cm,感覺有明顯阻力后停止。假手術組分離血管,但不插栓。在大鼠腦缺血2 h或4 h后,抽出線栓,大鼠腦血流再灌注。用激光多普勒(Laser Doppler flowmetry,LDF)監測整個手術過程中大鼠腦血流變化情況,以驗證線栓阻斷成功。再灌注即刻,通過尾靜脈注射的方式在30 min內給予tPA(10 mg/mL)和0.9%(質量分數)氯化鈉注射液([tPA+NS]2 h、[tPA+NS]4 h),或通過大腦中動脈注射的方式按照800 IU/kg的劑量在4 min內給予EPO([tPA+EPO]2 h、[tPA+EPO]4 h)。在手術過程中,通過溫控墊將大鼠肛溫維持在(37.0±0.5)℃。實驗進行過程中記錄大鼠的死亡數量。
1.3 腦梗死體積
大鼠腦缺血-再灌注24 h后,取腦組織并切片,用蒸餾水配制的1.5%(質量分數)2,3,5-三苯基氯化四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)染色,計算腦梗死體積及水腫體積。對缺血側腦切片的出血點進行計數,每組累積計算40個腦切片。
1.4 神經功能評分
在大鼠腦缺血-再灌注24 h后行神經功能評價,采用 Ludmila Belayev 12 分評分法[12]:(1)姿勢反射試驗,即提尾懸空試驗:無明顯神經功能缺失為0分,梗死對側肢體屈曲為1分,側推試驗陽性為2分。(2)肢體放置試驗:① 視覺亞實驗,實驗者將動物握于手中,使其前爪懸空,讓動物位于桌子前方,自桌面上方10 cm處向桌面緩慢斜線靠近,大鼠正常反應為前肢即抓向桌面,損傷大鼠則表現為肢體反應延遲。0分:動物肢體放置反應正常;1分:反應延遲但不超過2 s;2分:反應延遲且超過2 s。側方刺激,讓動物位于桌子側方,實驗檢測方法及評分標準同前方刺激。②觸覺亞實驗,將動物雙眼遮住,并使其前爪懸空,用其前爪背側輕觸桌面,刺激深度僅達皮膚和毛發,動物反應及評分同視覺亞試驗,觸覺刺激同樣分前方和側方刺激。③ 本體覺亞實驗,操作及評分同觸覺亞實驗,僅刺激深度不同,本體覺亞實驗給予前爪較大壓力,刺激深達肌肉及關節。該亞實驗只有前方刺激。動物前肢放置試驗總分范圍為0~10分,功能損傷越重,得分越高。
1.5 血常規檢測
在大鼠腦缺血4 h再灌注24 h后,從腹主動脈取血液樣本。在首都醫科大學宣武醫院臨床實驗室進行血常規的檢測。包括白細胞、中性粒細胞、淋巴細胞、單核細胞、紅細胞和血小板計數,檢測血紅蛋白濃度。
1.6 免疫印跡法檢測
大鼠腦缺血-再灌注24 h后,用過量水合氯醛麻醉處死,取梗死側皮質腦組織稱質量,加入5倍體積的裂解液,裂解液成分包含20 mmol/L Tis-HCl(pH 7.5),150 mmol/L NaCl,1 mmol/L Na2EDTA,1 mmol/L EGTA,1%NP-40,2.5 mmol/L 焦磷酸鈉,1 mmol/L β-甘油磷酸酯,1 mmol/L Na3VO4和 1 μg/mL 亮抑蛋白酶肽。將組織超聲破碎后,蛋白定量,隨后進行常規的免疫印跡檢測。電泳、電轉后,5%脫脂牛奶室溫封閉2 h;按照1∶1 000的比例加入p-AKT(Ser473)、p-ERK(Thr202/Tyr204)(Cell Signaling Technology,美國)一抗,4℃孵育過夜;按照1∶5 000的比例加入HRP標記的二抗(Abgent公司,美國),室溫孵育1 h后,利用化學發光儀進行檢測。結果用Quantity one 4.4.0軟件分析蛋白條帶的相對灰度。
1.7 免疫熒光染色
大鼠腦缺血-再灌注24 h后,腹腔注射水合氯醛(300 mg/kg)麻醉,4%(質量分數)多聚甲醛磷酸鹽溶液經右心室快速灌注,斷頭取腦,置于4%多聚甲醛中后固定48 h,石蠟包埋、進行腦冠狀切片,每片厚約5 μm。用0.3%(體積分數)H2O2/甲醇溶液消除內源性過氧化物酶活性,EDTA抗原微波熱修復,用3%(質量分數)小牛血清磷酸鹽溶液封閉2 h;按照1∶50的比例加p-AKT(Ser473)、p-ERK(Thr202/Tyr204)抗體,4℃孵育過夜;加入TRITC標記的山羊抗兔IgG熒光二抗,室溫孵育30 min;DAPI封片,熒光顯微鏡下觀察并記錄。
1.8 統計學方法
采用SPSS 17.0軟件進行統計分析,所有資料采用均數±標準差(±s)表示,兩組之間的比較采用Student’s t-test;多組之間的分析比較采用 one-way ANOVA 及post-hoc Scheffe’s test方法,以P <0.05為差異有統計學意義。
2 結果
2.1 EPO聯合tPA使用可以減小大鼠腦梗死體積,改善神經功能評分
大鼠腦缺血再灌注24 h后,TTC染色計算腦梗死體積百分比(圖 1A)。結果顯示,與[tPA+NS]4 h組相比,[tPA+EPO]4 h組梗死百分比顯著減少(P<0.05,圖1B);[tPA+EPO]2 h組與[tPA+NS]2 h組相比,差異無統計學意義。另外,[tPA+EPO]4 h組大鼠神經功能損傷明顯低于[tPA+NS]4 h組(P<0.05,圖1C)。[tPA+EPO]2 h組與[tPA+NS]2 h組之間差異無統計學意義(圖1C)。

圖1 腦梗死體積及神經功能的結果Fig.1 Results of cerebral infarction volume and neurological function
A:representative results of TTC staining;B:cerebral infarction volumes were analyzed and calculated;C:representative results of neurological function.*P<0.05 vs tPA+NS group,n=6;tPA:tissue plasminogen activator;EPO:erythropoietin;NS:normal saline;TTC:2,3,5-triphenyltetrazolium chloride.
2.2 EPO聯合tPA使用可以減少病死率、腦水腫和腦出血
在本研究中,[tPA+EPO]2 h組和[tPA+EPO]4 h組的病死率分別是10%和20%,明顯低于[tPA+NS]2 h組(30%,P<0.05)和[tPA+NS]4 h組(60%,P <0.05)。通過TTC染色計算腦水腫顯示(圖1A):[tPA+EPO]2 h組和[tPA+EPO]4 h組的腦水腫百分比分別低于[tPA+NS]2 h組和[tPA+NS]4 h組(P<0.05,圖2B)。同樣,通過對每組40個腦切片出血點的觀察和計數表明,[tPA+EPO]2 h組和[tPA+EPO]4 h組的出血點數量分別低于[tPA+NS]2 h組和[tPA+NS]4 h組(P<0.05,圖2C)。這些結果顯示,通過大腦中動脈低劑量注射EPO聯合tPA使用后,降低了 大鼠的病死率、血腦脊液屏障通透性和腦出血。
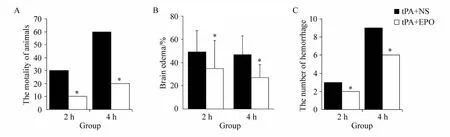
圖2 病死率、腦水腫和腦出血的結果Fig.2 Results of mortality,brain edema and hemorrhage
2.3 EPO聯合tPA注射不影響紅細胞及血紅蛋白變化

圖3 血常規檢測結果Fig.3 Results of routine blood tests
本研究通過降低EPO的使用劑量避免對紅細胞及血紅蛋白的影響等不良反應的發生。應用腦缺血4 h,再灌注24 h后的大鼠進行血常規檢測來驗證。[tPA+EPO]4 h組和[tPA+NS]4 h組大鼠的白細胞、中性粒細胞、淋巴細胞、單核細胞(圖3A)、紅細胞(圖3B)的總數、血紅蛋白濃度(圖3C)和血小板數量(圖3D)差異無統計學意義,證實了用低劑量EPO聯合tPA治療,不會產生明顯的不良反應。
2.4 EPO聯合tPA使用可以增加大鼠腦皮質中p-AKT的表達

圖4 p-AKT的蛋白免疫印跡及免疫熒光結果Fig.4 Results of western blotting and immunofluorescence for p-Akt
本研究通過Western blotting和免疫熒光的方法檢測了大鼠腦皮質p-AKT的濃度。如圖4A所示,相對于Sham 組,[tPA+EPO]2 h組和[tPA+NS]2 h組大鼠腦皮質中的p-AKT濃度顯著增加,但兩組之間差異無統計學意義。然而,[tPA+EPO]4 h組p-AKT濃度明顯高于[tPA+NS]4 h組(P<0.05),提示大鼠腦缺血4 h后,通過EPO處理激活了AKT通路。免疫熒光顯示,與sham組和[tPA+NS]4 h組(圖4B)相比,[tPA+EPO]4 h組大鼠腦皮質中p-AKT陽性的神經元明顯增加,這一結果與Western blotting的結果相符合。
2.5 EPO聯合tPA使用可以增加大鼠腦皮質中p-ERK的表達
Western blotting結果表明,與 sham組相比較,[tPA+NS]2 h組、[tPA+EPO]2 h組和[tPA+NS]4 h組的p-ERK濃度無明顯變化;與sham組和[tPA+NS]4 h組相比較,[tPA+EPO]4 h組大鼠腦皮質中p-ERK的濃度顯著增加(P<0.05,圖5A)。與Western blotting結果一致,相對于[tPA+NS]4 h組,[tPA+EPO]4 h組大鼠腦皮質中p-ERK陽性的神經元明顯增加(圖5B)。

圖5 p-ERK的蛋白免疫印跡及免疫熒光結果Fig.5 Results of western blotting and immunofluorescence for p-ERK
3 討論
在缺血性卒中治療中,雖然很多基礎研究[3-5]和臨床研究[8,13]已經證明EPO具有治療腦缺血的潛力,但是當大劑量EPO聯合tPA使用時會引發有害的不良反應,如紅細胞增多、增加血栓形成,這些可以使腦缺血損傷更加惡化[8-10,14]。2008年,德國哥廷根大學開展了多中心EPO卒中臨床Ⅲ期試驗[8],用EPO(單次靜脈注射40 000 IU)治療急性腦缺血患者后,很多患者出現腦出血和死亡,其中63%的患者接受過tPA溶栓治療。研究[8]表明,EPO不適用于治療tPA溶栓后的腦卒中患者。但是,該臨床試驗中存在幾個問題:① 約50%患者進行tPA溶栓時超過了規定的時間窗;②EPO注射的劑量過大(單次靜脈注射40 000 IU)。這些很有可能是EPO聯合tPA使用后導致患者的腦出血和高病死率的關鍵問題,也是很多基礎研究與臨床試驗結果不相符的原因。Jia等[9]通過建立大鼠MCAO模型,發現在大鼠腦缺血6 h后,當rhEPO(5 000 IU/kg)聯合tPA(10 mg/kg)使用時沒有減少腦梗死體積,而且rhEPO會加劇tPA誘發的腦出血。值得注意的是,與對照組相比,在腦缺血后2 h給予rhEPO聯合tPA治療可以顯著減少腦梗死體積,并且沒有顯著的增加腦出血轉化。這與本試驗中的腦缺血4 h結果相符。在線栓制作的大鼠腦缺血模型中,tPA的治療時間窗不超過腦缺血后的4 h,延遲給予tPA治療會增加腦出血性轉化[15-16]。因此,Jia等[9]研究中的大鼠腦缺血6 h后給藥產生的不良反應,可能與tPA超過治療時間窗有關,與該研究結果不同的是,本研究顯示,在大鼠腦缺血后2 h給予治療并未減少腦梗死體積,有待進一步的研究。但證實了腦缺血4 h后,同時使用EPO及tPA是可行的,沒有增加出血性轉化或其他不良反應。以上這些研究結果提示,明確EPO和tPA之間的作用關系、確定給藥時間、方式和劑量在治療缺血性卒中過程中非常必要。
在本研究中,為了避免高劑量注射EPO產生的促紅細胞生成的不良反應,同時又能有效的達到治療作用。本研究采用了低劑量EPO(800 IU/kg)聯合tPA通過大腦中動脈注射的給藥方式。結果顯示,相對于單獨使用tPA(tPA+NS組),在大鼠腦缺血4h后,通過大腦中動脈聯合注射tPA及EPO,可以顯著減少腦缺血后梗死體積、神經功能缺失、病死率、腦水腫和腦出血點,提示EPO發揮神經保護作用的同時并未加劇tPA誘發的腦出血。此外,tPA+NS組和tPA+EPO組大鼠的白細胞、中性粒細胞、淋巴細胞、單核細胞、紅細胞的總數、血紅蛋白濃度和血小板數量無明顯變化,提示該劑量的EPO(800 IU/kg)聯合tPA是治療腦缺血-再灌注損傷中一個安全、有效的策略。
研究[17-18]表明,ERK通路是腦缺血后重要的生存通路。在腎損傷[19]和心肌癥[20]中,EPO 主要通過激活AKT通路起到保護性作用,當AKT通路被抑制后,ERK通路被激活,參與保護作用[21]。另一方面,也有些研究[22-24]認為,EPO治療腦缺血性損傷時,兩條通路同時被激活。關于EPO起效的信號通路的矛盾可能是因為組織和器官的差異性[25-27]。本研究證實,相對于[tPA+NS]4 h組,[tPA+EPO]4 h組大鼠 p-ERK和p-AKT的水平顯著增加,表明兩條通路均參與了EPO的治療過程。
綜上所述,在大鼠腦缺血-再灌注后,通過大腦中動脈低劑量注射EPO后可以起到神經保護的效果,并未引發tPA的不良反應,這可能為今后腦缺血性中風治療提供了新策略。本研究目前認為,大腦中動脈低劑量注射EPO可能是通過激活AKT和ERK通路發揮神經保護作用,其具體的機制還需要進一步明確。
[1] Marler J R,Goldstein L B.Medicine.Stroke——tPA and the clinic[J].Science,2003,301(5640):1677.
[2] Wardlaw J M,Sandercock P A,Berge E.Thrombolytic therapy with recombinant tissue plasminogen activator for acute ischemic stroke:where do we go from here?A cumulative meta-analysis[J].Stroke,2003,34(6):1437-1442.
[3] Gao Y,Mengana Y,Cruz Y R,et al.Different expression patterns of Ngb and EPOR in the cerebral cortex and hippocampus revealed distinctive therapeutic effects of intranasal delivery of Neuro-EPO for ischemic insults to the gerbil brain[J].J Histochem Cytochem,2011,59(2):214-227.
[4] Gunnarson E,Song Y,Kowalewski J M,et al.Erythropoietin modulation of astrocyte water permeability as a component of neuroprotection[J].Proc Natl Acad Sci U S A,2009,106(5):1602-1607.
[5] Iwai M,Cao G,Yin W,et al.Erythropoietin promotes neuronal replacement through revascularization and neurogenesis after neonatal hypoxia/ischemia in rats[J].Stroke,2007,38(10):2795-2803.
[6] Zhang F,Xing J,Liou A K,et al.Enhanced delivery of erythropoietin across the blood-brain barrier for neuroprotec-tion against ischemic neuronal injury[J].Transl Stroke Res,2010,1(2):113-121.
[7] Dang S,Liu X,Fu P,et al.Neuroprotection by local intraarterial infusion of erythropoietin after focal cerebral ischemia in rats[J].Neurol Res,2011,33(5):520-528.
[8] Ehrenreich H,Weissenborn K,Prange H,et al.Recombinant human erythropoietin in the treatment of acute ischemic stroke[J].Stroke,2009,40(12):e647-656.
[9] Jia L,Chopp M,Zhang L,et al.Erythropoietin in combination of tissue plasminogen activator exacerbates brain hemorrhage when treatment is initiated 6 hours after stroke[J].Stroke,2010,41(9):2071-2076.
[10]Zechariah A,ElAli A,Hermann D M.Combination of tissue-plasminogen activator with erythropoietin induces blood-brain barrier permeability,extracellular matrix disaggregation,and DNA fragmentation after focal cerebral ischemia in mice[J].Stroke,2010,41(5):1008-1012.
[11] Longa E Z,Weinstein P R,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[12] Belayev L,Alonso O F,Busto R,et al.Middle cerebral artery occlusion in the rat by intraluminal suture.Neurological and pathological evaluation of an improved model[J].Stroke,1996,27(9):1616-1622.
[13]Ehrenreich H,Hasselblatt M,Dembowski C,et al.Erythropoietin therapy for acute stroke is both safe and beneficial[J].Mol Med,2002,8(8):495-505.
[14] Stohlawetz P J,Dzirlo L,Hergovich N,et al.Effects of erythropoietin on platelet reactivity and thrombopoiesis in humans[J].Blood,2000,95(9):2983-2989.
[15]Murata Y,Rosell A,Scannevin R H,et al.Extension of the thrombolytic time window with minocycline in experimental stroke[J].Stroke,2008,39:3372-3377.
[16]Zhang L,Zhang Z G,Zhang R L,et al.Postischemic(6-hour)treatment with recombinant human tissue plasminogen activator and proteasome inhibitor ps-519 reduces infarction in a rat model of embolic focal cerebral ischemia[J].Stroke,2001,32(12):2926-2931.
[17] Kilic U,Kilic E,Soliz J,et al.Erythropoietin protects from axotomy-induced degeneration of retinal ganglion cells by activating ERK-1/-2[J].FASEB J,2005,19(2):249-251.
[18]Park M H,Lee S M,Lee J W,et al.ERK-mediated production of neurotrophic factors by astrocytes promotes neuronal stem cell differentiation by erythropoietin[J].Biochem Biophys Res Commun,2006,339(4):1021-1028.
[19] Eliopoulos N,Zhao J,Forner K,et al.Erythropoietin gene-enhanced marrow mesenchymal stromal cells decrease cisplatin-induced kidney injury and improve survival of allogeneic mice[J].Mol Ther,2011,19(11):2072-2083.
[20]Kim K H,Oudit G Y,Backx P H.Erythropoietin protects against doxorubicin-induced cardiomyopathy via a phosphatidylinositol 3-kinase-dependent pathway[J].J Pharmacol Exp Ther,2008,324(1):160-169.
[21] Miki T,Miura T,Tanno M,et al.Impairment of cardioprotective PI3K-Akt signaling by post-infarct ventricular remodeling is compensated by an ERK-mediated pathway[J].Basic Res Cardiol,2007,102(2):163-170.
[22] Kilic E,Kilic U,Soliz J,et al.Brain-derived erythropoietin protects from focal cerebral ischemia by dual activation of ERK-1/-2 and Akt pathways[J].FASEB J,2005,19(14):2026-2028.
[23]Sargin D,Friedrichs H,El-Kordi A,et al.Erythropoietin as neuroprotective and neuroregenerative treatment strategy:comprehensive overview of 12 years of preclinical and clinical research[J].Best Pract Res Clin Anaesthesiol,2010,24(4):573-594.
[24] Noguchi C T,Asavaritikrai P,Teng R,et al.Role of erythropoietin in the brain[J].Crit Rev Oncol Hematol,2007,64(2):159-171.
[25]王榮亮,劉小蒙,張營,等.大鼠局灶性腦缺血后神經功能評分與腦梗死體積相關性分析[J].首都醫科大學學報,2013,34(1):69-74.
[26]劉小蒙,王榮亮,羅玉敏.大鼠腦缺血神經功能缺損行為學評價的研究進展[J].中國腦血管病雜志,2012,9(4):208-212.
[27]劉小蒙,羅玉敏,陳俊.缺血性腦血管病神經保護藥轉化醫學的現狀[J].中國腦血管病雜志,2012,9(10):550-555.

