胃癌淋巴結轉移相關外周血MicroRNA分子標記物的臨床價值*
鄭君華,王永兵,顧天來,羅蕓葆(上海市浦東新區人民醫院普外科 201200)
>中國是胃癌高發區,特別是在農村地區,胃癌的總發病率在各類惡性腫瘤中居首位[1]。早期胃癌患者多無特異性癥狀,約三分之二的患者在確診時便處于中晚期或出現轉移[2]。影像學檢查在微小病灶方面有一定的局限性[3]。而腫瘤標記物如癌胚抗原、糖鏈抗原(CA)72-4和CA19-9的異常一般在晚期胃癌患者中才能檢出,且其陽性率不到50%[4]。MicroRNA(miRNA)在組織和細胞中的表達與腫瘤呈現顯著的相關性、組織特異性和表達穩定性,并且在外周血中的表達與腫瘤中的表達具有一定的一致性[5]。目前已經證實,有5種血清miRNA(miR-1,miR-20a,miR-27a,miR-34和miR-423-5p)是胃癌的診斷標志物,且其表達水平與腫瘤的分期相關[6]。本研究選擇hsa-miR-106a進行實時熒光定量聚合酶聯反應(qRT-PCR)檢測,評估hsa-miR-106a作為外周血中與胃癌淋巴結轉移相關的分子標志物,用于臨床胃癌篩查的應用前景。現將結果報道如下。
1 資料與方法
1.1 一般資料選取2010年5月至2012年12月本院普外科住院、術前行胃鏡及病理檢查確診并行根治性手術治療的80例胃癌患者為研究對象,其中男52例,女28例;年齡31~82歲,平均年齡(53.6±8.3)歲。將胃癌患者按照淋巴結轉移數目分為N0組(無淋巴結轉移)46例,其中男31例,女15例,平均年齡(56.0±13.2)歲;N3組(淋巴結轉移大于7枚)34例,其中男21例,女13例,平均年齡(52.6±15.5)歲。并選取同一時期的體檢健康者40例為健康對照組,其中男25例,女15例,平均年齡(47.2±11.2)歲。并做miRNA芯片檢測。3組一般資料比較,差異無統計學意義(P>0.05),具有可比性。
1.2 方法
1.2.1 外周血miRNA的抽提及檢測 分別采集研究對象3 mL全血,置乙二胺四乙酸鹽(EDTA)抗凝管中,常溫下1 500 r/min離心15min。將上層血漿(約1.5mL)轉移到1.5mL無RNA酶的EP管中,-80℃冰箱保存備用。按照說明書步驟,用Ambion公司的mirVana miRNA Isolation Kit抽提外周血miRNA,并檢測miRNA的質量。按照說明書上的步驟,采用FlashTag Biotin RNA Labeling Kit進行樣品標記,再采用GeneChip miRNA 2.0進行miRNA檢測。實驗由博奧生物有限公司完成。
1.2.2 qRT-PCR檢測 檢測對象包括N0組46例、N3組34例,健康對照組40例。應用miRNA qRT-PCR引物試劑盒(美國AB公司)PCR擴增。先逆轉錄成熟的miRNA,反應結束后,將逆轉錄產物10倍稀釋進行PCR反應。PCR體系為:TaqMan MicroRNA Assay 20×1.0μL,Product from RT reaction(Minimum 1∶10Dilution)2.0μL,TaqMan 2×Universal PCR Master Mix 10μL,Nuclease free water 7μL,總共20μL。95℃預變性10s;95℃變性5s,60℃退火延伸20s,重復40個循環,70~95℃繪制融解曲線結果分析以U6snRNA為內參,通過2-ΔΔCT法計算不同組之間hsa-miR-106a的表達差異。其中,ΔCt=Ct miRNA-CtU6,ΔΔCt=ΔCtM-ΔCt NM。實驗重復3次。
1.3統計學處理 使用SPSS13.0統計軟件進行統計分析,計量及計數資料分別采用±s或百分率表示,組間比較采用獨立樣本的t檢驗或χ2檢驗,以α=0.05為檢驗水準,P<0.05為差異有統計學意義。
2 結 果
2.1 miRNA芯片檢測結果在N3、N0組胃癌患者中均明顯上調的miRNA包括hsa-miR-16、hsa-miR-190、hsa-miR-101、hsa-miR-122、hsa-miR-149、hsa-miR-1、hsa-miR-20a;在N3、N0組胃癌患者中均明顯下調的miRNA包括hsa-miR-148a、hsamiRPlus-C1110、hsa-miR-423-5p、hsa-miR-7、hsa-miR-877、hsamiR-185、hsa-miR-365;在N3組患者表達上調最為明顯而在N0組患者中無明顯變化的miRNA包括hsa-miRNA-218、hsamiR-106a、hsa-miR-103a、hsa-miR-130b、hsa-miR-141、hsa-miR-203、hsa-miR-222、hsa-miR-29b。其中hsa-miR-106a最符合作為分子標記物的條件。具體見表1。
表1 miRNA芯片檢測N3組與N0組中miRNA表達情況(±s)

表1 miRNA芯片檢測N3組與N0組中miRNA表達情況(±s)
?
續表1 miRNA芯片分析N3組與N0組中miRNA表達情況(±s)
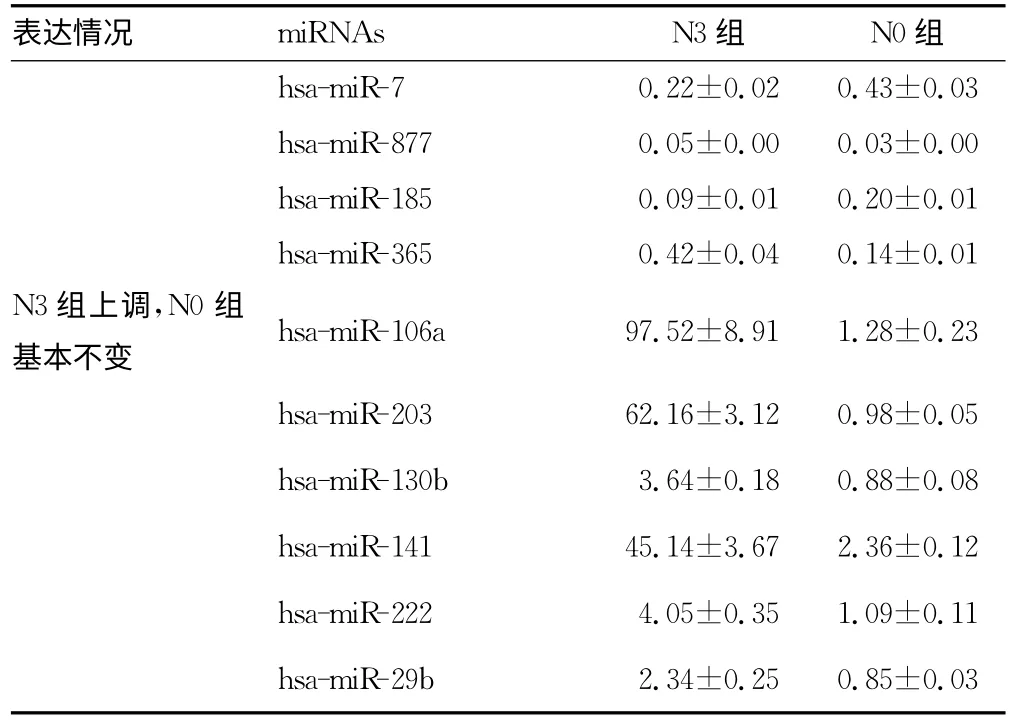
續表1 miRNA芯片分析N3組與N0組中miRNA表達情況(±s)
?
2.2 hsa-miR-106aqRT-PCR結果46例N0組胃癌患者、34例N3組胃癌患者及40例健康者外周血中hsa-miR-106a的表達情況分別見圖1、圖2、圖3。N0組外周血hsa-miR-106a表達水平均值為(0.990±5.576),N3組外周血hsa-miR-106a均值為(-9.698±6.485),健康對照組均值為(-0.279±6.041)。經獨立樣本t檢驗分析,N3組的外周血hsa-miR-106a的表達水平與N0組及健康對照組比較顯著上調,差異有統計學意義(P<0.05),但N0組與健康對照組之間外周血hsa-miR-106a的表達水平差異無統計學意義(P>0.05),見圖4。

圖1 N0組外周血中hsa-miR-106a的表達水平

圖2 N3組外周血中hsa-miR-106a的表達水平

圖3 健康對照組外周血中hsa-miR-106a的表達水平

圖4 各組hsa-miR-106a表達水平比較
2.3 胃癌患者外周血hsa-miR-106a的表達與臨床病理參數的關系hsa-miR-106a的表達水平除了與胃癌淋巴結轉移有關外(P<0.05),與患者性別、年齡、腫瘤大小、部位、組織學類型、腫瘤類型及分化程度等均無關(P>0.05)。
3 討 論
在不同腫瘤疾病中,miRNA具有特定的表達模式,這些特點在肝癌、肺癌、腸癌、卵巢癌和白血病等多種惡性腫瘤中得到了證實[7],也使miRNA成為腫瘤診斷的新生物學標記和治療靶標。外周血miRNA在胃癌中的檢測已有一些研究。例如通過生物芯片分析技術比較胃腫瘤組織miRNA和血漿miRNA,對hsa-miR-17-5p、hsa-miR-21、hsa-miR-106a、miR-106b和let-7a等外周血miRNA進行檢測,發現血漿中miRNA的表達水平與大部分腫瘤組織miRNA的表達水平一致[8]。采用常規RNA提取方法便可以從血清中獲得滿足實驗需要的miRNA,這也為外周血miRNA的臨床檢測奠定了基礎。
本研究應用最新版本的miRNA生物芯片,篩選出幾種具有較高差異表達水平的外周血miRNA胃癌標記物。這些miRNA在N3組表達上調,而在N0組基本不變,其中hsamiR-106a最符合作為分子標記物的條件。hsa-miR-106a定位于X染色體上,通常表達于由內胚層分化而來的組織干細胞中。通過序列搜索,已證實hsa-miR-106a潛在的目的基因超過700種,所表達的蛋白包括細胞周期調控蛋白、細胞凋亡調控蛋白、血管生成相關蛋白、腫瘤轉移相關蛋白等。在乳腺癌轉移研究中,發現層粘連蛋白5是基底膜的重要組成成分,而基底膜介導上皮細胞間的粘連。當層粘連蛋白5表達增加時,癌細胞轉移減少。hsa-miR-106a的過表達可下調層粘連蛋白5的表達,從而刺激癌細胞的轉移[9]。RB可與甲基化轉移酶組成復合物行使甲基轉移的功能。而RB和SUV420H1同時受hsa-miR-106a的負調控,在hsa-miR-106a的作用下表達降低,從而促進基因的低甲基化[10]。因此,本研究以hsa-miR-106a為研究對象,擴大標本量,通過qRT-PCR進行進一步的研究。經獨立樣本t檢驗分析,N3組的外周血hsa-miR-106a表達水平與N0組及健康對照組比較顯著上調,差異有統計學意義(P<0.05),但N0組與健康對照組之間外周血hsa-miR-106a的表達水平差異無統計學意義(P>0.05)。這與Xiao等[11]研究中發現淋巴及遠處轉移的胃癌組織中hsa-miR-106a高表達相符。
胃癌的發病機制較為復雜,可能的病因包括幽門螺旋桿菌感染、環境因素以及遺傳因素等[12]。傳統的胃癌腫瘤標記物在特異性與敏感性的兼容性方面都不是特別理想。相比之下miRNA具有高度的保守性、時序性和組織特異性,PCR檢測高靈敏度以及特異性引物的使用,使得miRNA兼容腫瘤診斷的特異性和敏感性成為可能。期望通過對hsa-miRNA-106a以及其他胃癌特異性miRNA的進一步研究,能為胃癌的預防、臨床診斷和治療開辟一條新的道路。
[1]Rifai N,Gillette MA,Carr SA.Protein biomarker discovery and validation:the long and uncertain path to clinical utility[J].Nat Biotechnol,2006,24(8):971-983.
[2]Lu J,Getz G,Miska EA,et al.MicroRNA expression profiles classify human cancers[J].Nature,2005,435(743):834-838.
[3]Lee YS,Dutta A.MicroRNAs in cancer[J].Annu Rev Pathol,2009,24(4):199-277.
[4]樊代明.腫瘤研究前沿[M].西安:第四軍醫大學出版社,2009:160-170.
[5]Alvarez-Garcia I,Miska EA.MicroRNA functions in animal development and human disease[J].Development,2005,132(21):4653-4662.
[6]Liu R,Zhang C,Hu Z,et al.A five-microRNA signature identified from genome-wide serum microRNA expression profiling serves as a fingerprint for gastric Cancer diagnosis[J].Eur J Cancer,2011,47(5):784-791.
[7]Zhou L,Zhao YP,Liu WJ,et al.Circulating microRNAs in Cancer:diagnostic and prognostic significance[J].Expert Rev Anticancer Ther,2012,12(2):283-288.
[8]Bartel DP.MicroRNAs:target recognition and regulatory functions[J].Cell,2009,136(2):215-233.
[9]Mccave EJ,Cass CA,Burg KJ,et al.The normal microenvironment directs mammary gland development[J].J Mammary Gland Biol Neoplasia,2010,15(3):291-299.
[10]Tryndyak VP,Kovalchuk O,Pogribny IP.Loss of DNA methylation and histone H4lysine 20trimethylation in human breast Cancer cells is associated with aberrant expression of DNA methyltransferase 1,Suv4-20h2histone methyltransferase and methyl-binding proteins[J].Cancer Biol Ther,2006,5(1):65-70.
[11]Xiao B,Guo J,Miao Y,et al.Detection of miR-106ain gastric carcinoma and its clinical significance[J].Clin Chim Acta,2009,400(1/2):97-102.
[12]James GF,Timothy CW.Inflammation,atrophy and gastric cancer[J].J Clin Invest,2007,117(2):60-69.

