NADPH氧化酶在高糖誘導的H9c2心肌細胞損傷中的作用
余 薇,閔 清,郭 霜
(湖北科技學院1.糖尿病心腦血管病變湖北省重點實驗室、2.藥學院藥理教研室,湖北咸寧 437100)
NADPH氧化酶在高糖誘導的H9c2心肌細胞損傷中的作用
余 薇1,2,閔 清2,郭 霜1
(湖北科技學院1.糖尿病心腦血管病變湖北省重點實驗室、2.藥學院藥理教研室,湖北咸寧 437100)
中國圖書分類號:R322.11;R329.25;R542.202.3;R587.2
摘要:目的 探討還原型煙酰胺腺嘌呤二核苷酸磷酸(NAD-PH)氧化酶在高糖損傷H9c2心肌細胞中的作用。方法 不同濃度(5.5、11、22、33、44、55 mmol·L-1)高糖刺激H9c2心肌細胞24 h及33 mmol·L-1濃度高糖刺激H9c2心肌細胞(0、12、24、36、48、72 h),MTT比色法檢測細胞存活率;West-ern blot檢測細胞內Bcl-2、Bax以及NADPH氧化酶亞基p22phox、p47phox以及p67phox的表達水平。結果 33 mmol· L-1濃度高糖刺激H9c2心肌細胞24 h后,細胞存活率開始明顯下降,Bcl-2表達減少,而Bax表達增加(P<0.05);此外,NADPH氧化酶亞基p22phox、p47phox以及p67phox蛋白表達水平明顯上調(P<0.05)。結論 心肌細胞內NADPH氧化酶活性升高可能是介導高糖損傷心肌細胞的重要機制。
關鍵詞:心肌細胞;高糖;糖尿病心肌病;NADPH氧化酶;氧化應激;凋亡
網絡出版時間:2015-9-14 14:53 網絡出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150914.1453.022.html
糖尿病心肌病(diabetic cardiomyopathy,DCM)是由糖尿病引起的一種心臟結構和功能障礙,獨立于高血壓、冠狀動脈粥樣硬化性心臟病、心臟瓣膜病及其他已知心臟疾病[1]。DCM的發病機制非常復雜,目前尚未完全闡明,現有研究認為,氧化應激導致的心肌細胞凋亡是糖尿病患者非缺血性心力衰竭發生的重要原因[2]。有研究顯示,糖尿病氧化應激水平升高與還原型煙酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NAD-PH)氧化酶活化相關[3]。本研究擬觀察不同時間高糖刺激對H9c2心肌細胞凋亡調節蛋白以及NAD-PH氧化酶亞單位表達的影響,探討NADPH氧化酶在高糖誘導的心肌細胞損傷中的作用,為防治糖尿病心肌細胞病變提供新的思路。
1 材料與方法
1.1實驗材料
1.1.1細胞系 H9c2細胞購自武漢大學細胞典藏中心。
1.1.2藥品與試劑 DMEM培養基、胎牛血清購自美國Gibco公司,單克隆Bax和Bcl-2抗體購自美國CST公司,p22phox、p47phox以及p67phox抗體購自美國Santa Cruz公司。
1.1.3主要儀器 CO2培養箱(德國Heraeus公司);超凈工作臺(蘇州安泰空氣技術公司);倒置相差顯微鏡(日本Olympus);垂直式電泳儀、電轉移槽
(美國Bio-Rad公司);多功能酶標儀(美國Bio-Tek公司);自動發光凝膠成像系統(英國SYNGENE公司)。
1.2方法
1.2.1細胞培養 H9c2細胞培養于含10%胎牛血清、抗生素(50 kU·L-1青霉素+50×103g·L-1鏈霉素)的DMEM培養基中,在37℃、5%CO2、飽和濕度的培養箱中靜置培養。待細胞生長接近70%融合時,0.25%EDTA-胰酶消化、傳代培養。取對數生長期細胞進行實驗。
1.2.2實驗分組 ①H9c2細胞隨機分為:正常對照組(使用含葡萄糖5.5 mmol·L-1的DMEM培養基),11、22、33、44、55 mmol·L-1高糖培養基刺激24 h組。②H9c2細胞隨機分為:正常對照組(使用含葡萄糖5.5 mmol·L-1的DMEM培養基)、33 mmol·L-1葡萄糖刺激12、24、36、48、72 h組。
1.3指標測定
1.3.1細胞存活率檢測 實驗結束后棄上清液,每孔加入5 g·L-1MIT工作液30 μL,10%血清培養基270 μL,共同培養4 h,加入DMSO在490 nm波長下檢測,酶標儀檢測各孔的光密度(OD)值。
1.3.2Western blot檢測 實驗結束后棄上清,PBS清洗細胞。每組加入80 μL細胞裂解液,冰上震蕩裂解30 min。用干凈的細胞刮刀迅速來回刮動板底細胞,1.5 mL離心管收集細胞碎片和裂解液,于4℃下13 000 r·min-1離心15 min。BCA法檢測蛋白濃度,每條泳道加蛋白樣品50 μg,根據不同抗體的效價,加入用TBST適當稀釋的一抗,置于4℃冰箱過夜。加入HRP標記的羊抗兔或羊抗鼠的IgG抗體,置室溫孵育1 h。用TBST漂洗后,加入ECL熒光液,顯影。
2 結果
2.1心肌細胞存活率改變 MTT測定結果表明,正常對照組細胞存活率以100%參照,高糖可致心肌細胞存活率隨著高糖濃度以及刺激時間延長而逐漸下降,心肌細胞在33 mmol·L-1高糖刺激24 h后存活率開始明顯下降,與正常對照組比較差異具有統計學意義(P<0.05)。見Fig 1。
2.2心肌細胞凋亡相關蛋白的變化 H9c2經過高糖處理12 h后,心肌細胞調控凋亡的蛋白表達開始發生改變,表現為抑制細胞凋亡的蛋白Bcl-2表達減少,而促凋亡發生的蛋白Bax表達增加,與正常對照組比較差異具有統計學意義(P<0.05),提示心肌細胞凋亡的可能已經發生。見Fig 2。

Fig 1 Influence of high glucose on cell viability in H9c2 cardiac cells(n=10)
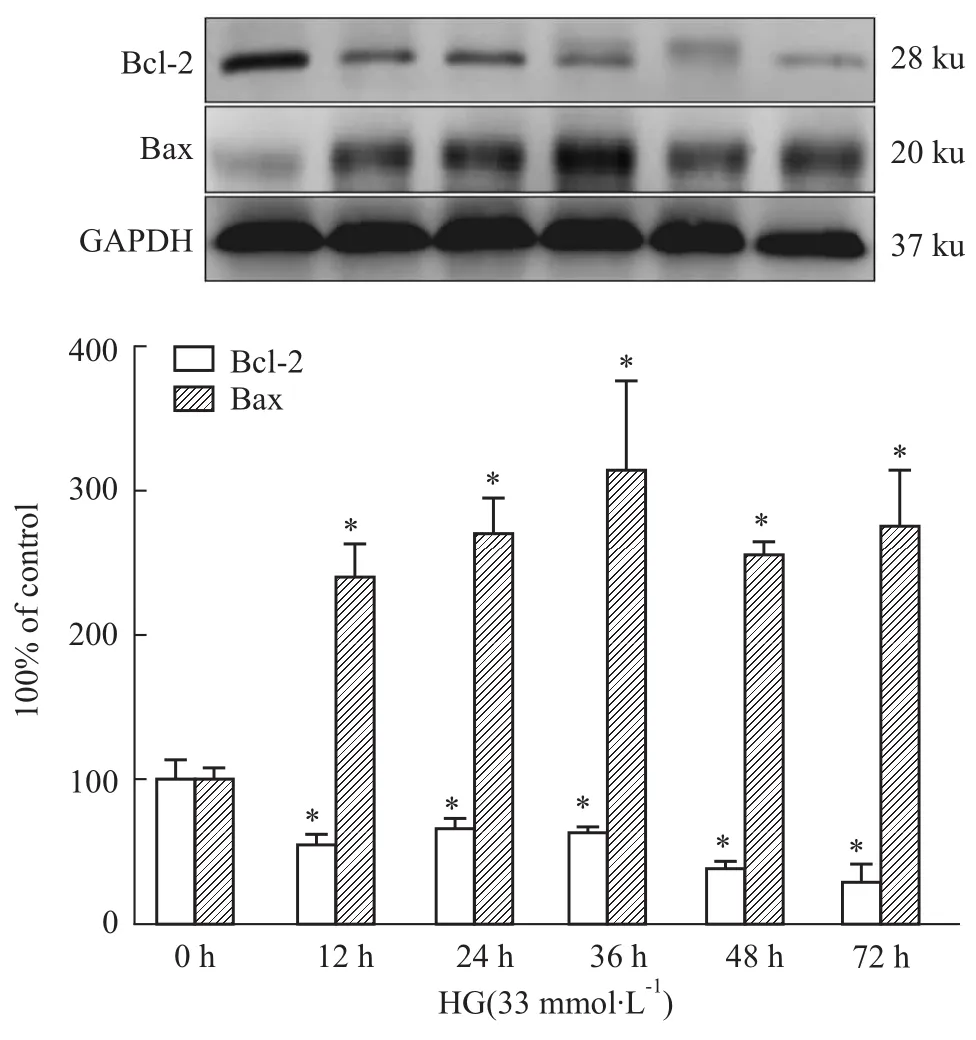
Fig 2 Influence of high glucose on the expression of Bcl-2 and Bax in H9c2 cardiac cells(n=3)
2.3心肌細胞NADPH氧化酶亞基的變化 為進一步探討高糖損害心肌細胞的可能機制,我們研究與氧化應激密切相關的NADPH氧化酶。H9c2細胞經過高糖刺激12 h后NADPH氧化酶亞基p22phox和p47phox表達水平持續升高,與正常對照組的差異具有統計學意義(P<0.05);而p67phox蛋白表達在高糖刺激24 h后持續升高,與正常對照組比較差異具有統計學意義(P<0.05)。見Fig 3。
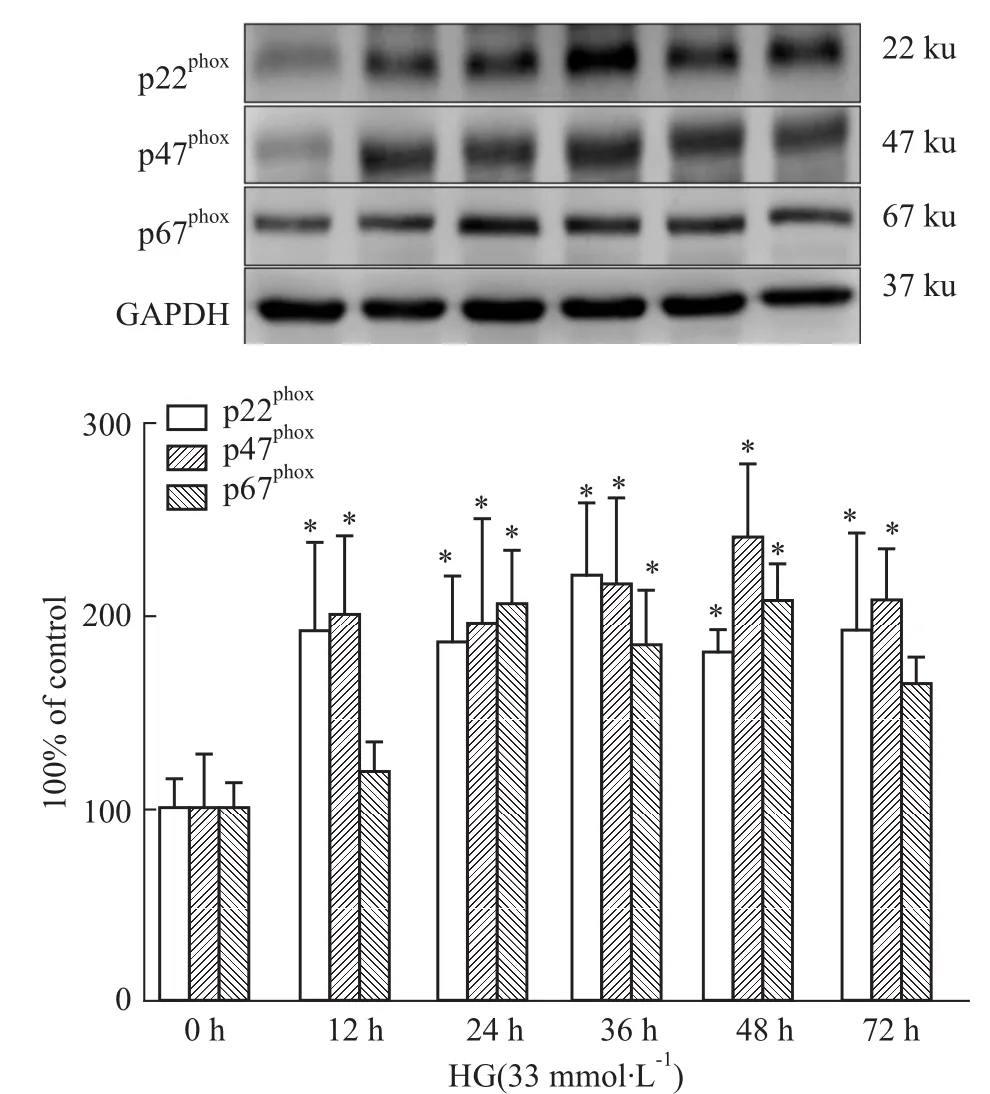
Fig 3 Influence of high glucose on the expression of NADPH submits in H9c2 cardiac cells(n=3)
3 討論
糖尿病與心血管疾病的發生密切相關,糖尿病是微血管和大血管疾病發展中的重要風險因素,糖尿病患者心血管并發癥引起的死亡率等同于確診心臟病的非糖尿病患者[4]。糖尿病患者在調整了伴隨著的心血管疾病的風險,比如冠心病或者高血壓以后,仍然容易罹患心臟衰竭。DCM作為糖尿病心血管疾病的主要并發癥之一,早期表現為心肌順應性降低和舒張期充盈受阻為主的舒張功能障礙,晚期以收縮功能不全為主,并最終發展為充血性心力衰竭,重癥患者甚至發生猝死[5]。
高血糖作為一種獨立的危險因素能直接損害心肌[6]。高血糖狀態下,細胞外基質大量增生、膠原降解異常,心肌間質纖維化發生。纖維化的增加直接促進成纖維細胞增殖,導致心肌肥大和重構,心臟功能受限[7]。心肌細胞具有不可再生性,隨著凋亡的不斷增加,細胞外基質逐步取代丟失的心肌細胞,加速心肌纖維化和重構進程,從而誘發心衰。糖尿病患者和實驗動物研究提示,心肌細胞凋亡在DCM發生發展中發揮至關重要作用[8-9]。目前認為,B細胞淋巴瘤/白血病-2(Bcl-2)蛋白家族調節細胞凋亡信號轉導,與細胞凋亡密切相關[10]。正常情況下,抗細胞凋亡蛋白Bcl-2與促細胞凋亡蛋白Bax維持動態平衡,維持細胞正常的生理過程。當Bcl-2表達增多,Bax表達減少,細胞凋亡減少,反之凋亡增多。H9c2心肌細胞株來源于大鼠胚胎期心臟組織,保持了心肌細胞的特征,可用于高糖的體外作用研究。本文通過不同濃度葡萄糖刺激H9c2細胞發現33 mmol·L-1高糖可致H9c2存活率明顯降低,且雷梅先等[11]報道33 mmol·L-1高糖可誘導H9c2心肌細胞凋亡。因此,本研究在此基礎上進一步探討高糖損傷心肌的可能機制。
研究表明,氧化應激導致的心肌細胞凋亡是糖尿病患者非缺血性心力衰竭發生的重要原因,NAD-PH氧化酶是糖尿病心血管組織活性氧簇(reactive oxygen species,ROS)的主要來源[12]。糖尿病時,糖脂代謝紊亂不僅使胞質戊糖途徑產生的NADPH增多,而且導致線粒體的還原當量NADH產生過多,抑制了電子傳遞,從而使NADPH氧化酶以還原當量NAD(P)H為底物,將過多的電子傳遞到氧分子產生ROS。已證實,NADPH氧化酶激活所致ROS產生的增加(即NADPH源性ROS的增加)在糖尿病心肌病中起重要作用[13]。心肌細胞NADPH氧化酶由gp91phox、p22phox、p47phox、p67phox、p40phox和Rac1 6種亞基組成的復合體。其中gp91phox和p22phox亞基位于細胞質膜上,p47phox、p67phox、p40phox、以及Rac1亞基位于細胞質內。NADPH氧化酶亞基表達的增加或位于細胞質的亞基向細胞膜轉移的增加均可導致NADPH氧化酶活性的增加[14]。王月芬等[15]研究發現,吡格列酮通過抑制NADPH氧化酶亞單位p22phox和p47phox的表達,抑制腎臟氧化應激水平,從而對糖尿病腎病產生保護作用。本實驗結果顯示:高糖刺激H9c2心肌細胞24 h后NADPH氧化酶亞基p22phox、p47phox以及p67phox表達持續增加,且Bcl-2表達減少而Bax表達增加,由此提示抑制NADPH氧化酶亞單位的表達可有效抑制高糖所致的心肌損傷。
綜上所述,高糖刺激時間的延長可使H9c2細胞存活率明顯下降,Bcl-2蛋白表達減少,而促凋亡蛋白Bax表達增加,同時使NADPH氧化酶亞基的表達增加。這提示了抑制NADPH氧化酶活性和細
胞凋亡在糖尿病心血管病并發癥的預防和治療具有重要的指導意義。
(致謝:本實驗在湖北科技學院糖尿病心腦血管病變湖北省重點實驗室完成,感謝實驗室的老師對本實驗的幫助與指導。)
參考文獻:
[1] Poornima I G,Parikh P,Shannon R P.Diabetic cardiomyopathy:the search for a unifying hypothesis[J].Circ Res,2006,98(5):596-605.
[2] Giacco F,Brownlee M.Oxidative stress and diabetic complications [J].Circ Res,2010,107(9):1058-70.
[3] Tsai K H,Wang W J,Lin C W,et al.NADPH oxidase-derived superoxide anion-induced apoptosis is mediated via the JNK-de-pendent activation of NF-kappaB in cardiomyocytes exposed to high glucose[J].J Cell Physiol,2012,227(4):1347-57.
[4] Haffner S M,Lehto S,Ronnemaa T,et al.Mortality from coro-nary heart disease in subjects with type 2 diabetes and in nondia-betic subjects with and without prior myocardial infarction[J].N Engl J Med,1998,339(4):229-34.
[5] Nagy A,Cserep Z.Link between diabetes and diastolic dysfunction and the diagnostic role of echocardiography[J].Orv Hetil,2009,150(45):2060-7.
[6] Rajamani U,Essop M F.Hyperglycemia-mediated activation of the hexosamine biosynthetic pathway results in myocardial apopto-sis[J].Am J Physiol Cell Physiol,2010,299(1):C139-C47.
[7] D′Souza A,Howarth F C,Yanni J,et al.Chronic effects of mild hyperglycaemia on left ventricle transcriptional profile and structur-al remodelling in the spontaneously type 2 diabetic Goto-Kakizaki rat[J].Heart Fail Rev,2014,19(1):65-74.
[8] Frustaci A,Kajstura J,Chimenti C,et al.Myocardial cell death in human diabetes[J].Circ Res,2000,87(12):1123-32.
[9] He C,Zhu H,Li H,et al.Dissociation of Bcl-2-Beclin1 complex by activated AMPK enhances cardiac autophagy and protects a-gainst cardiomyocyte apoptosis in diabetes[J].Diabetes,2013,62(4):1270-81.
[10]Mano Y,Anzai T,Kaneko H,et al.Overexpression of human C-reactive protein exacerbates left ventricular remodeling in diabetic cardiomyopathy[J].Circ J,2011,75(7):1717-27.
[11]雷梅先,王云開,殷 然,等.肝X受體通過NF-κB信號通路減輕高糖誘導的H9C2細胞凋亡[J].中國藥理學通報,2014,30(12):1698-70.
[11]Lei M X,Wang Y K,Yan R,et al.Liver X receptors attenuate high glucose-induced apoptosis in H9C2 cells through NF-κB sig-naling pathway[J].Chin Pharmacol Bull,2014,30(12):1698-70.
[12]Dong YF1,Liu L,Kataoka K,et al.Aliskiren prevents cardiovas-cular complications and pancreatic injury in a mouse model of obe-sity and type 2 diabetes[J].Diabetologia,2010,53(1):180-91.
[13]Li J,Zhu H,Shen E,et al.Deficiency of rac1 blocks NADPH ox-idase activation,inhibits endoplasmic reticulum stress,and re-duces myocardial remodeling in a mouse model of type 1 diabetes [J].Diabetes,2010,59(8):2033-42.
[14]Griendling K K,Sorescu D,Ushio-Fukai M.NAD(P)H oxidase:role in cardiovascular biology and disease[J].Circ Res,2000,86 (5):494-501.
[15]王月芬,葉山東,邢 燕.吡格列酮對STZ糖尿病大鼠腎組織氧化應激的影響[J].中國藥理學通報,2013,29(1):85-8.
[15]Wang Y F,Ye S D,Xing Y.Effect of different dosages of piogtita-zone on the oxidative stress in the kidney of STZ-induced diabetic rats[J].Chin Pharmacol Bull,2013,29(1):85-8.
Role of NADPH oxidase in high glucose-induced injury in H9c2 cardiac cells
YU Wei1,2,MIN Qing2,GUO Shuang1
(1.Hubei Province Key Laboratory on Cardiovascular,Cerebrovascular,and Metabolic Disorders,Hubei University of Science and Technology,Xianning Hubei 437100,China;2.Dept of Pharmacology,Hubei University of Science and Technology,Xianning Hubei 437100,China)
Abstract:Aim To explore the role of nicotinamide adenine dinucleotide phosphate(NADPH)oxidase in high glucose-induced injury in H9c2 cardiac cells.Methods H9c2 cardiac cells were exposed to differ-ent concentrations of high glucose(5.5 mmol·L-1,11 mmol·L-1,22 mmol·L-1,33 mmol·L-1,44 mmol ·L-1,55 mmol·L-1)for 24 h and different time pints of high glucose(0 h,12 h,24 h,36 h,48 h,72 h).Cell viability was measured by MTT colorimetry,the protein expression of Bcl-2,Bax and NADPH oxi-dase submits such as p22phox,p47phoxand p67phoxwere determined by western blotting.Results H9c2 cardi- ac cells exposure to high glucose for 24 h showed on decrease in cell survival and the Bcl-2 expression while an increase in the Bax expression(P<0.05).Moreo-ver,high glucose could markedly up-regulate the activ-ity of NADPH oxidase characterized by the enhanced expression of p22phox,p47phoxand p67phox(P<0.05).Conclusion Activating NADPH oxidase may play an important role in high glucose-induced injury in H9c2 cells.
Key words:myocardial cells;high glucose;diabetic cardiomyopathy;NADPH oxidase;oxidative stress;ap-optosis
作者簡介:余 薇(1979-),女,博士,副教授,碩士生導師,研究方向:心血管藥理學,E-mail:yuwei0805@163.com;閔 清(1967-),女,博士,教授,研究方向:心血管藥理學,E-mail:873806089@qq.com
基金項目:湖北省自然科學基金資助項目(No 2014CFB382);湖北省教育廳重點基金資助項目(No D20152802);湖北科技學院科研課題(No ZX1305)
收稿日期:2015-07-06,修回日期:2015-08-05
文獻標志碼:A
文章編號:1001-1978(2015)10-1379-04
doi:10.3969/j.issn.1001-1978.2015.10.011