肝動脈化療栓塞聯合CT引導下射頻消融術序貫治療小肝癌效果觀察
郭漢斌,曹建彪,周一鳴,任永強,康 志,孟慶梅
影像學引導下經皮射頻消融術(RFA)、肝動脈栓塞化療(TACE)及外科手術是目前原發性肝癌的標準治療手段[1]。針對小肝癌RFA的效果可以與手術治療媲美,但肝癌患者大多合并嚴重肝硬化,多數肝硬化結節與肝癌結節在超聲下很難鑒別,超聲引導還受腫瘤所在位置的影響,如鄰近膈頂的腫瘤由于部位深或受膈頂周圍包繞肺組織中氣體的影響,使得超聲難以發揮良好的導向作用,致應用受到限制。TACE治療后碘油在肝癌病灶沉積可以精確定位病灶,通過CT引導下RFA(CT-RFA)治療可以徹底消融肝癌病灶。北京軍區總醫院全軍肝病治療中心于2011年1月—2014年5月對48例肝細胞性小肝癌患者行TACE聯合CT-RFA序貫治療,獲得較好療效,現報告如下。
1 資料與方法
1.1 臨床資料 本組48例,男35例,女13例;年齡45~88歲,平均69歲。病例納入標準:①患者有乙、丙型肝炎肝硬化病史、血清甲胎蛋白(AFP)升高及2種以上影像學典型表現明確診斷原發性肝癌患者;②單個腫瘤直徑≤5 cm,或多發腫瘤≤3個,而且最大直徑≤3 cm,無明顯大血管、膽管浸潤,無淋巴結或肝外轉移;③由于高齡、嚴重肝硬化、病灶位置或患者家屬主觀等因素拒絕外科手術治療患者[2-3]。經B超、CT或MRI證實病灶72枚,其中單發病灶26例,多發病灶22例,病灶最長徑0.9~5.0(3.3±1.2)cm。其中,28枚病灶直徑≤3.0 cm,44枚病灶直徑3.1~5.0 cm。31例有肝硬化,肝功能Child-pugh A級30例,B級18例。均經1次TACE治療后,間隔30 d行CT-RFA。
1.2 治療方法
1.2.1 TACE:所有患者均行數字減影血管造影(DSA),使用GE LCV+DSA機。采用Seldinger法,經右側股動脈途徑。常規方法行選擇性肝總動脈造影,以3.1幀/s速度獲取圖像,10 s后取像速度1幀/s,總取像時間≥15 s。對比劑為碘氟醇350,注射速率4~5 ml/s,總量20 ml。分別進行后前位投照及右前斜位30°投照造影。選擇性或超選擇性造影,觀察病灶的位置、大小、數量和腫瘤供血動脈。栓塞劑采用國產超乳化碘化油,根據腫瘤瘤體大小和栓塞中造影結果決定具體劑量。化療藥物為:氟尿嘧啶(5-Fu)、表柔比星(EADM)、絲裂霉素(MMC)和順鉑(CDDP)。在TACE治療后重復造影了解各病灶是否均在栓塞范圍內以及碘化油栓塞沉積情況。觀察腫瘤血管是否存在再通情況,以及有無腫瘤染色,予以必要的補充栓塞。
1.2.2 CT-RFA:結合CT平掃確定碘油聚集病灶,采用美國RITA或Olympus RFA系統。具體方法:心電監護,術前10 min肌內注射鹽酸異丙嗪25 mg,哌替啶100 mg;根據病灶位置選取仰臥或側臥位,先行增強CT平掃,進一步確認進針的方向、角度及深度。常規消毒鋪巾,應用2%利多卡因2~5 ml局麻,置入22G穿刺引導針,掃描位置正確后經皮經肝將RFA針分步穿刺入腫瘤內部,CT確認主針位置正確后,將子針展開至直徑2~4 cm,再次確認子針覆蓋腫瘤滿意后行RFA治療,根據腫瘤大小、病灶數量、腫瘤位置等確定射頻消融的范圍、功率、次數、持續時間等。術后即刻CT掃描提示消融區呈稍低密度,完全覆蓋腫瘤,消融邊緣充分,治療結束后行針道消融以預防針道轉移及出血,術后常規行胸、腹部CT掃描,觀察病灶消融情況及有無氣胸、腹腔出血等并發癥。術后腹帶加壓固定,給予止血、預防感染、支持、對癥治療。
1.3 療效評估及安全性評價 術后即刻平掃:如果低密度灶范圍完全覆蓋病灶范圍,消融邊緣至病灶邊緣5~10 mm即為成功,否則應補行RFA,觀察有無周圍臟器受累,如氣胸及腹腔內出血等并發癥。術后3、6、12個月行肝臟三期增強CT、MRI掃描或超聲造影檢查評價療效:完全消融為腫瘤所在區域為低密度(超聲表現為高回聲),動脈期未見強化;不完全消融為腫瘤病灶內局部動脈期有強化,提示腫瘤殘留。
1.4 腫瘤大小變化 以公式V=πabc/6 cm3(V:體積,a:長徑,b:短徑,c:高徑,各徑線均以CT測量為準)計算每個腫瘤的體積[4],分別測量術前、術后3、6和12個月的腫瘤體積。
1.5 統計學方法 采用SPSS 18.0軟件分析,計量資料以均數±標準差(x±s)表示,數據符合正態分布及方差齊性,組內比較采用配對t檢驗,計數資料以率(%)表示,采用χ2檢驗,α=0.05為檢驗水準。
2 結果
2.1 TACE結果 48例均行DSA檢查共發現68枚病灶,病灶單發于肝左葉10例,位于Ⅳ段;單發于右葉19例,其中Ⅴ段6例,Ⅵ段6例,Ⅶ段2例,Ⅷ段5例。多發病灶19例,發現病灶39枚。DSA發現2枚微小肝癌病灶(MHCC,直徑<1 cm),另有7枚病灶MRI考慮癌結節,DSA下未顯影。DSA表現:肝動脈造影早期至中期出現由動脈小分支供血的結節狀染色區,其邊緣較清楚,隨動脈期的延長而逐漸增深。結節狀染色持續時間長,延長觀察至15 s以上時結節密度仍明顯高于周圍肝實質。均使用微導管行肝段TACE治療,栓塞后碘油聚集好(圖1)。30 d后復查,57枚首次治療病灶內碘油密實完全充填,11枚病灶內部分碘油沉積,其中6枚病灶MRI仍提示有腫瘤殘留。
2.2 CT-RFA結果 48例均接受CT-RFA,共消融腫瘤病灶68枚,其中 >5 cm者39枚,治療時間10~30 min,平均15 min。本組68枚病灶,行 CTRFA術后1個月隨訪復查,平掃示病灶CT值降低,內部可見空腔,同正常組織界限更加清晰,增強掃描消融病灶內部及邊緣無明顯強化(圖2)。
2.3 腫瘤體積 術前、術后3、6和12個月的腫瘤體積分別是(14.71±11.14)、(20.78±22.34)、(17.27±11.65)、(10.62±8.11)cm3,術后12個月腫瘤體積明顯減小,與術前比較差異有統計學意義(P<0.05)。本組68枚腫瘤病灶中,65枚完全壞死,完全壞死率為95.6%。
2.4 并發癥 CT-RFA術后36例出現不同程度右上腹痛和發熱,對癥處理后2~5 d癥狀明顯緩解或消失。5例氣胸,其中2例出現皮下氣腫,經保守治療后吸收。2例肝內出血,給予靜脈輸注止血藥物后好轉。
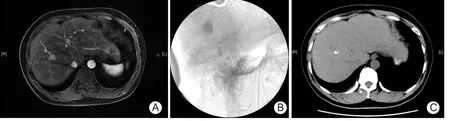
圖1 原發性小肝癌肝動脈栓塞化療前后影像學所見A.治療前CT影像;B.肝動脈造影;C.治療后CT復查
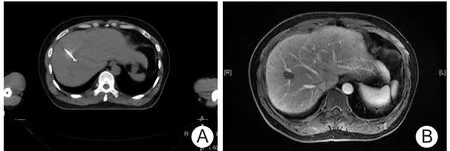
圖2 原發性小肝癌CT引導下射頻消融治療及治療后復查影像學所見A.射頻消融治療;B.治療后復查
3 討論
RFA是近年發展較快的肝癌治療手段,有微創、操作簡單、可反復治療等特點[4-5]。多項研究證明其對于小肝癌的療效與手術切除相似,被認為是不能切除的小肝癌主要替代手段,甚至可作為小肝癌的一線治療手段。但現有資料顯示,直徑≤1 cm的肝臟腫瘤B超、CT的漏診率分別高達90.2%、89.5%[6]。目前有文獻報道,DSA對于原發性小肝癌病灶的診斷靈敏度高于CT[7],故可通過先行TACE治療,根據碘油沉積準確定位病灶,消除以往未發現的微小病灶。RFA通過熱毀損原理治療腫瘤,被認為是肝癌TACE術后重要的輔助補充治療手段,兩者聯合應用有望成為小肝癌外科手術替代治療,而如何改進相關技術操作,提高療效,減少相關并發癥,仍有待于深入研究。
TACE治療對中小肝癌可起到良好的近期療效,但是肝癌周圍腫瘤微血管、門靜脈參與供血等,成為腫瘤復發及轉移的根源,影響其遠期療效[8-12]。本組11枚病灶碘油填充不完全,6枚MRI提示有腫瘤殘留,及時行RFA取得了較好效果。本組68枚病灶術后12個月腫瘤體積明顯縮小,腫瘤完全壞死率為95.6%。有學者認為,TACE術后1周腫瘤血管經栓塞后造成腫瘤局部相對缺血,不僅可以防止癌細胞的擴散,而且可以縮短射頻治療時間,擴大組織凝固壞死范圍是RFA治療最佳時機[13]。本研究認為該理論存在偏頗:一方面,小肝癌經微導管超選擇性栓塞術后,常使碘油滯留病灶周圍肝實質內,1周時間正常肝組織碘油尚未廓清,造成病灶邊界顯示不清,易遺漏或擴大消融范圍,甚至誤傷周圍組織。另一方面,腫瘤組織局部相對缺血,同樣該區域正常組織也相應缺血,此時RFA可加重肝功能損傷及增加并發癥風險。本組TACE治療后30 d復查CT顯示正常肝組織中碘油基本廓清,腫瘤病灶顯示清楚,是射頻治療的較好時機。11枚病灶碘油填充不完全,考慮一方面與多血管參與供血有關,另一方面為隨著時間延長,病灶內碘油消退,腫瘤邊界模糊,不利于進一步治療。所以,筆者認為TACE后30 d內行CT-RFA效果較好。
本組先行TACE治療有以下優勢:①TACE后碘油在腫瘤內沉積行RFA治療時起到導引作用,栓塞后可清楚顯示腫瘤的大小、位置、邊緣,并發現CT或MRI無法定性、定位的微小病灶,進而確定RFA治療的范圍。②TACE后可阻斷腫瘤的血供,使腫瘤去血管化,在RFA治療時射頻電極產生的熱能不易隨著血液循環帶走,從而消除熱沉降效應,提高RFA的治療效果。③在RFA治療時降低腫瘤穿刺出血及針道轉移的概率。
CT-RFA與超聲相比有如下優勢:①通常將病灶周圍0.5~1.0 cm范圍稱為腫瘤消融的安全邊界,CT能即刻清楚的顯示術后消融范圍,有利于評價消融效果。②采用CT定位對TACE術后病灶進行射頻消融,具有無盲區、不受腸道氣體干擾、減少“熱消散”效應、擴大凝固壞死區等優點,但其不足是穿刺過程不能做到實時監控,易受呼吸時相、幅度等影響導致消融靶區偏差,但可以通過術前有效鎮痛、平靜吸氣末屏氣訓練提高穿刺消融的準確性。③對于位于膈頂、心臟旁、血管膽管旁、肝臟邊緣、鄰近胃腸道的病灶,CT可精確定位,術前設計好進針途徑,調整CT影像的窗寬及窗位,清楚顯示射頻針的主針及子針的位置,精確實施多位點的射頻治療。
本組主要并發癥是氣胸和肝內出血。氣胸出現在膈頂病灶的治療中,因此,術前要精確定位,術中囑患者平靜呼吸屏氣,臨床可采用傾斜穿刺技術,避免穿刺經過肺組織及反復穿刺;經肺穿刺時,針道消融應避免在肺組織中進行,也可減少氣胸風險。肝內出血出現在反復穿刺患者,因此,在穿刺時應避免多次穿刺和經過1 cm以上的正常肝組織,另外,可采用22G千葉針或心內穿刺針引導穿刺,以減少反復穿刺所致出血;如果進行單次多位點治療時,如變換射頻針的方向,針尖應在肝被膜下調整位置,如必須在肝被膜外調整,需充分進行針道燒灼止血。
綜上所述,TACE聯合RFA治療小肝癌,其完全壞死率比較理想,遠期療效可能受病理性質、分化程度、肝硬化情況、病毒載量等因素影響,需長期隨訪。因此我們認為,TACE聯合CT-RFA治療小肝癌近期療效肯定。
[1] Lam V W,Ng K K,Chok K S,et al.Incomplete ablation after radiofrequency ablation of hepatocellular carcinoma:analysis of risk factors and prognostic factors[J].Ann Surg Oncol,2008,15(3):782-790.
[2] 中華人民共和國衛生部.原發性肝癌診療規范(2011年版)[J].臨床腫瘤學雜志,2011,16(10):929-946.
[3] 周際昌.實用腫瘤內科學[M].2版.北京:人民衛生出版社,2013:45-46.
[4] 唐云強,江鵬,何璐,等.三維重建聯合超聲引導下射頻消融治療肝癌的療效分析[J].中華消化外科雜志,2014,13(9):678-682.
[5] 蔡磊,李曉武,夏鋒,等.射頻消融治療轉移性肝癌的臨床療效[J].中華消化外科雜志,2014,13(3):190-193.
[6] Ochsenbein A F,Sierro S,Odermatt B,et al.Roles of tumour localization,second signals and cross priming in cytotoxic T-cell induction[J].Nature,2001,411(6841):1058-1064.
[7] Jemal A,Bray F,Cener,et al.Glohal cancer statistics[J].CA Cancer JClin,2011,61(5):69-90.
[8] 郭放,劉永葉,鄭振東,等.超聲引導下射頻消融治療原發性肝癌36例[J].解放軍醫藥雜志,2014,26(4):68-70.
[9] Tombesi P,Di Vece F,Sartori S.Resection vs thermal ablation of small hepatocellular carcinoma:What's the first choice?[J].World JRadiol,2013,5(1):1-4.
[10] Metussin A,Patanwala I,Cross T J.Re:partial hepatectomy vs.transcatheter arterial chemoembolization for resectable multiple hepatocellular carcinoma beyond Milan criteria:A RCT[J].J Hepatol,2014,7(14):813-817.
[11] Huang Z M,Li W,Li S,et al.Cytokine-induced killer cells in combination with transcatheter arterial chemoembolization and radiofrequency ablation for hepatocellular carcinoma patients[J].JImmunother,2013,36(5):287-293.
[12]Cucchetti A,Piscaglia F,Cescon M,et al.Cost-effectiveness of hepatic resection versus percutaneous radiofrequency ablation for early hepatocellular carcinoma[J].J Hepatol,2013,59(2):300-307.
[13] Widmann G,Schullian P,Bale R.Radiofrequency ablation of hepatocellular carcinoma[J].Wien Med Wochenschr,2013,163(5-6):132-136.

