負(fù)載抗原的DC與CIK共培養(yǎng)對(duì)多藥耐藥肝癌細(xì)胞HepG2/ADM的殺傷作用及其機(jī)制研究
徐巧元,楊志祥,羅 闊
(1.重慶市第五人民醫(yī)院腫瘤科 400062;2.重慶市中山醫(yī)院腫瘤科400013)
?
·論 著·
負(fù)載抗原的DC與CIK共培養(yǎng)對(duì)多藥耐藥肝癌細(xì)胞HepG2/ADM的殺傷作用及其機(jī)制研究
徐巧元1,楊志祥2△,羅 闊2
(1.重慶市第五人民醫(yī)院腫瘤科 400062;2.重慶市中山醫(yī)院腫瘤科400013)
目的 觀(guān)察負(fù)載抗原的樹(shù)突狀細(xì)胞(DC)與細(xì)胞因子誘導(dǎo)的殺傷細(xì)胞(CIK)對(duì)高表達(dá)P-糖蛋白(P-gp)的多藥耐藥(MDR)的肝癌細(xì)胞株HepG2/ADM細(xì)胞的殺傷作用和機(jī)制研究。方法 用常規(guī)方法誘導(dǎo)健康志愿者外周血中單個(gè)核細(xì)胞產(chǎn)生DC和CIK細(xì)胞,制備HepG2/ADM細(xì)胞凍融抗原后沖擊DC,并與CIK細(xì)胞分別共培養(yǎng)24、48、72、96 h,并將未負(fù)載抗原的DC和CIK細(xì)胞共培養(yǎng)作為對(duì)照。采用流式細(xì)胞術(shù)鑒定DC、CIK細(xì)胞的表型,采用CCK-8試劑檢測(cè)HepG2/ADM細(xì)胞的增殖活力。用RT-PCR檢測(cè)各組細(xì)胞內(nèi)mdr-1 mRNA的水平變化,Western blot檢測(cè)細(xì)胞內(nèi)P-gp蛋白水平的變化。結(jié)果 與未負(fù)載抗原的DC-CIK相比,負(fù)載抗原的DC-CIK表面分子表達(dá)明顯增高(P<0.05),對(duì)HepG2/ADM細(xì)胞增殖活力抑制作用更加明顯(P<0.05)。RT-PCR和Western blot結(jié)果分別顯示,隨著作用時(shí)間的延長(zhǎng),未負(fù)載抗原的DC-CIK和負(fù)載抗原DC-CIK的HepG2/ADM細(xì)胞內(nèi)的mdr-1 mRNA和P-gp蛋白水平分別都有明顯的降低(P<0.05),而且后者的抑制作用更明顯(P<0.05)。結(jié)論 經(jīng)抗原沖擊的DC和CIK共培養(yǎng)可以明顯提高對(duì)多藥耐藥HepG2/ADM細(xì)胞株的殺傷活性,其機(jī)制可能與抑制與MDR密切相關(guān)的mdr-1基因和及其編碼的P-gp蛋白水平有關(guān)。
細(xì)胞因子誘導(dǎo)的殺傷細(xì)胞; 樹(shù)突狀細(xì)胞; 多藥耐藥; P-糖蛋白; HepG2/ADM細(xì)胞
樹(shù)突狀細(xì)胞(DC)是體內(nèi)已知功能最強(qiáng)、唯一能活化靜息T細(xì)胞的專(zhuān)職抗原提呈細(xì)胞。細(xì)胞因子誘導(dǎo)的殺傷細(xì)胞(CIK)一種新型的免疫活性細(xì)胞,它是將人外周血單個(gè)核細(xì)胞在體外用多種細(xì)胞因子共同培養(yǎng)一段時(shí)間后獲得的一群異質(zhì)細(xì)胞。研究表明,CIK和DC兩者共培養(yǎng)后具有更強(qiáng)的增殖活性和細(xì)胞毒性,能刺激機(jī)體的免疫系統(tǒng),誘導(dǎo)產(chǎn)生特異性的抗腫瘤免疫反應(yīng),從而達(dá)到治療腫瘤的目的。目前DC聯(lián)合CIK細(xì)胞免疫治療在多種實(shí)體腫瘤和血液系統(tǒng)疾病中得到令人鼓舞的效果,而對(duì)于肝癌細(xì)胞多藥耐藥性調(diào)節(jié)方面報(bào)道較少,故本研究欲將CIK 細(xì)胞與負(fù)載耐藥肝癌HepG2/ADM細(xì)胞凍融抗原的DC細(xì)胞共培養(yǎng),觀(guān)察其對(duì)細(xì)胞殺傷性的影響,并探討其機(jī)制[1-3]。現(xiàn)將研究結(jié)果報(bào)道如下。
1 材料與方法
1.1 細(xì)胞系 DC和CIK細(xì)胞取自健康志愿者的外周血,HepG2肝癌細(xì)胞株來(lái)自重慶醫(yī)科大學(xué)分子與腫瘤研究中心,并建立由阿霉素誘導(dǎo)的多藥耐藥細(xì)胞株HepG2/ADM。
1.2 儀器與試劑 RPMI-1640培養(yǎng)液和胎牛血清購(gòu)自Gibco公司;人淋巴細(xì)胞分離液為T(mén)BS產(chǎn)品;RHGM-CSF、TNF-α、IFN-γ、IL-2和IL-4購(gòu)自廈門(mén)特寶生物工程股份有限公司;CD3單克隆抗體(CD3McAb)購(gòu)自深圳達(dá)科為生物有限公司;FITC標(biāo)記的CD3、CD8、CD56、CD80、CD83、CD86和主要組織相容性復(fù)合體Ⅱ(MHCⅡ)單克隆抗體購(gòu)自美國(guó)eBioscience公司;IL-2和IFN-γ的ELISA試劑盒購(gòu)自博士德生物公司;CCK-8試劑盒購(gòu)自日本株式會(huì)社;Annexin V-FITC/PI 購(gòu)自凱基生物。RT-PCR試劑盒購(gòu)自大連寶生生物工程有限公司,mdr-1引物由Invitrogen公司設(shè)計(jì)并合成。P-gp單克隆抗體購(gòu)自Santa Cruz公司,內(nèi)參抗體β-actin購(gòu)自博鰲森生物有限公司。
1.3 方法
1.3.1 細(xì)胞凍融抗原的制備 常規(guī)收集對(duì)數(shù)生長(zhǎng)期的HepG2/ADM細(xì)胞,磷酸緩沖液(PBS)沖洗3遍后,再用PBS稀釋將濃度調(diào)整至1×108/mL,制成細(xì)胞懸液。在-80 ℃冰凍,后于37 ℃融解,如此反復(fù)凍融3次,再于冰浴中超聲波破碎,以3 000 r/min離心10 min,收集上清液,過(guò)濾除菌,存放于4 ℃?zhèn)溆谩?/p>
1.3.2 DC和CIK細(xì)胞的誘導(dǎo)培養(yǎng)和共培養(yǎng) 取自于健康志愿者的外周血,經(jīng)血細(xì)胞分離機(jī)和淋巴細(xì)胞分離液梯度離心法分離純化單個(gè)核細(xì)胞。用含10% FCS的RPMI 1640培養(yǎng)基將細(xì)胞濃度調(diào)整為5×106/mL,加入6孔板中,于37 ℃,5% CO2培養(yǎng)箱培養(yǎng)2 h。收集培養(yǎng)上清中的懸浮細(xì)胞作為誘導(dǎo)CIK細(xì)胞備用。用含有1 000 U/mL CM-CSF、500 U/mL IL-4、500 U/mL TNF-α以及10% FCS的RPMI 1640培養(yǎng)基繼續(xù)培養(yǎng)貼壁細(xì)胞。每3天換1次液,在第4天,向一部分DC培養(yǎng)液中按100 U/mL加入凍融抗原,誘導(dǎo)至第7天收獲成熟DCs。將收集的懸浮細(xì)胞密度調(diào)整至2×106/mL加入6孔板中,用含50 ng/mL 抗CD3單抗、2 000 U/mL IFN-γ、1 000 U/mL IL-2以及10% FCS的RPMI 1640培養(yǎng)基繼續(xù)培養(yǎng)。每3天換1次液,誘導(dǎo)至14 d收獲CIK細(xì)胞。將收獲的負(fù)載抗原和未負(fù)載抗原的DC分別與CIK細(xì)胞共培養(yǎng)(DC∶CIK=1∶100),采用CIK培養(yǎng)液,分別命名為Ag-DC-CIK和DC-CIK。共培養(yǎng)4 d后,收集細(xì)胞備用。
1.3.3 流式細(xì)胞術(shù)鑒定DC和CIK細(xì)胞的免疫表型 共培養(yǎng)4 d的DC以及CIK細(xì)胞,用PBS將細(xì)胞密度調(diào)整至1×106/mL,分別加入相應(yīng)的抗體,混勻后在室溫下避光孵育30 min,再用PBS洗滌3遍,加入1%多聚甲醛固定。采用流式細(xì)胞儀檢測(cè)DC表型(CD80、CD83、CD86、MHCⅡ)和CIK表型(CD3、CD8、CD56)。
1.3.4 CCK-8檢測(cè)共培養(yǎng)細(xì)胞對(duì)肝癌HepG2/ADM細(xì)胞的殺傷作用 將處于對(duì)數(shù)生長(zhǎng)期的HepG2/ADM細(xì)胞以1×104/孔接種于96孔板中,培養(yǎng)12 h細(xì)胞貼壁后,將DC-CIK細(xì)胞或Ag-DC-CIK細(xì)胞加入HepG2/ADM培養(yǎng)體系中(效靶比1∶1、10∶1、100∶1),繼續(xù)培養(yǎng)24、48、72、96 h。在培養(yǎng)相應(yīng)時(shí)間點(diǎn)后加入10 μL的CCK-8試劑,37 ℃孵育2 h,于酶標(biāo)儀上490 nm處比色。根據(jù)公式計(jì)算細(xì)胞活力:細(xì)胞活力=A490(處理組)/A490(自然生長(zhǎng)組)×100%。
1.3.5 RT-PCR 收集DC-CIK細(xì)胞或Ag-DC-CIK細(xì)胞共培養(yǎng)的各組HepG2/ADM細(xì)胞,PBS充分洗滌后,參照Trizol試劑盒說(shuō)明書(shū)提取細(xì)胞總RNA,用RT-PCR法檢測(cè)各組細(xì)胞中mdr-1基因的表達(dá)量。Mdr-1上游引物:5′-GTA CCC ATC ATT GCA ATA GC-3′;下游引物:5′-CAA ACT TCT GCT CCT GAG TC-3′,擴(kuò)增產(chǎn)物大小為167 bp。內(nèi)參GAPDH上游引物:5′-CGG AGT CAA CGG ATT TGG TCG TAT-3′;下游引物:5′-AGC CTT CTC CAT GGT GGT GAA GAC-3′,擴(kuò)增產(chǎn)物大小為228 bp。擴(kuò)增條件:94 ℃預(yù)變性5 min;94 ℃變性45 s,55 ℃退火45 s,72 ℃延伸5 min,35個(gè)循環(huán);72 ℃ 延伸7 min。擴(kuò)增產(chǎn)物以1.5%瓊脂糖凝膠進(jìn)行電泳,凝膠成像掃描。用Quantity One灰度分析軟件進(jìn)行吸光度值計(jì)算。以目的基因mdr-1條帶灰度值與內(nèi)參GAPDH條帶灰度值的比值作為mdr-1 mRNA的表達(dá)量,并重復(fù)3次。
1.3.6 Western blot 收集各組細(xì)胞提取總蛋白,并測(cè)定蛋白的濃度為(2.12±0.24)mg/mL。取蛋白樣品20 μL,經(jīng)過(guò)SDS-PAGE電泳后,將蛋白電轉(zhuǎn)移至PVDF膜,以5%脫脂奶粉TBST液封閉后,加入P-糖蛋白(P-gp)抗體4 ℃孵育過(guò)夜,洗滌后加入HRP標(biāo)記的二抗室溫孵育1 h后,ECL底物化學(xué)發(fā)光顯色后曝光顯影。通過(guò)Chemi DocXRS化學(xué)發(fā)光成像系統(tǒng),進(jìn)行曝光分析,然后計(jì)算其比值表示結(jié)果,即:相對(duì)吸光度=目的蛋白P-gp吸光度/β-actin蛋白吸光度。
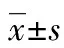
2 結(jié) 果
2.1 DC與Ag-DC細(xì)胞的免疫表型的比較 在DC誘導(dǎo)培養(yǎng)7 d后,分別收集DC和Ag-DC,采用流式細(xì)胞術(shù)鑒定DC表面標(biāo)志物CD80、CD83、CD86、MHCⅡ,結(jié)果見(jiàn)表1。DC分別為:(24.13±2.31)%、(18.77±0.63)%、(33.99±1.53)%、(32.02±2.30)%,而Ag-DC分別為:(42.42±2.27)%、(36.08±2.10)%、(36.66±2.10)%、(42.39±2.55)%。因此,結(jié)果顯示DC負(fù)載抗原后,表面標(biāo)志物的表達(dá)均有上升,且2組間CD80、CD83以及MHCⅡ的差異有統(tǒng)計(jì)學(xué)意義(P<0.05)。見(jiàn)表1。

表1 誘導(dǎo)7 d后DC與Ag-DC細(xì)胞的免疫表型的表達(dá)量
注:DC組與Ag-DC組比較,*P<0.05。
2.2 與DC或Ag-DC共培養(yǎng)后CIK細(xì)胞的免疫表型比較 在DC-CIK和Ag-DC-CIK共培養(yǎng)4 d后,收集2組CIK細(xì)胞,采用流式細(xì)胞術(shù)進(jìn)行表型鑒定,DC-CIK組的CIK細(xì)胞CD3+CD8+、CD3+CD56+細(xì)胞分別為(25.79±1.70)%、(8.94±0.63)%,而Ag-DC-CIK組的CIK細(xì)胞分別為(32.48±1.00)%、(13.97±1.25)%。該結(jié)果提示,負(fù)載抗原的DC比未負(fù)載抗原的DC更能提高CD3+CD8+CIK和CD3+CD56+CIK的百分比。見(jiàn)表2。

表2 共培養(yǎng)4 d后2組CIK細(xì)胞的免疫表型
注:DC-CIK組與Ag-DC-CIK組比較,*P<0.05。
2.3 DC-CIK和Ag-DC-CIK共培養(yǎng)細(xì)胞對(duì)肝癌HepG2/ADM細(xì)胞的殺傷作用 將DC-CIK或Ag-DC-CIK按效靶比分別為1∶1、10∶1、100∶1與肝癌細(xì)胞HepG2/ADM共培養(yǎng),采用CCK-8試劑檢測(cè)2組共培養(yǎng)細(xì)胞對(duì)肝癌細(xì)胞增殖活力的殺傷作用。當(dāng)效靶比為1∶1時(shí),無(wú)論作用多長(zhǎng)時(shí)間,2組HepG2/ADM細(xì)胞增殖活力下降均不明顯。當(dāng)效靶比為10∶1時(shí),2組共培養(yǎng)細(xì)胞在48 h出現(xiàn)殺傷作用,隨著作用時(shí)間延長(zhǎng),HepG2/ADM細(xì)胞增殖活力下降越明顯(P<0.05),且Ag-DC-CIK組的細(xì)胞活力明顯低于DC-CIK組(P<0.05)。當(dāng)效靶比在100∶1時(shí),共培養(yǎng)細(xì)胞的殺傷作用更強(qiáng),Ag-DC-CIK組在24 h就使HepG2/ADM細(xì)胞增殖活力下降至(81.8±4.67)%,當(dāng)作用時(shí)間至96 h,DC-CIK組的HepG2/ADM細(xì)胞活力大大降低至(42.23±3.01)%,甚至在A(yíng)g-DC-CIK組僅剩(19.14±2.06)%。該結(jié)果顯示,效靶比在1∶1到100∶1范圍內(nèi)時(shí),共培養(yǎng)細(xì)胞對(duì)肝癌HepG2/ADM細(xì)胞的殺傷作用與效靶比呈正相關(guān),且具有時(shí)間依賴(lài)性,差異有統(tǒng)計(jì)學(xué)意義(P<0.05),且Ag-DC-CIK細(xì)胞抗癌作用明顯優(yōu)于DC-CIK組(P<0.05)。見(jiàn)表3。

表3 共培養(yǎng)細(xì)胞對(duì)肝癌HepG2/ADM細(xì)胞的殺傷作用
注:與自然生長(zhǎng)組比較,*P<0.05;與相同效靶比的DC-CIK組比較,△P<0.05。
2.4 DC-CIK和Ag-DC-CIK共培養(yǎng)細(xì)胞對(duì)肝癌HepG2/ADM細(xì)胞內(nèi)mdr-1 mRNA表達(dá)的影響 根據(jù)前面的實(shí)驗(yàn)結(jié)果,將DC-CIK和Ag-DC-CIK按效靶比為10∶1與肝癌細(xì)胞HepG2/ADM共培養(yǎng),分別于培養(yǎng)24、48、72和96 h后收集各組細(xì)胞。采用RT-PCR法和凝膠電泳成像分析,在DC-CIK與HepG2/ADM共培養(yǎng)72 h后,細(xì)胞內(nèi)mdr-1 mRNA的表達(dá)量才有明顯的下降,作用96 h后,其表達(dá)下降更明顯,差異有統(tǒng)計(jì)學(xué)意義(P<0.05);而在A(yíng)g-DC-CIK與HepG2/ADM共培養(yǎng)48 h后,細(xì)胞內(nèi)mdr-1 mRNA的表達(dá)已有明顯降低,且隨著作用時(shí)間的延長(zhǎng),細(xì)胞內(nèi)的mdr-1 mRNA下降更明顯,差異有統(tǒng)計(jì)學(xué)意義(P<0.05),具有時(shí)間依賴(lài)性。而且,在48 h時(shí),與DC-CIK比較,Ag-DC-CIK對(duì)HepG2/ADM細(xì)胞內(nèi)mdr-1 mRNA的抑制作用較更明顯(P<0.05)。見(jiàn)圖1、表4。

注:A表示Ag-DC-CIK共培養(yǎng)細(xì)胞對(duì)肝癌HepG2/ADM細(xì)胞內(nèi)mdr-1 mRNA表達(dá)的影響;B表示DC-CIK共培養(yǎng)細(xì)胞對(duì)肝癌HepG2/ADM細(xì)胞內(nèi)mdr-1 mRNA表達(dá)水平的比較。

圖1 DC-CIK和Ag-DC-CIK共培養(yǎng)細(xì)胞對(duì)肝癌HepG2/ADM細(xì)胞內(nèi)mdr-1 mRNA表達(dá)的影響和比較
注:與0 h組相比,*P<0.05,**P<0.01;Ag-DC-CIK組與DC-CIK組相比,§P<0.01。
2.5 DC-CIK和Ag-DC-CIK共培養(yǎng)細(xì)胞對(duì)肝癌HepG2/ADM細(xì)胞內(nèi)P-gp蛋白表達(dá)水平的影響 將DC-CIK和Ag-DC-CIK按效靶比為10∶1與肝癌細(xì)胞HepG2/ADM共培養(yǎng),分別于培養(yǎng)24、48、72和96 h后收集各組細(xì)胞。采用WB法和凝膠成像分析,在DC-CIK與HepG2/ADM共培養(yǎng)48 h后,細(xì)胞內(nèi)P-gp蛋白的表達(dá)量有明顯的下降,作用72、96 h后,其表達(dá)下降更明顯,差異有統(tǒng)計(jì)學(xué)意義(P<0.01);在A(yíng)g-DC-CIK與HepG2/ADM共培養(yǎng)48 h后,細(xì)胞內(nèi)P-gp蛋白的表達(dá)也有明顯降低,且隨著作用時(shí)間的延長(zhǎng),細(xì)胞內(nèi)的P-gp蛋白表大量下降更明顯,具有時(shí)間依賴(lài)性差異有統(tǒng)計(jì)學(xué)意義(P<0.05)。而且,在72 h后,與DC-CIK比較,Ag-DC-CIK對(duì)HepG2/ADM細(xì)胞內(nèi)P-gp蛋白水平的抑制作用更明顯差異有統(tǒng)計(jì)學(xué)意義(P<0.05)。見(jiàn)圖2、表5。

注:A表示Ag-DC-CIK共培養(yǎng)細(xì)胞對(duì)肝癌HepG2/ADM細(xì)胞內(nèi)P-gp蛋白表達(dá)水平的影響;B表示DC-CIK共培養(yǎng)細(xì)胞對(duì)肝癌HepG2/ADM細(xì)胞內(nèi)P-gp蛋白表達(dá)水平的比較。

圖2 DC-CIK和Ag-DC-CIK共培養(yǎng)細(xì)胞對(duì)肝癌HepG2/ADM細(xì)胞內(nèi)P-gp蛋白表達(dá)水平的影響和比較
注:與0 h組比較,#P<0.05,##P<0.01;Ag-DC-CIK組與DC-CIK組比較,§P<0.01。
3 討 論
多藥耐藥(MDR)是指腫瘤細(xì)胞對(duì)一種抗腫瘤藥物產(chǎn)生抗藥性的同時(shí),對(duì)結(jié)構(gòu)和作用機(jī)制不同的多種抗腫瘤藥物產(chǎn)生交叉抗藥性,從而極大地降低了抗腫瘤藥物的療效。MDR的發(fā)生是許多種腫瘤化療失敗的主要原因,其形成的機(jī)理復(fù)雜多樣,而多藥耐藥基因mdr1編碼的P-gp過(guò)度表達(dá)是其重要原因之一,P-gp能夠?qū)⒂H脂類(lèi)化療藥物泵出細(xì)胞外,從而導(dǎo)致耐藥特性[4]。Mdr-1和P-gp在多種惡性腫瘤細(xì)胞中的過(guò)度表達(dá)是形成MDR的重要機(jī)制,也是腫瘤患者化療效果差、預(yù)后差、復(fù)發(fā)率高的重要原因,因此尋找有效的MDR逆轉(zhuǎn)劑一直是抗腫瘤研究的熱點(diǎn)[5-6]。
肝癌是消化系統(tǒng)最為常見(jiàn)的惡性腫瘤之一,針對(duì)因糖蛋白P-gp高表達(dá)引發(fā)MDR而導(dǎo)致的肝癌居高不下的發(fā)病率和死亡率,各種新型的治療策略正在迅速地被發(fā)掘,其中細(xì)胞免疫治療因其能提高肝癌患者的生存率和降低復(fù)發(fā)率而備受臨床醫(yī)生和患者的青睞。
CIK是一類(lèi)具有非MHC限制性的T細(xì)胞,具有強(qiáng)大的光譜的殺瘤效應(yīng),如肺癌、胃癌、乳腺癌等,而其主要的效應(yīng)細(xì)胞給CD3+和CD6+淋巴細(xì)胞[7-9]。DC分布于全身各處,它具有強(qiáng)大的抗原呈遞作用,它能激活初始型的T細(xì)胞增殖并建立初級(jí)免疫應(yīng)答。DC在體外可以通過(guò)多種細(xì)胞因子誘導(dǎo)生成。將DC與CIK共培養(yǎng),前者可識(shí)別病原、激活獲得性免疫系統(tǒng),后者通過(guò)發(fā)揮自身的細(xì)胞毒性與分泌細(xì)胞因子殺傷腫瘤細(xì)胞,因此能夠提高CIK的抗瘤療效。因此,在本研究中,通過(guò)利用DC-CIK聯(lián)合培養(yǎng),然后作用于多藥耐藥肝癌細(xì)胞株HepG2/ADM,效靶比在100∶1時(shí),顯示出了強(qiáng)大的抗肝癌細(xì)胞增殖作用,此種抗瘤作用隨時(shí)間延長(zhǎng)而增強(qiáng),并持續(xù)到96 h,具有時(shí)間依賴(lài)性。其可能的機(jī)制為DC表面有大量的樹(shù)突狀突起,使之有利于大量接觸抗原,提呈給T細(xì)胞;高表達(dá)MHCⅠ、Ⅱ類(lèi)分子及CD80/CD86等共刺激分子,為CIK細(xì)胞充分活化提供了有效的刺激,分泌出多種細(xì)胞因子,包括IL-12、IFN等,維持和增強(qiáng)CIK細(xì)胞的殺傷作用。進(jìn)一步研究還發(fā)現(xiàn),DC-CIK聯(lián)合培養(yǎng)后能夠顯著降低mdr-1 mRNA水平的表達(dá)及其編碼的P-gp蛋白水平的表達(dá),而且這種抑制作用也呈現(xiàn)時(shí)間依賴(lài)性(P<0.05)。
DC除能刺激初始型T細(xì)胞活化增殖外,還能把抗原有效的呈遞給T細(xì)胞,使T細(xì)胞對(duì)抗原蛋白酶致敏,從而殺死腫瘤細(xì)胞。將腫瘤細(xì)胞全部抗原信息(如提取的腫瘤細(xì)胞總RNA或經(jīng)過(guò)滅活的完整的腫瘤細(xì)胞)沖擊DC,可以有效地致敏和活化DC,促進(jìn)其分化成熟,增強(qiáng)其功能,因此,將負(fù)載有抗原的DC-CIK共培養(yǎng),可以提高CIK的抗瘤能力[10]。在本研究中,將肝癌HepG2/ADM細(xì)胞反復(fù)凍融制作的抗原負(fù)載于DC上,DC表面的共刺激分子(CD80、CD83和CD86)、MHCⅡ、CD3+CD8+和CD3+CD56+的表達(dá)均高于未負(fù)載抗原的DC,說(shuō)明負(fù)載了抗原的DC,其成熟度更高,抗原呈遞功能更強(qiáng)。進(jìn)一步的研究發(fā)現(xiàn),與未負(fù)載抗原的DC-CIK比較,負(fù)載抗原組的抗瘤作用明顯強(qiáng)于未負(fù)載抗原組,且效靶比在10∶1和100∶1時(shí)差異有統(tǒng)計(jì)學(xué)意義,此種差異隨著作用時(shí)間延長(zhǎng)而漸顯明顯(P<0.05);且細(xì)胞內(nèi)mdr-1 mRNA水平的表達(dá)以及其編碼的P-gp蛋白水平的表達(dá)明顯降低,也呈現(xiàn)時(shí)間依賴(lài)性(P<0.05)。
目前,負(fù)載有特異性的抗原DC瘤苗已運(yùn)用于臨床,此種瘤苗作為強(qiáng)有力的宿主免疫刺激物,具有超強(qiáng)的免疫應(yīng)答激發(fā)功能,能特異性的殺死腫瘤細(xì)胞,提高治療效果并無(wú)明顯毒副作用[11]。在本研究中,采用HepG2/ADM凍融抗原負(fù)載的DC-CIK,產(chǎn)生了比未負(fù)載抗原的DC-CIK細(xì)胞更有效殺傷mdr-1和P-gp高表達(dá)的多藥耐藥肝癌細(xì)胞HepG2/ADM的效應(yīng),這為肝癌的綜合治療指出了新的方向。
[1]Wang D,Zhang B,Gao H,et al.Clinical research of genetically modified dendritic cells in combination with cytokine-induced killer cell treatment in advanced renal cancer[J].BMC Cancer,2014,14(11):1-7.
[2]Shi SB,Tang XY,Tian J,et al.Efficacy of erlotinib plus dendritic cells and cytokine-induced killer cells in maintenance therapy of advanced non-small cell lung cancer[J].J Immunother,2014,37(4):250-255.
[3]Qu HQ,Zhou XS,Zhou XL,et al.Effect of DC-CIK cell on the proliferation,apoptosis and differentiation of leukemia cells[J].Asian Pac J Trop Med,2014,7(8):659-662.
[4]Leitner I,Nemeth J,Feurstein T,et al.The third generation P-glycoprotein inhibitor tariquidar may over come bacterial multidrug resistance by increasing intracellular drug concentration[J].Antimicrob Agents Chemother,2011,66(4):834-839.
[5]Liu Z,Duan ZJ,Chang JY,et al.Sinomenine sensitizes multidrug-resistant colon cancer cells(Caco-2) to doxorubicin by downregulation of MDR-1 expression[J].PLoS One,2014,9(6):e98560.[6]Oliveira RFF,Santos RE,Oliveira AL,et al.Prognostic assessment of polymorphisms of the MDR-1 and GSTP1 genes in patients with stage Ⅱ and Ⅲ breast cancer submitted to neoadjuvant chemotherapy[J].Breast J,2012,18(2):185-187.
[7]Jin C,Li J,Wang J,et al.Impact of cellular immune function on prognosis of lung cancer patients after cytokine-induced killer cell therapy[J].Asian Pac J Cancer Prev,2014,15(15):6009-6014.
[8]Du X,Jin R,Ning N,et al.In vivo distribution and antitumor effect of infused immune cells in a gastric cancer model[J].Oncol Rep,2012,28(5):1743-1749.
[9]Pan K,Guan XX,Li YQ,et al.Clinical activity of adjuvant cytokine-induced killer cell immunotherapy in patients with post-mastectomy triple-negative breast cancer[J].Clin Cancer Res,2014,20(11):3003-3011.
[10]岳玲玲,張連生,柴曄,等.負(fù)載抗原的DC與CIK共培養(yǎng)對(duì)耐藥乳腺癌細(xì)胞的殺傷作用[J].中國(guó)腫瘤生物治療雜志,2012,19(4):437-441.
[11]Shah AH,Bregy A,Heros DO,et al.Dendritic cell vaccine for recurrent high-grade gliomas in pediatric and adult subjects:clinical trial protocol[J].Neurosurgery,2013,73(5):863-867.
Killing effects of co-culture of antigen-loaded DC and CIK cells on multidrug resistant liver cancer HepG2/ADM and its potential mechanism*
XUQiao-yuan1,YANGZhi-xiang2△,LUOKuo2
(1.DepartmentofOncology,ChongqingFifthPeople′sHospital,Chongqing400062,China;2.DepartmentofOncology,ChongqingZhongshanHospital,Chongqing400013,China)
Objective To observe the killing effects of the antigen-loaded dendritic cells(DC) and cytokine-induced killer cells(CIK) on multidrug resistance liver cancer line HepG2/ADM with highly expressed permeability glycoprotein(P-gp) and to explore its potential mechanisms.Methods DC cells and CIK cells were induced from the peripheral blood in healthy volunteers ′by the conventional methods,and DC cells were impacted with HepG2/ADM cells after frozen-thawed antigen,which were co-cultured with CIK cells for 24,48,72,96 h respectively.The DC cells without antigen-loading and CIK cells were co-cultured as control.The cell phenotype of DC and CIK was identified by the flow cytometry,the cell proliferation vitality of HepG2/ADM was detected by CCK-8;The expression of mdr-1 mRNA was determined by realtime-PCR,the P-gp protein level was detected by Western blot.Results Compared with non-antigen-loaded DC-CIK group,the expression of surface molecules in the antigen-loaded DC-CIK group was significantly increased(P<0.05),the vitality of HepG2 cells was inhibited more significantly(P<0.05).The RT-PCR and Western blot results showed that with the time extension,the expression of mdr-1 mRNA and P-gp protein both were significantly decreased in the above two groups respectively(P<0.05);Furthermore,the inhibitory effects was more significant in the antigen-loaded group(P<0.05).Conclusion The co-culture of DC and CIK after antigen impact could improve its killing activity to multidrug-resistant HepG2/ADM cell line,its potential mechanism may be via inhibiting the MDR closely related mdr-1 gene expression and its encoded P-gp protein level.
cytokine-induced killer cells; dendritic cells; multidrug-resistance; P-gp; HepG2/ADM cells
重慶市渝中區(qū)科技計(jì)劃項(xiàng)目(20120225)。
徐巧元,女,副主任醫(yī)師,碩士,主要從事腫瘤學(xué)方面的研究。△
,E-mail:yzhixiang122@tom.com。
10.3969/j.issn.1672-9455.2015.15.009
A
1672-9455(2015)15-2161-04
2015-02-28
2015-05-15)

