犬瘟熱病毒囊膜糖蛋白在桿狀病毒-昆蟲細胞系統中的表達及鑒定
虞一聰,馮 娜,閆飛虎,蓋微微,王鐵成,王化磊,3,鄭學星,3,趙永坤,3,黃 耕,楊松濤,高玉偉,夏咸柱,3,4*
(1.吉林農業大學動物科學技術學院,長春 130118;2.軍事醫學科學院軍事獸醫研究所,吉林省人獸共患病預防與控制重點實驗室,長春 130122;3.中國農業科學院長春獸醫研究所,長春 130122;4.江蘇省動物重要疫病與人獸共患病防控協同創新中心,揚州 225009)
犬瘟熱病毒囊膜糖蛋白在桿狀病毒-昆蟲細胞系統中的表達及鑒定
虞一聰1,2,馮 娜2,3*,閆飛虎2,蓋微微2,王鐵成2,王化磊2,3,鄭學星2,3,趙永坤2,3,黃 耕2,楊松濤2,高玉偉2,夏咸柱2,3,4*
(1.吉林農業大學動物科學技術學院,長春 130118;2.軍事醫學科學院軍事獸醫研究所,吉林省人獸共患病預防與控制重點實驗室,長春 130122;3.中國農業科學院長春獸醫研究所,長春 130122;4.江蘇省動物重要疫病與人獸共患病防控協同創新中心,揚州 225009)
為表達具有天然構象的犬瘟熱病毒(CDV)囊膜糖蛋白融合蛋白(F)和血凝素蛋白(H),本研究擴增小熊貓源CDV馴化致弱株LP的F、H基因,克隆至pFastBacTM1載體中,測序驗證后轉化至DH10BacTM感受態細胞,同源重組獲得穿梭質粒rBacmid-F、rBacmid-H,將其分別轉染Sf9細胞獲得重組桿狀病毒rpFB-F、rpFB-H,并將表達的重組融合蛋白(rF)和血凝素蛋白(rH)進行IFA和Western blot鑒定。以犬抗CDV高免血清對重組桿狀病毒感染細胞進行IFA鑒定,在感染細胞的細胞膜上可見特異性熒光反應;以鼠抗F、H蛋白的主要抗原表位區多克隆抗體對重組桿狀病毒感染細胞進行Western blot檢測,可見相對分子質量為63和68 ku左右的條帶,分別為重組融合蛋白(rF)和血凝素蛋白(rH),大小與預期相符。兩種囊膜糖蛋白在桿狀病毒-昆蟲細胞系統中均成功表達,且具有良好的反應原性。本研究為CDV病毒樣顆粒疫苗的開發等工作奠定了基礎。
犬瘟熱病毒;融合蛋白;血凝素蛋白;桿狀病毒-昆蟲細胞系統
犬瘟熱(canine distemper,CD)是由副黏病毒科麻疹病毒屬的犬瘟熱病毒(canine distemper virus,CDV)引起犬科動物的一種高度傳染性、致死性疾病,全世界廣泛分布[1]。該病的傳染性強,發病率高,臨床癥狀多樣,容易繼發混合感染和二次感染[2]。近年來,CDV自然感染宿主不斷擴大,除犬科動物外,還可感染大熊貓、小熊貓和虎等珍稀野生動物[3-5],且已擴大到非人靈長類動物[6],嚴重危害我國乃至世界養犬業、經濟動物養殖業和野生動物保護業。目前對 CD 尚無特效的治療藥物和方法,疫苗接種是唯一有效的防制措施[7]。
CDV為單股、負鏈、不分節段的RNA病毒。其主要結構蛋白有核衣殼蛋白(N)、磷蛋白(P)、大蛋白(L)、基質膜蛋白(M)、融合蛋白(F)、附著或血凝素蛋白(H)。負鏈RNA基因組被螺旋形衣殼包裹,形成核衣殼結構,外面由雙層囊膜包裹。CDV囊膜上有1.3 nm的桿狀纖突,纖突由兩種囊膜糖蛋白F和H蛋白組成,纖突只含血凝素,而無神經氨酸酶[8]。融合蛋白(F)和血凝素蛋白(H)是病毒的主要結構蛋白,在病毒侵入宿主細胞的過程中共同介導細胞膜發生融合,同時也是誘導中和抗體的主要免疫原[9]。H蛋白使病毒趨向并接近敏感細胞,F蛋白是病毒和宿主細胞融合過程中所必需的,在病毒感染過程中,H和F蛋白兩者缺一不可。具有中和活性的抗H蛋白抗體和抑制細胞融合的抗F抗體,在抗犬瘟熱病毒的感染機制中也發揮了重要的作用[10]。本研究以實驗室馴化致弱的小熊貓源CDV LP毒株為模板擴增F、H基因,并將目的基因克隆到表達載體pFastBacTM1,利用桿狀病毒-昆蟲細胞表達系統進行表達,并以犬抗CDV高免血清及鼠抗CDV F、H蛋白多克隆抗體對重組病毒蛋白質進行反應原性鑒定,為后期亞單位疫苗尤其是病毒樣顆粒疫苗的開發奠定了基礎。
1 材料與方法
1.1 材料
桿狀病毒表達系統(Bac-to-Bac?Baculovirus Expression System)、Lipofectamine?2000轉染試劑和Sf9細胞購自Invitrogen 公司;ExTaqDNA聚合酶、T4DNA連接酶、限制性內切酶購自大連寶生物技術公司;質粒快速提取試劑盒、DNA膠回收純化試劑盒購自OMEGA biotek公司;基因組DNA提取試劑盒購自Axygen公司;Grace’s昆蟲培養基購自AppliChem 公司;BacPAKTMBaculovirus Rapid Titer Kit試劑盒購自Clontech公司;His標簽鎳離子蛋白純化柱(HisPurTMNi-NTA Spin Columns)和SuperSignal West Dura持久性化學發光底物購自Thermo scientific公司;熒光素(FITC)標記羊抗犬IgG 購自Sigma-Aldrich公司;辣根過氧化物酶(HRP)標記兔抗鼠IgG購自Bioworld公司。
CDV LP馴化致弱毒株F、H基因cDNA克隆質粒pMD18-T-CDV-F、pMD18-T-CDV-H、感受態細胞E.coliDH5α、BL21(DE3)、犬抗CDV高免血清均由軍事醫學科學院軍事獸醫研究所動物病毒學與特種動物疫病學實驗室保存;6周齡BALB/c小鼠購自長春生物制品研究所實驗動物中心。
1.2 目的基因的擴增及純化
以pMD18-T-CDV-F和pMD18-T-CDV-H為模板,PCR擴增F、H基因(CDV F For:5′-CGAGGATCCATGCACAACAAAATCCCCAAAATAT-CC-3′,CDV F Rev:5′-ATAGCGGCCGCTCAGA-GTGATCTTACATAGG-3′;CDV H For:5′-CGA-GGATCCATGCTCTCCTACCAAGA-3′,CDV H Rev:5′-ATAGCGGCCGCTCAAGGTTTTGAACGG-3′;下劃線部分為BamHⅠ、NotⅠ酶切位點)。反應體系:ExTaqDNA聚合酶(5 U·μL-1)0.5 μL,反轉錄產物cDNA 8 μL,上、下游引物(20 μmol·L-1)各1 μL,dNTP(2.5 mmol·L-1)4 μL,10× ExTaqBuffer 5 μL,加ddH2O補足至總體積50 μL。反應條件:94 ℃預變性5 min;94 ℃變性30 s,55 ℃退火30 s,72 ℃延伸2 min,共33個循環;72 ℃延伸10 min。擴增的目的片段膠回收純化后4 ℃保存。
1.3 重組供體質粒的構建
將目的片段和pFastBacTM1載體均分別用BamHⅠ、NotⅠ進行雙酶切,37 ℃作用2 h,酶切片段和載體純化后在T4DNA連接酶作用下于16 ℃連接過夜。連接體系(20 μL):載體4 μL,目的片段10 μL,10×緩沖液2 μL,T4DNA連接酶2 μL,用ddH2O補足至總體積20 μL。連接產物轉化至感受態細胞E.coliDH5α。提取陽性重組質粒pFastBacTM1-F和pFastBacTM1-H,經PCR及雙酶切鑒定正確后送至長春庫美生物公司測序。
1.4 重組穿梭質粒的構建
參考Invitrogen公司Bac-to-Bac?Baculovirus Expression System操作手冊,分別將測序正確的重組質粒pFastBacTM1-F和pFastBacTM1-H轉化至含桿狀病毒穿梭載體的感受態細胞DH10BacTM,37 ℃培養48 h,通過藍白斑篩選,挑取白色陽性菌落,抽提純化重組桿狀病毒質粒,并用M13通用引物和CDV FF/CDV FR、CDV HF/CDV HR同時進行PCR鑒定,將鑒定為陽性的質粒分別命名為rBacmid-F和rBacmid-H。
1.5 重組桿狀病毒的制備
利用脂質體Lipofectamine?2000將rBacmid-F和rBacmid-H轉染Sf9細胞,于27 ℃培養96 h,待細胞出現病變后,收集細胞上清獲得重組桿狀病毒。基因組DNA提取試劑盒抽提病毒基因組DNA,分別用M13通用引物和特異性引物PCR驗證CDVF和H基因在純化病毒中是否獲得穩定重組,重組病毒分別命名為rpFB-F和rpFB-H。擴增種毒至第3代,并按BacPAKTMBaculovirus Rapid Titer Kit試劑盒對種毒進行滴定,于4 ℃保存備用。
1.6 間接免疫熒光
將上述rpFB-F和rpFB-H種毒液按1∶20體積比感染Sf9細胞,并以野生型桿狀病毒作為對照,于27 ℃培養48 h,棄細胞上清液,用PBS洗滌后用3%多聚甲醛室溫固定30 min。以1∶100倍稀釋的犬高免血清和犬陰性血清為一抗,室溫孵育1 h。PBST洗滌后加入1∶200倍稀釋的熒光素(FITC)標記的羊抗犬二抗,室溫避光作用1 h,PBST洗滌后熒光顯微鏡(Olympus Corp,Tokyo,Japan)觀察結果。
1.7 F和H蛋白主要抗原表位區多克隆抗體的制備
1.7.1 F和H片段的原核表達 應用在線生物分析軟件BepiPred分析CDV LP弱毒株F、H蛋白的氨基酸序列,預測F、H基因的主要抗原表位區片段,去除跨膜區和信號肽序列,結合pET-30a(+)表達載體,利用Primer Premier 5.0軟件,分別設計合成CDV-F-pET30-F 5′-GAATTCCAATCCAACCTCAATGC-3′(下劃線部分為EcoRⅠ酶切位點)和CDV-F-pET30-R 5′-CTCGAGCCTAACCGT-CTCAAGG-3′(下劃線部分為XhoⅠ酶切位點)為引物PCR擴增F基因1 050 bp片段(第751—1 800 bp);分別設計合成CDV-H-pET30-F 5′-GATATCATCTCAGACGGAGTGTAT-3′(下劃線部分為EcoRⅤ酶切位點)和CDV-H-pET30-R 5′-CTCGAGGGTTGTAAAGTTGGTGATGT-3′(下劃線部分為XhoⅠ酶切位點)為引物PCR擴增H基因1 104 bp片段(第667—1 770 bp)。分別以pMD18-T-CDV-F和pMD18-T-CDV-H為模板PCR擴增F、H蛋白胞外主要抗原表位區(體系同1.2),克隆至pET-30a(+)表達載體,構建成與His標簽融合表達的重組質粒pET-30a(+)-Fec、pET-30a(+)-Hec,轉化BL21(DE3)表達菌株后,經IPTG誘導融合蛋白質表達。表達的目的蛋白質經His標簽鎳離子蛋白質純化柱(HisPurTMNi-NTA Spin Columns)純化后,進行SDS-PAGE分析。
1.7.2 重組抗原免疫血清的制備 將純化的重組F、H蛋白與弗氏完全佐劑等體積乳化,肌肉注射免疫6周齡BALB/c小鼠,50 μg·只-1。2周后將重組蛋白質與弗氏不完全佐劑等體積乳化進行第2和第3次免疫,間隔2周。三免后2周眼球采血,分離血清。
1.8 Western blot
參照文獻方法進行[11]。將上述rpFB-F和rpFB-H種毒液按1∶10體積比感染正常Sf9細胞,72 h后3 000 r·min-1離心10 min收獲感染細胞,PBS離心洗滌,按原培養液10%體積加入PBS懸起細胞,反復凍融3次,離心后收獲上清,制備成細胞裂解抗原液進行SDS-PAGE電泳,并電轉印至PVDF膜,封閉液室溫封閉2 h;分別以鼠抗CDV F、H蛋白主要抗原表位區多克隆抗體(1∶100倍稀釋)為一抗,4 ℃孵育過夜;以辣根過氧化物酶(HRP)標記兔抗鼠IgG(1∶2 000倍稀釋)為二抗,室溫孵育1 h,加入SuperSignal West Dura持久性化學發光底物進行檢測。
2 結 果
2.1 含目的基因的重組Bacmid的篩選與鑒定
首先將CDV F和H基因亞克隆至pFastBacTM1,將鑒定正確的穿梭質粒pFastBacTM1-F和pFastBacTM1-H轉化至DH10BacTM感受態細胞后,經含卡那霉素、四環素和慶大霉素的平板篩選,抽提質粒分別進行PCR鑒定,以M13F/M13R為引物PCR擴增出長度約為4 289 bp和4 124 bp的特異產物,以CDV FF/CDV FR和CDV HF/CDV HR為引物獲得約為1 989 bp和1 824 bp的特異產物,與理論值相符(圖1),表明重組桿狀病毒表達質粒rBacmid-F和rBacmid-H構建成功。
2.2 重組桿狀病毒的制備
將rBacmid-F和rBacmid-H分別轉染對數生長期的Sf9細胞,27 ℃連續培養96 h,收獲P1代重組桿狀病毒,然后將重組桿狀病毒連續傳3代,感染Sf9細胞48 h后均可見細胞變大、變圓,細胞間隙增大,停止生長,由貼壁變為脫落漂浮,感染末期細胞溶解破裂等典型致細胞病變效應。將擴增的第三代種毒rpFB-F P3用BacPAKTMBaculovirus Rapid Titer Kit試劑盒對種毒進行滴定,鏡下可見散在的染色斑點,結果顯示,rpFB-F滴度為8.0×107IFU·mL-1(圖2),應用同樣的方法測得rpFB-H P3滴度為8.4×107IFU·mL-1。
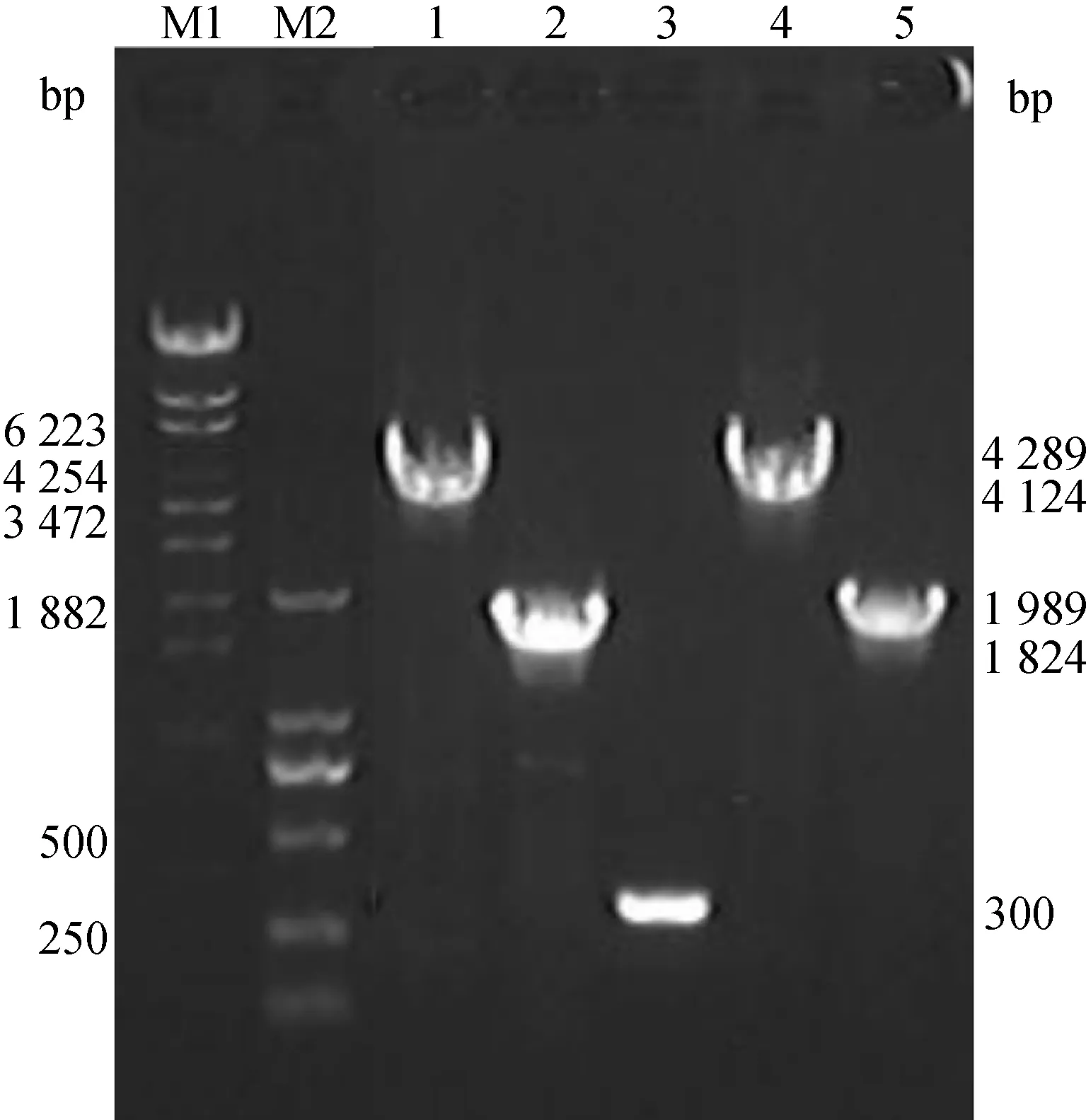
M1.DNA相對分子質量標準;M2.DNA相對分子質量標準;1.M13引物鑒定重組質粒rBacmid-H;2.特異性引物鑒定重組質粒rBacmid-H;3.M13引物鑒定Bacmid陰性對照;4.M13引物鑒定重組質粒rBacmid-F;5.特異性引物鑒定重組質粒rBacmid-FM1.λ-EcoT14 I digest DNA marker;M2.DL2000 DNA marker;1.PCR products from rBacmid-H with M13F/M13R;2.PCR products from rBacmid-H with CDV HF/HR;3.PCR products from Bacmid with M13F/F13R;4.PCR products from rBacmid-F with M13F/M13R;5.PCR products from rBacmid-F with CDV FF/FR圖1 重組質粒rBacmid-F和rBacmid-H的鑒定Fig.1 Identification of rBacmid-F and rBacmid-H
2.3 重組桿狀病毒 IFA 鑒定
分別以rpFB-F和rpFB-H感染Sf9細胞48 h,棄細胞上清液,用3%多聚甲醛室溫固定30 min以犬抗CDV高免血清為一抗及FITC標記羊抗犬IgG為二抗進行免疫熒光染色。熒光顯微鏡觀察可見rpFB-F和rpFB-H感染Sf9細胞膜均顯示較強的陽性熒光信號(圖3A和3B),而野生型桿狀病毒感染Sf9細胞(圖3C)和未感染病毒細胞的熒光信號均呈陰性(圖3D)。結果表明重組桿狀病毒能在昆蟲細胞中高效表達CDV囊膜糖蛋白,且能夠被犬抗CDV高免血清特異性識別。
2.4 F和H蛋白主要抗原表位區的原核表達及多克隆抗體的制備
將pET-30a(+)-Fec、pET-30a(+)-Hec分別轉化至E.coliBL21(DE3),經IPTG誘導后以鎳離子蛋白質純化柱對目的蛋白質進行純化,SDS-PAGE可見單一的大小約為40和46 ku的目的片段(圖4)。將純化的重組F、H蛋白與弗氏佐劑乳化后,肌肉注射連續免疫3次,每次間隔2周,制備鼠多克隆抗體。
2.5 重組CDV F和H蛋白Western blot檢測
Western blot檢測桿狀病毒表達的重組融合蛋白(rF)和血凝素蛋白(rH)與鼠抗主要抗原表位區多克隆抗體的反應性,結果顯示分別在63和68 ku左右處有清晰的特異的反應條帶,大小與預期值相符(圖5),表明獲得的兩種重組蛋白質具有良好的反應原性。
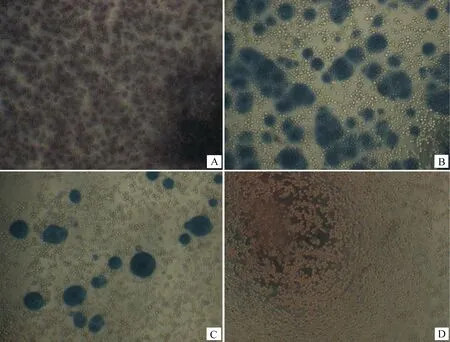
A.重組桿狀病毒103稀釋;B.重組桿狀病毒104稀釋;C.重組桿狀病毒105稀釋;D.陰性對照A.Dilutions of 103 of recombinant baculovirus;B.Dilutions of 104 of recombinant baculovirus;C.Dilutions of 105 of recombinant baculovirus;D.Negative control圖2 重組桿狀病毒rpFB-F滴定Fig.2 Titration of recombinant baculovirus rpFB-F
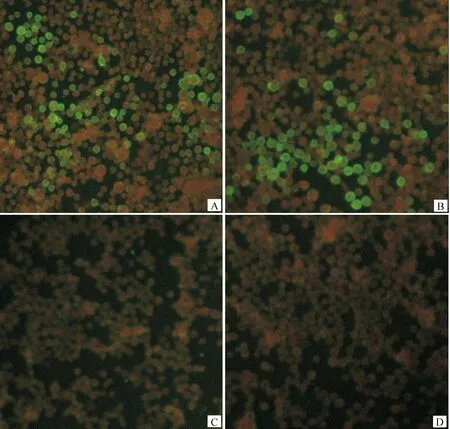
A.重組桿狀病毒rpFB-F感染的Sf9細胞;B.重組桿狀病毒rpFB-H感染的Sf9細胞;C.野生型桿狀病毒感染的Sf9細胞;D.正常Sf9細胞對照A.Sf9 cells infected with rpFB-F;B.Sf9 cells infected with rpFB-H;C.Sf9 cells infected with wild baculovirus;D.Normal Sf9 cells as control group圖3 IFA檢測重組蛋白質rF和 rH的表達Fig.3 Identification of expressed rF and rH by IFA
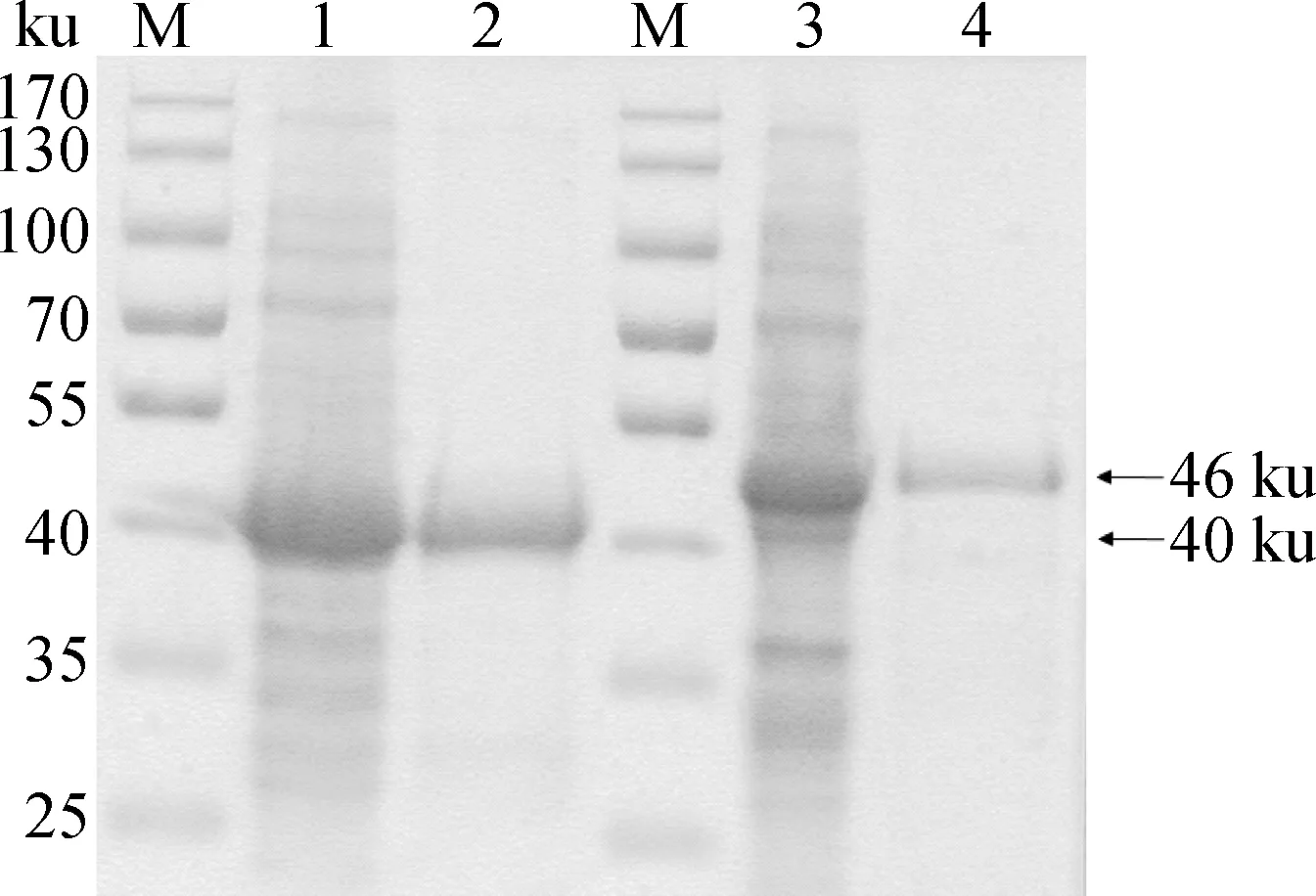
M.蛋白質相對分子質量標準;1.未純化F蛋白SDS-PAGE檢測;2.純化F蛋白SDS-PAGE檢測;3.未純化H蛋白SDS-PAGE檢測;4.純化H蛋白SDS-PAGE檢測M.Protein molecular weight marker;1.Detection of unpurified F protein by SDS-PAGE;2.Detection of purified F protein by SDS-PAGE;3.Detection of unpurified H protein by SDS-PAGE;4.Detection of purified H protein by SDS-PAGE圖4 原核表達F、H蛋白的SDS-PAGE檢測Fig.4 Detection of prokaryotic expressed F and H protein by SDS-PAGE

M.蛋白質相對分子質量標準;1.野生型桿狀病毒感染的Sf9細胞;2.重組桿狀病毒rpFB-F感染的Sf9細胞;3.野生型桿狀病毒感染的Sf9細胞;4.重組桿狀病毒rpFB-H感染的Sf9細胞M.Protein molecular weight marker;1.Sf9 cells infected with wild baculovirus;2.Sf9 cells infected with rpFB-F;3.Sf9 cells infected with wild baculovirus;4.Sf9 cells infected with rpFB-H圖5 重組蛋白質rF和rH的Western blot檢測Fig.5 Detection of rF and rH by Western blot
3 討 論
犬瘟熱呈世界性分布,擁有廣泛的哺乳動物宿主[12-13]。疫苗免疫在20世紀20年代已有研究和使用,滅活疫苗因誘導產生的抗體下降快,抗原性差且僅能誘導體液免疫,免疫時間短等缺點,現已很少使用[14]。國內外對犬瘟熱的預防仍然主要依賴于弱毒疫苗,由于不同動物對CDV 的敏感性存在差異,弱毒苗對野生食肉動物和某些免疫缺陷幼犬的毒力過強、安全性差[15-16],且在使用過程中存在熱穩定差、易受母源抗體干擾等缺陷[17]。因此,亟需更安全有效的新型疫苗防控犬瘟熱的流行,其中基因工程疫苗是研究開發的主要方向。
研究表明囊膜糖蛋白(F、H)是產生CDV中和抗體的主要保護性抗原,是基因工程亞單位疫苗主要候選抗原。犬瘟熱病毒對理化因素極為敏感,難以通過常規純化病毒的方法獲得主要保護性抗原,因此基因工程表達成了制備亞單位疫苗的有效技術手段。當前國內外關于犬瘟熱結構蛋白基因的表達,多是利用原核表達系統表達截短蛋白序列,很少有全長序列的報道,且表達產物易受空間構象影響。桿狀病毒-昆蟲細胞表達系統是一個以昆蟲桿狀病毒為外源基因載體,以昆蟲細胞或昆蟲為受體的表達系統,由于其操作簡便、生產周期短,對人及其他哺乳動物無危害,表達產物可被正確地加工修飾,形成天然構象,具有完整的生物學功能,已被公認為是當今基因工程四大表達系統之一[18-21]。目前,已有多種利用該系統表達制備的亞單位疫苗通過批準上市[22-23]。
國內很多研究者都嘗試利用桿狀病毒表達麻疹病毒屬成員囊膜糖蛋白。全傳松等[24]、隋修錕等[25]分別利用桿狀病毒表達系統在昆蟲細胞中成功表達了CDV 和小反芻獸疫病毒(peste des petits ruminants virus,PPRV)H蛋白。目前尚未有CDV F蛋白在昆蟲細胞成功表達的報道。馮佩平[26]分別構建了表達犬瘟熱病毒主要結構蛋白N、F和H的重組桿狀病毒,通過Western blot、間接免疫熒光證明N蛋白和H蛋白獲得了成功表達,然而F基因僅在表達后的細胞液中測得,Western blot并沒有如期檢測到F蛋白。同樣,有研究認為PPRV F蛋白在昆蟲細胞中可以獲得轉錄卻無法翻譯,分析稱密碼子偏嗜性也許是影響多肽翻譯的因素之一[27]。病毒樣顆粒(virus-like particles,VLPs)疫苗作為新型的亞單位疫苗既能激發體液免疫,又能激發細胞和黏膜免疫;且不含病毒核酸,不能復制,具有安全、高效的特點,是很有發展前景的候選疫苗。對同屬的PPRV病毒樣顆粒疫苗的研究表明,共表達基質蛋白M與表面糖蛋白(F、H)所形成VLPs的大小與真實病毒粒子相似,同時又具有足夠的保護性抗原[28]。由此可見,重組桿狀病毒表達犬瘟熱病毒囊膜糖蛋白是制備犬瘟熱病毒樣顆粒疫苗的必要前提。
4 結 論
成功構建表達CDV 囊膜糖蛋白F、H的重組桿狀病毒,IFA和Western bolt檢測結果表明F和H蛋白分別在感染昆蟲細胞中得到成功表達,并且與犬抗CDV高免血清及鼠抗F、H蛋白主要抗原表位區的多克隆抗體均具有良好的反應原性,這為后期利用重組桿狀病毒包裝犬瘟熱病毒樣顆粒,開發安全、有效的亞單位疫苗尤其是病毒樣顆粒疫苗奠定了物質基礎。
[1] WANG F,YAN X,CHAI X,et al.Differentiation of canine distemper virus isolates in fur animals from various vaccine strains by reverse transcription-polymerase chain reaction-restriction fragment length polymorphism according to phylogenetic relations in China[J].VirolJ,2011,8:85.
[2] 蔡寶祥.家畜傳染病學 [M].2版.北京:中國農業出版社,1999:301-304. CAI B X.Livestock infectious disease [M].2ed edition.Beijing:China Agriculture Press,1999:301-304.(in Chinese)
[3] APPEL M J G,MONTALI R J.Canine distemper and emerging morbillivirus diseases in exotic species[C].ProcAmAssocZooVet,1994:336-339.
[4] 李金中,夏咸柱,邱 薇,等.小熊貓等四種動物犬瘟熱病毒的分離與鑒定[J].中國獸醫科技,1998,28(8):8-10. LI J Z,XIA X Z,QIU W,et al.Isolation and identification of canine distemper virus from lesser panda,dog,raccoon dog and fox[J].ChineseJournalofVeterinaryScienceandTechnology,1998,28(8):8-10.(in Chinese)
[5] 胡桂學,夏咸柱,李金中.大熊貓犬瘟熱致死性感染的首次報告[C].中國微生物學會獸醫微生物學學術年會論文集.北京,1997,1(997):1. HU G X,XIA X Z,LI J Z.The first report of giant panda infected with lethal canine distemper[C].Chinese Society for Microbiology Veterinary Microbiology Academic Conference.Beijing,1997,1(997):1.(in Chinese)
[6] QIU W,ZHENG Y,ZHANG S,et al.Canine distemper outbreak in rhesus monkeys,China[J].EmergInfectDis,2011,17(8):1541-1543.
[7] NORRIS J M,KROCKENBERGER M B,BAIRD A A,et al.Canine distemper:re-emergence of an old enemy[J].AustVetJ,2006,84(10):362-363.
[8] 殷 震,劉景華.動物病毒學 [M].2版.北京:科學出版社,1997:756-762. YIN Z,LIU J H.Animal virology[M].2ed edition.Beijing:Science Press,1997:756-762.(in Chinese)
[9] VON MESSLING V,ZIMMER G,HERRLER G,et al.The hemagglutinin of canine distemper virus determines tropism and cytopathogenicity[J].JVirol,2001,75(14):6418-6427.
[10] 潘耀謙.犬瘟熱發病機理的免疫及分子病理學研究——腦組織及淋巴器官病變觀察[D].北京:中國農業大學,2005. PAN Y Q.Studies of pathogenesis of immune and molecular pathology on dogs with canine distemper—pathologic observation in brain tissues and lymphatic tissues[D].Beijing:China Agricultural University,2005.(in Chinese)
[11] 薩姆布魯克 J,弗里奇 E F,曼尼阿蒂斯 T.分子克隆實驗指南[M].2版.北京:科學出版社,1993:674-683. SAMBMOK J,FRITSEH E F,MANIATIS T.Molecular cloning a laboratory manual[M].2ed edition.Beijing:Science Press,1993:674-683.(in Chinese)
[12] DEEM S L,SPELMAN L H,YATES R A,et al.Canine distemper in terrestrial carnivores:a review[J].JZooWildlMed,2000,31(4):441-451.
[13] MARTELLA V,ELIA G,BUONAVOGLIA C.Canine distemper virus[J].VetClinNorthAmSmallAnimPract,2008,38(4):787-797.
[14] 孔慶波.犬瘟熱免疫預防研究進展[J].動物醫學進展,2007,28(6):69-75. KONG Q B.Progress on immune prevention of canine distemper[J].ProgressinVeterinaryMedicine,2007,28(6):69-75.(in Chinese)
[15] BARRETT T.Morbillivirus infections,with special emphasis on morbilliviruses of carnivores[J].VetMicrobiol,1999,69(1-2):3-13.
[16] 王 磊,李天松,劉玉秀,等.犬瘟熱新型疫苗研究進展[J].動物醫學進展,2011,32(3):99-103. WANG L,LI T S,LIU Y X,et al.Progress on new type vaccines of canine distemper[J].ProgressinVeterinaryMedicine,2011,32(3):99-103.(in Chinese)
[17] WELTER J,TAYLOR J,TARTAGLIA J,et al.Vaccination against canine distemper virus infection in infant ferrets with and without maternal antibody protection,using recombinant attenuated poxvirus vaccines[J].JVirol,2000,74(14):6358-6367.
[18] 高炳淼,李寶珠,于津鵬,等.外源基因在昆蟲桿狀病毒表達系統中的表達[J].中國生物工程雜志,2011,31(11):123-129. GAO B M,LI B Z,YU J P,et al.Expression of foreign genes in insect baculovirus expression systems[J].ChinaBiotechnology,2011,31(11):123-129.(in Chinese)
[19] AILOR E,BETENBAUGH M J.Modifying secretion and post-translational processing in insect cells[J].CurrOpinBiotechnol,1999,10(2):142-145.
[21] SANDOVAL C,CURTIS H,CONGOTE L F.Enhanced proliferative effects of a baculovirus-produced fusion protein of insulin-like growth factor and α1-proteinase inhibitor and improved anti-elastase activity of the inhibitor with glutamate at position 351[J].ProteinEng,2002,15(5):413-418.
[22] FRAZER I H.Cervical cancer vaccine development[J].SexHealth,2010,7(3):230-234.
[23] MENA J A,KAMEN A A.Insect cell technology is a versatile and robust vaccine manufacturing platform[J].ExpertRevVaccines,2011,10(7):1063-1081.
[24] 全傳松,姜 騫,于 作,等.犬瘟熱病毒血凝蛋白在昆蟲細胞中的表達與抗原性分析[J].中國畜牧獸醫,2014,41(8):25-29. QUAN C S,JIANG Q,YU Z,et al.Expression of hemagglutinin of canine distemper virus in the insect cell and its antigenic analysis[J].ChinaAnimalHusbandry&VeterinaryMedicine,2014,41(8):25-29.(in Chinese)
[25] 隋修錕,金紅巖,李文超,等.小反芻獸疫病毒H基因在桿狀病毒中的表達及其免疫原性研究[J].畜牧獸醫學報,2014,45(6):974-980. SUI X K,JIN H Y,LI W C,et al.Expression ofHgene of Peste des Petits Ruminants virus in baculovirus and its immunogenicity study[J].ActaVeterinariaetZootechnicaSinica,2014,45(6):974-980.(in Chinese)
[26] 馮佩平.犬瘟熱病毒主要結構蛋白基因在昆蟲細胞中的表達及間接 ELISA 檢測方法的建立[D].長春:吉林農業大學,2012. FENG P P.Expression of CDV major structural protein in Sf9 cells and establishment of indirect ELISA assay[D].Changchun:Jilin Agricultural University,2012.(in Chinese)
[27] 劉拂曉.小反芻獸疫病毒樣顆粒的構建及對小鼠免疫效力的評價[D].長春:吉林大學,2013. LIU F X.Construction of Peste des Petits Ruminants virus-like particles and evaluation of their immune effects in mice[D].Changchun:Jilin University,2013.(in Chinese)
[28] LI W,JIN H,SUI X,et al.Self-assembly and release of peste des petits ruminants virus-like particles in an insect cell-baculovirus system and their immunogenicity in mice and goats[J].PLoSOne,2014,9(8):e104791.
(編輯 白永平)
Expression and Identification of Glycoprotein of Canine Distemper Virus in the Baculovirus-Insect Cell System
YU Yi-cong1,2,FENG Na2,3*,YAN Fei-hu2,GAI Wei-wei2,WANG Tie-cheng2,WANG Hua-lei2,3,ZHENG Xue-xing2,3,ZHAO Yong-kun2,3,HUANG Geng2,YANG Song-tao2,GAO Yu-wei2,XIA Xian-zhu2,3,4*
(1.CollegeofAnimalScienceandTechnology,JilinAgriculturalUniversity,Changchun130118,China;2.KeyLaboratoryofZoonosisPreventionandControlofJilinProvince,MilitaryVeterinaryInstituteoftheAcademyofMilitaryMedicalSciences,Changchun130122,China;3.ChangchunVeterinaryResearchInstitute,ChineseAcademyofAgriculturalSciences,Changchun130122,China; 4.JiangsuCo-innovationCenterforPreventionandControlofImportantAnimalInfectiousDiseasesandZoonosis,Yangzhou225009,China)
The objectives of this study were to express the native structure of fusion protein (F) and hemagglutinin glycoprotein (H) of canine distemper virus (CDV).TheFandHgene of lesser panda attenuated strain were amplified by PCR and cloned into pFastBacTM1 vector.The recombinant plasmids were sequenced,and then were transformed into competent DH10BacTME.colicells to construct shuttle plasmids,rBacmid F and rBacmid H,by homologous recombination.The recombinant plasmids were then transfected into Sf9 cells to construct recombinant baculoviruses and the expression products of rF and rH were identified with IFA and Western blot.The expression of rF and rH in insect cells infected with recombinant baculoviruses were identified by IFA with dog anti-CDV hyperimmune serum and were detected by Western blot with mouse polyclonal antibody against F and H major epitopes of CDV.The molecular weight of expressed F and H protein were identified as 63 and 68 kD,which were consistent with the expected value.The results show that both envelope glycoproteins are successfully expressed in baculovirus-insect cell expression system and have a good immunoreactivity.Our study laid the foundation for the development of the CDV virus-like particle vaccine.
canine distemper virus;fusion protein;attachment glycoprotein;baculovirus-insect cell system
10.11843/j.issn.0366-6964.2015.06.014
2014-09-28
國家公益性行業(農業)科研專項(201303042)
虞一聰(1989-),男,浙江慈溪人,碩士生,主要從事動物分子病毒學研究,E-mail:jordanyuyicong@163.com
*通信作者:夏咸柱,E-mail:xiaxzh@cae.cn;馮 娜,E-mail:fengna0308@126.com
S852.659.5
A
0366-6964(2015)06-0981-08

