α-硫辛酸對慢性腦低灌注大鼠腦單胺類神經遞質和單胺氧化酶的影響
趙冉冉,徐曉臣,王 玲,路志民,張文忠,劉吉祥
(邯鄲市第一醫院急診科1、神經內科2、泌尿科3、神經外科4,河北 邯鄲 056002)
α-硫辛酸對慢性腦低灌注大鼠腦單胺類神經遞質和單胺氧化酶的影響
趙冉冉1,徐曉臣2,王 玲1,路志民3,張文忠1,劉吉祥4
(邯鄲市第一醫院急診科1、神經內科2、泌尿科3、神經外科4,河北 邯鄲 056002)
目的 觀察α-硫辛酸(ALA)對慢性腦低灌注(CCH)血管性癡呆大鼠單胺類神經遞質和單胺氧化酶的影響。方法健康成年雄性Wistar大鼠60只隨機分為假手術組(SHAM組)、慢性腦低灌注組(CCH組)、低劑量治療組(L-ALA組,50 mg/kg)和高劑量治療組(H-ALA組,100 mg/kg),每組15只。利用雙側頸動脈結扎術制備慢性腦低灌注模型,SHAM組手術步驟與CCH組相同但不結扎頸總動脈。從實驗第29天起Morris水迷宮檢測動物認知功能,水迷宮結束后取材,采用高效液相色譜儀檢測去甲腎上腺素(NE)、多巴胺(DA)和5-羥色胺(5-HT)在大鼠前腦皮層的水平,分光光度計檢測前腦皮層單胺氧化酶(MAO)的水平。結果與SHAM組比較,CCH組大鼠前腦皮層NE、DA和5-HT的含量均顯著下降,MAO含量明顯升高,差異均有統計學意義(P<0.05);與CCH組比較,低劑量ALA和高劑量ALA治療均能顯著提高CCH大鼠前腦皮層組織的NE、DA和5-HT含量,降低MAO水平,差異均有統計學意義(P<0.05)。結論α-硫辛酸能夠明顯改善CCH大鼠的行為學異常,調節CCH大鼠腦內單胺類神經遞質系統。
慢性腦低灌注;α-硫辛酸;單胺類神經遞質;單胺氧化酶
血管性認知功能障礙(Vascular cognitive impairment,VCI)是指由各種心、腦血管病而引起的獲得性學習、記憶功能下降。隨著社會人口逐漸老齡化,心腦血管病發病率明顯增加,同時,醫療水平的進步使得心腦血管疾病生存率提高,VCI的發病呈快速增長的趨勢,造成生活質量的下降,嚴重威脅人類身心健康[1]。然而,血管性認知功能障礙的發病機制尚未明確,目前尚無有效改善血管性認知功能障礙的方法,臨床急切需要治療VCI的特效藥物。本研究通過雙側頸總動脈結扎制備慢性腦低灌注血管性認知功能障礙大鼠模型,觀察并探討α-硫辛酸對血管性認知功能障礙大鼠行為學和腦單胺類神經遞質、單胺氧化酶的影響。
1 材料與方法
1.1 實驗動物分組和模型制備 健康成年雄性Wistar大鼠共60只,體質量(260±20)g,購自河北醫科大學實驗動物中心。按照隨機數字表法分為假手術組(SHAM組)、慢性腦低灌注組(CCH組)、低劑量治療組(L-ALA組,50 mg/kg)和高劑量治療組(H-ALA組,100 mg/kg),每組15只;麻醉采用10%的水合氯醛腹腔注射方式,在動物麻醉后仰臥位固定,頸前區消毒,沿頸前正中做縱行的切口,逐層切開皮膚、皮下組織,然后小心地鈍性分離出雙側的頸總動脈,避免刺激頸動脈竇,隨后用絲線依次結扎住雙側頸總動脈的近心端和遠心端,在兩個結扎點間將動脈剪斷,縫合皮膚。術畢將動物放回籠中。密切觀察大鼠精神狀態、飲食等一般情況。在手術過程中假手術組大鼠僅僅是分離雙側頸總動脈,而不結扎雙側頸總動脈,其他步驟不變。術后24 h起,SHAM組和CCH組每日腹腔注射生理鹽水,L-ALA組和H-ALA組給予相應的ALA腹腔注射,每日一次,共28 d。
1.2 主要藥品和試劑α-硫辛酸由Sigma公司提供,去甲腎上腺素(NE)、多巴胺(DA)和5-羥色胺(5-HT)標準品均由中國生物藥品制品檢定所提供,MAO檢測試劑盒由南京建成生物工程研究所提供。
1.3 Morris水迷宮試驗 自術后第29天起進行Morris水迷宮試驗,來評價各組大鼠的認知功能。其中,第29~33天動物進行定向航行試驗,試驗具體內容是將動物分別從四個象限入水,大鼠從入水到爬上平臺所花費的時間記錄為逃避潛伏期,取4次逃避潛伏期的均值為當日的逃避潛伏期并進行分析;第34天動物進行空間探索試驗,水迷宮中的平臺撤除后將大鼠從固定的一個象限入水,觀察大鼠入水后2 min里在平臺所在象限的游泳時間。
1.4 NE、DA、5-HT檢測 Morris水迷宮試驗結束后各組動物采用斷頭取腦的方法取材,冰盤上快速分離前腦皮層組織并稱濕重后,按1:10(mg:μl)比例與預冷的高氯酸混合,隨后在冰浴中制備為10%的腦皮層組織勻漿,離心并取上清液進行下一步的檢驗,采用液相高效色譜儀分析各指標含量。
1.5 單胺氧化酶(MAO)檢測 Morris水迷宮試驗結束后采用大鼠斷頭取腦的方法取材,冰盤上快速分離出前腦皮層組織,稱濕重后加冰生理鹽水制備成10%勻漿,按照試劑盒說明書進行具體實驗步驟。
1.6 統計學方法 應用SPSS17.0軟件對本研究中的實驗數據進行統計分析。計量數據以均數±標準差(±s)表示,重復測量設計的方差分析用于水迷宮實驗中逃避潛伏期的數據分析,其他數據采用one-way ANOVA進行統計分析,兩組間比較采用LSD,以P<0.05為差異有統計學意義。
2 結果
2.1 水迷宮結果 與SHAM組比較,CCH組大鼠在定向航行實驗中逃避潛伏期顯著延長,與CCH組比較,α-硫辛酸治療的兩組動物,L-ALA組和H-ALA組大鼠在定向航行實驗中的逃避潛伏期均明顯縮短(P<0.05);空間探索實驗結果顯示,與SHAM組比較,CCH組大鼠目標象限的游泳時間顯著縮短,L-ALA組和H-ALA組與CCH組相比在目標象限的游泳時間顯著增加(P<0.01);在逃避潛伏期和目標象限游泳時間兩個指標上,高劑量ALA的改善作用更好。在各組大鼠間游泳速度差異無統計學意義,見表1。

表1 α-硫辛酸對Morris水迷宮表現的影響
2.2α-硫辛酸對腦內單胺類神經遞質和MAO的影響 與SHAM組比較,CCH組大鼠前腦皮層內NE、DA和5-HT水平均明顯下降(P<0.05),MAO的水平明顯升高(P<0.05);低劑量和高劑量α-硫辛酸治療均能明顯緩解腦內單胺類神經遞質紊亂,表現為明顯升高了血管性認知功能障礙大鼠前腦皮層中NE、DA和5-HT水平(P<0.05),顯著降低了MAO水平(P<0.05);L-ALA組NE、DA、5-HT和MAO仍未達到SHAM組的正常水平,H-ALA組各項指標水平與SHAM組比較差異無統計學意義(P>0.05),見表2。
表2 α-硫辛酸對前腦皮層NE、DA、5-HT和MAO含量的影響(±s)
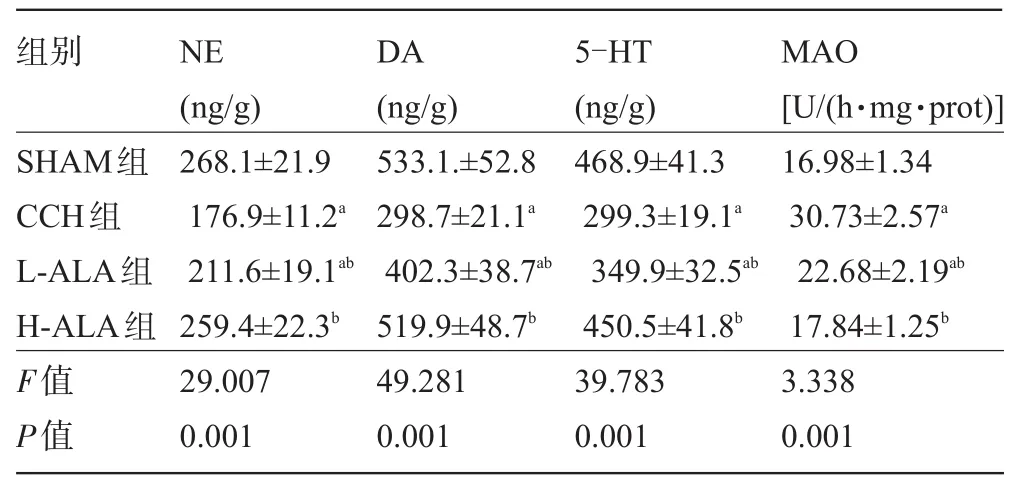
表2 α-硫辛酸對前腦皮層NE、DA、5-HT和MAO含量的影響(±s)
注:a與假手術組比較,P<0.05;b與CCH組比較,P<0.05。
組別SHAM組CCH組L-ALA組H-ALA組F值P值NE (ng/g) 268.1±21.9 176.9±11.2a211.6±19.1ab259.4±22.3b29.007 0.001 DA (ng/g) 533.1.±52.8 298.7±21.1a402.3±38.7ab519.9±48.7b49.281 0.001 5-HT (ng/g) 468.9±41.3 299.3±19.1a349.9±32.5ab450.5±41.8b39.783 0.001 MAO [U/(h·mg·prot)] 16.98±1.34 30.73±2.57a22.68±2.19ab17.84±1.25b3.338 0.001
3 討論
慢性腦低灌注(Chronic cerebral hypoperfusion,CCH)是血管性認知功能障礙和阿爾茨海默病中常見的病理狀態[1],CCH可由高血壓、糖尿病、動脈粥樣硬化、吸煙等因素誘發。CCH與腦血管功能狀態密切相關,是導致血管性癡呆(VD)的主要原因[2]。臨床研究和動物實驗的結果均表明,CCH可導致認知功能損傷[3-4]。存在有CCH的患者常出現不同程度的認知功能障礙。由于CCH在癡呆中的重要作用,CCH已經成為神經科學研究的前沿和熱點。近年來的研究發現,CCH可通過氧化應激、神經遞質紊亂和促炎因子的釋放等機制導致神經退行性改變,進而導致神經元損害和白質的損害[5-6]。動物實驗中發現,雙側頸總動脈結扎術后腦組織中脂質過氧化和氧化性DNA損傷均明顯增加[7],因此抗氧化治療有可能是治療血管性認知功能障礙的有效策略。
學習和記憶功能的下降是血管性認知功能障礙患者的主要臨床表現。從發病機制上看,中樞神經系統中神經遞質與學習記憶密切相關,除了膽堿能神經遞質系統與認知聯系密切外,中樞神經系統單胺類神經遞質在學習和記憶過程中發揮了重要的易化作用,單胺類神經遞質正常的合成及釋放是學習和記憶功能的生化基礎。有研究報道,在血管性認知功能障礙的患者中發現,中樞單胺類神經遞質含量的下降與認知功能的下降密切相關,上調中樞神經系統單胺類神經遞質的含量可能具有增強認知功能的作用。與此同時,腦內5-HT含量的下降也是血管性認知功能受損的典型表現[8],5-HT再攝取抑制劑能有效增強學習和記憶功能[9]。
作為迄今為止發現的唯一同時具有水溶性和脂溶性的強效抗氧化劑,α-硫辛酸能夠順利通過血腦屏障從而發揮其神經保護作用。α-硫辛酸可通過以下機制減輕機體的氧化應激:直接清除活性氧自由基、與金屬離子螯合進而減少活性氧自由基、使體內的內生性抗氧化物再生成并循環利用從而增強機體抗氧化防御、通過在體內轉化為還原型二氫硫辛酸而顯著增強自身抗氧化能力。既往的研究表明,α-硫辛酸對糖尿病及其并發癥[10]、腦外傷[11]、阿爾茨海默病[12]、實驗性自身免疫性腦脊髓炎[13]等都有顯著的保護作用。作為能夠改善認知功能的強抗氧化劑,α-硫辛酸是否在血管性認知功能障礙中也具有治療作用,正是本研究所要探討的問題。
本研究發現,CCH大鼠學習、記憶能力明顯下降,α-硫辛酸治療4周后CCH大鼠認知功能得以明顯改善,且改善作用與劑量相關;檢測大鼠前腦皮層中單胺類神經遞質含量發現,CCH大鼠前腦皮層中單胺類神經遞質DA、NE和5-HT的含量均明顯下降,MAO的含量顯著升高,而α-硫辛酸治療4周后可明顯改善單胺類神經遞質的紊亂。表明ALA對血管性認知功能障礙大鼠有明顯的治療作用,同時ALA能夠調節腦皮層單胺類神經遞質含量。但是ALA究竟是通過何種機制調節了單胺類神經遞質的含量,還有待進一步研究。
[1]de la Torre JC.Alzheimer's disease is a vasocognopathy:a new term to describe its nature[J].Neurol Res,2004,26:517-524.
[2]Valerio Romanini C,Dias Fiuza Ferreira E,Correia Bacarin C,et al. Neurohistological and behavioral changes following the four-vessel occlusion/internal carotid artery model of chronic cerebral hypoperfusion:comparison between normotensive and spontaneously hypertensive rats[J].Behav Brain Res,2013,252:214-221.
[3]Liu H,Zhang J.Cerebral hypoperfusion and cognitive impairment: the pathogenic role of vascular oxidative stress[J].Int J Neurosci, 2012,122:494-499.
[4]Ruitenberg A,den Heijer T,Bakker SL,et al.Cerebral hypoperfusion and clinical onset of dementia:the Rotterdam Study[J].Ann Neurol,2005,57:789-794.
[5]Bang J,Jeon WK,Lee IS,et al.Biphasic functional regulation in hippocampus of rat with chronic cerebral hypoperfusion induced by permanent occlusion of bilateral common carotid artery[J].PLoS One,2013,8:e70093.
[6]Urabe T.Molecular mechanism and new protective strategy for ischemic white matter damages[J].Rinsho Shinkeigaku,2012,52: 908-910.
[7]Xu Y,Zhang JJ,Xiong L,et al.Green tea polyphenols inhibit cognitive impairment induced by chronic cerebral hypoperfusion via modulating oxidative stress[J].J Nutr Biochem,2010,21:741-748.
[8]Evers EA,Tillie DE,vander Veen FM,et al.Effects of a novel method of acute tryptophan depletion on plasma tryptophan and cognitive performance in healthy volunteers[J].Psychopharmacology (Berl),2005,178:92-99.
[9]Roth BL,Hanizavareh SM,Blum AE.Serotonin receptors represent highly favorable molecular targets for cognitive enhancement in schizophrenia and other disorders[J].Psychopharmacology(Berl), 2004,174:17-24.
[10]Chen CL,Cheng WS,Chen JL,et al.Potential of nonoral alpha-lipoic acid aqueous formulations to reduce ocular microvascular complications in a streptozotocin-induced diabetic rat model[J].J Ocul Pharmacol Ther,2013,29:738-745.
[11]Rocamonde B,Paradells S,Barcia JM,et al.Neuroprotection of lipoic acid treatment promotes angiogenesis and reduces the glial scar formation after brain injury[J].Neuroscience,2012,224: 102-115.
[12]Pocernich CB,Lange ML,Sultana R,et al.Nutritional approaches to modulate oxidative stress in Alzheimer's disease[J].Curr Alzheimer Res,2011,8:452-469.
[13]Chaudhary P,Marracci G,Yu X,et al.Lipoic acid decreases inflammation and confers neuroprotection in experimental autoimmune optic neuritis[J].J Neuroimmunol,2011,233:90-96.
Effects of alpha-lipoic acid on monoamine transmitters and monoamine oxidases in rats with chronic cerebral hypoperfusion.
ZHAO Ran-ran1,XU Xiao-chen2,WANG Ling1,LU Zhi-min3,ZHANG Wen-zhong1,LIU Ji-xiang4. Department of Emergency1,Department of Neurology2,Department of Urology3,Department of Neurosurgery4,the First Hospital of Handan,Handan 056002,Hebei,CHINA
Objective To explore the effects of alpha-lipoic acid(ALA)on monoamine neurotransmitters and monoamine oxidase in rats with chronic cerebral hypoperfusion(CCH).MethodsSixty healthy adult male Wistar rats were randomly assigned into four groups:SHAM group,CCH group,low-dose ALA therapy group(50 mg/kg)and high-dose ALA therapy group(100 mg/kg).Bilateral common carotid arteries occlusion was used in healthy adult male Wistar rats to establish CCH model.Rats in SHAM group were operated similarly to CCH group without occlusion of common carotid arteries.Morris water maze was used to evaluate spacial learning and memory function.HPLC was used to detect the levels of norepinephrine(NE),dopamine(DA)and 5-hydroxytryptamine(5-HT)in the forebrain cortex,and monoamine oxidase(MAO)was measured spectrophotometrically.ResultsCompared with SHAM group,the contents of NE,E,DA and 5-HT significantly decreased and MAO significantly increased in the CCH group,and the differences were statistically significant(P<0.05).Both low-dose ALA and high-dose ALA could significantly increase NE,DAand 5-HT levels,and significantly decrease MAO level in the CCH rats(P<0.05).ConclusionALAcould significantly improve behavioral alterations and restore central monoamine neurotransmitters system in rats with chronic cerebral hypoperfusion.
Chronic cerebral hypoperfusion(CCH);Alpha-lipoic acid(ALA);Monoamine transmitter; Monoamine oxidase
R-332
A
1003—6350(2015)23—3440—03
10.3969/j.issn.1003-6350.2015.23.1248
2015-05-22)
趙冉冉。E-mail:a34251900@163.com

