異鼠李素對H2O2引起的H9C2細胞氧化應激損傷的保護作用研究
董 曦,孫桂波,羅 云,孫曉波,陳素紅
(1.溫州醫科大學藥學院,浙江溫州 325035;2.中國醫學科學院北京協和醫學院藥用植物研究所,北京 100193)
?
異鼠李素對H2O2引起的H9C2細胞氧化應激損傷的保護作用研究
董曦1,孫桂波2,羅云2,孫曉波2,陳素紅1
(1.溫州醫科大學藥學院,浙江溫州325035;2.中國醫學科學院北京協和醫學院藥用植物研究所,北京100193)
摘要:目的探討異鼠李素對氧化應激誘導的心肌細胞損傷的保護作用及其作用機制。方法用MTT實驗確定異鼠李素的心肌細胞毒作用濃度,以及抗H2O2氧化應激損傷的最佳作用濃度。將實驗組分為正常組、模型組、治療組、單給藥組。治療組、單給藥組均用最佳濃度的異鼠李素預孵育12 h,模型組、治療組在預孵育結束后用300 μmol·L(-1)H2O2作用4 h,模擬心肌細胞的氧化應激損傷。利用流式細胞術檢測心肌細胞凋亡細胞比例、ROS產生等指標,利用熒光顯微鏡檢測細胞的線粒體膜電位去極化,利用熒光酶標儀檢測抗氧化酶與氧化產物MDA產量,利用Western blot檢測線粒體凋亡信號通路與Nrf2/ARE信號通路的相關蛋白表達。結果與正常組相比,單給藥組心肌細胞的凋亡細胞比例,ROS產生,線粒體膜電位去極化,細胞質細胞色素C、caspase-9、caspase-3、Bcl-2、Bax表達,抗氧化酶與氧化產物MDA產量差異均無顯著性(P>0.05) ;與模型組相比,治療組心肌細胞凋亡比例明顯降低(P<0.01),ROS產生明顯降低(P<0.05),線粒體膜電位去極化明顯改善(P<0.01),細胞質細胞色素C、caspase-9、caspase-3、Bax表達明顯降低(P <0.01),Bcl-2表達增加(P<0.01),抗氧化酶表達增加(P <0.01),氧化產物MDA表達降低(P<0.01) ;心肌細胞中Nrf2核轉位與HO-1表達均隨著異鼠李素預孵育時間的延長而增加。結論異鼠李素能夠保護H2O2引起的心肌細胞損傷。其機制為影響線粒體凋亡通路以及激活Nrf2/ARE信號通路,實現抗氧化、抗凋亡功能。
關鍵詞:異鼠李素;心肌細胞;氧化應激;凋亡;抗氧化;動脈粥樣硬化
冠狀動脈粥樣硬化性心臟病是指冠狀動脈粥樣硬化使血管腔狹窄或阻塞,導致心肌缺血、缺氧而引起的心臟病。隨著生活方式的改變,肥胖和吸煙人群的增加,高血壓病、糖尿病、高脂血癥發病率的增加,冠心病發病率不斷增高,越來越多的學者開始關注于冠心病的發病機制研究。氧化應激損傷被認為是重要的發病機制之一。氧化應激損傷主要來自于缺血部位的心肌細胞在再灌注過程中(急性),或長期低氧條件下(慢性)產生的過量活性氧自由基(reactive oxygen species,ROS)。這些ROS會攻擊心肌細胞的脂質、DNA及蛋白質等生物大分子,使已經損傷的心肌細胞情況更加惡化[1]。Nrf2/ARE信號通路是人體內重要的抗氧化通路,調控著細胞對氧化應激的抵抗能力。Nrf2/ARE信號通路可以誘導細胞內的二相抗氧化酶來清除多余的ROS,保持細胞內氧化還原狀態的平衡,并減輕ROS對細胞的損傷[2]。有研究表明在冠狀動脈粥樣硬化的治療中Nrf2/ARE信號通路發揮著重要的作用[3]。
異鼠李素(isorhamnetin,ISO)屬于黃酮類化合物,并廣泛存在于植物界中。其具有較好的抗腫瘤、降血脂、降血壓、抗氧化,以及擴張冠脈等多種藥理作用,在心血管系統疾病防治中具有廣泛的應用前景[4]。然而,目前關于異鼠李素對心肌細胞保護作用的研究還比較少,本研究將通過建立H9C2心肌細胞氧化應激損傷模型,探索異鼠李素對心肌細胞氧化應激損傷的保護作用以及其對Nrf2/ARE信號通路的影響,以期了解異鼠李素的作用機制并對臨床做出指導。
1 材料與方法
1.1實驗材料DMEM(dulbecco's modified eagle medium,批號: 8114057)培養基購自Gibco公司,MTT(批號: 2399B477)和胰酶(批號: 3049B047)購自Amresco公司,FBS (fetal bovine serum,批號: 090722)購自四季青公司,ROS檢測試劑(批號: 1275755)及凋亡檢測試劑(批號808365)購自Invitrogen公司,JC-1試劑(批號: 30MYL0)購自ENZO公司,DMSO(dimethyl sulphoxide,批號: 089K1407V)購自Sigma公司,細胞核蛋白與細胞質蛋白抽提試劑盒(批號: P0028)購自碧云天公司,Western blot一抗(批號: cytochrome,c-sc-13560; caspase-9,sc-7885; caspase-3,sc-7148; bcl-2,sc-492; Nrf2,G1916; HO-1,F0216;β-actin,sc-1616; lamin B,sc-374015)購自Santa Cruz公司,Western blot二抗(批號:105134)購自中杉金橋公司。考馬斯亮藍蛋白質定量試劑盒(A045-2),過氧化氫酶(catalase,CAT)測定試劑盒(A007-1),谷胱甘肽過氧化物酶(glutathione peroxidase,GSH-Px)測定試劑盒(A005),丙二醛(malondialdehyde,MDA)測定試劑盒(A003-1),總超氧化物歧化酶(total superoxide dismutase,T-SOD)測試盒(A001-1)購自南京建成生物工程研究所。
1.2儀器流式細胞儀(美國BD公司),電泳儀(美國Bio-Rad公司),熒光顯微鏡(日本Olympus公司),熒光酶標儀(瑞士Tecan公司)。
1.3細胞存活率實驗MTT法用無血清DMEM將異鼠李素配制成不同濃度,并與H9C2細胞共孵育12 h,然后向正常組以外的實驗組加入無血清DMEM配制的300 μmol·L-1H2O2孵育4 h(在異鼠李素的細胞毒性實驗中省略H2O2孵育)。吸棄所有實驗組的上清,加入200 μL 1 g·L-1MTT溶液,孵育4 h。加入200 μL DMSO,混勻后在570 nm波長下測定吸光度。細胞存活率/%=(實驗組光吸收值/對照組光吸收值)×100%。
1.4流式細胞術檢測凋亡及活性氧自由基水平變化實驗組分為正常組(N)、模型組(M)、治療組(M+ ISO)、單給藥組(ISO)。用步驟“1.3”中確定的最佳異鼠李素濃度,與治療組及單給藥組的H9C2細胞預孵育12 h,其他組用無血清DMEM預孵育。預孵育結束后,用300 μmol·L-1H2O2溶液對模型組與治療組造模,其他兩組換成新鮮無血清DMEM。4 h后消化細胞,用凋亡試劑盒內的200 μL binding buffer重懸各組細胞,再用5 μL FITC標記的Annexin V工作液與1 μL PI工作液共同孵育細胞懸液15 min,然后用流式細胞儀檢測;在檢測ROS過程中,向培養板中加入用無血清DMEM配制的25 μmol·L-1的ROS探針,將各組H9C2細胞于37℃下避光孵育0.5 h,再用PBS洗兩次,然后用流式細胞儀檢測。
1.5熒光顯微鏡檢測線粒體膜電位變化對各組H9C2細胞進行預給藥并造模后,向培養板中加入用無血清DMEM配制的2μmol·L-1JC-1探針,于37℃下避光孵育0.5 h,再用PBS洗兩次。用熒光顯微鏡進行觀察拍照。統計結果由image-pro plus軟件分析得出。
1.6細胞內MDA、SOD、CAT、GSH-Px的測定對各組H9C2細胞進行預給藥并造模后,消化并收集細胞,用-80℃冰箱將各組細胞反復凍融3次,提取細胞內容物,并按照檢測MDA、SOD、CAT、GSHPx試劑盒的說明書進行操作。
1.7Western blot檢測細胞內蛋白表達
1.7.1胞質蛋白提取對各組H9C2細胞進行預給藥并造模后,用PBS洗滌細胞1次并消化,400× g 10 min離心細胞,并加入細胞裂解液400 μL重懸,于4℃裂解1 h。800×g離心15 min,收集上清液,BCA法測定蛋白濃度。
1.7.2核蛋白提取收集“1.7.1”中的沉淀,并加入50 μL核蛋白抽提試劑,劇烈震蕩5 min,于4℃靜置30 min。800×g 15 min離心,收集上清液,BCA法測定蛋白濃度。
1.7.3Western blot步驟每組取20 μg的總蛋白,12% SDS-PAGE分離蛋白,用電轉移法將蛋白質轉移至PVDF膜,5%脫脂奶粉室溫封閉3 h,分別加入細胞質cytochrome C、caspase-9、caspase-3、bcl-2、Nrf2、HO-1、β-actin、lamin B、Nrf2、HO-1一抗(1∶200稀釋),4℃過夜; TBST溶液洗滌3次(×15 min),加入辣根素過氧化酶標記的二抗,室溫孵育4 h,TBST溶液洗膜3次(×15 min),化學發光法顯影。在檢測Nrf2及HO-1的實驗中,未對細胞進行造模。所檢測的蛋白表達為異鼠李素對正常細胞抗氧化通路的作用。
1.8統計學分析所有實驗均重復3次,數據采用SPSS 17.0統計軟件進行分析,計量資料先進行正態性檢驗,正態分布資料采用單因素方差分析,非正態分布資料轉成正態分布后再采用單因素方差分析;計數資料采用非參數秩和檢驗。
2 結果
2.1異鼠李素的毒性作用以及對H2O2引起的H9C2細胞損傷的保護作用MTT結果(Fig 1A)顯示,0~40 μmol·L-1的異鼠李素溶液與H9C2細胞共孵育12 h未見毒性作用,各組活率與正常組的差異無統計學意義(P>0.05)。80(P<0.05)與160 μmol·L-1(P<0.01)的異鼠李素則使H9C2細胞的活率明顯下降。異鼠李素的保護作用結果則表明(Fig 1B),15 μmol·L-1的異鼠李素對H2O2致H9C2細胞損傷的保護作用較好,其與模型組M相比差異有統計學意義(P<0.01)。20 μmol·L-1的異鼠李素也具有保護作用,差異有顯著性(P<0.05)。與模型組相比,其他濃度的作用沒有統計學意義(P>0.05),由于這些濃度還未至異鼠李素的毒性作用濃度,因此,保護作用的降低并非是由于異鼠李素毒性的原因。
2.2異鼠李素對H2O2引起的H9C2細胞凋亡的保護作用在檢測線粒體膜電位的實驗當中,本實驗利用紅綠熒光的比例來體現線粒體膜電位去極化的程度。紅色熒光表達越強,或者表達比例越高,說明去極化程度越弱。由Fig 2A,C可知,與正常組相比,模型組的線粒體膜電位去極化明顯(P<0.01)。15 μmol·L-1異鼠李素可緩解治療組H9C2細胞的MMP去極化(P<0.01)。對凋亡水平(Fig 2B,D)的檢測也呈現出類似的結果,與模型組相比,治療組的凋亡細胞比例明顯降低(P<0.01)。而與正常組相比,單給藥組的MMP去極化與細胞凋亡水平均沒有差異(P>0.05)。因此,15 μmol·L-1的異鼠李素對于H2O2引起H9C2的MMP去極化、細胞凋亡都有抑制的作用。
2.3異鼠李素對H2O2損傷的H9C2凋亡信號通路蛋白表達的影響如Fig 3所示,與模型組相比,異鼠李素可以明顯降低治療組H9C2的Bax、胞質細胞色素C、caspase-9與caspase-3的表達(P<0.01),并能夠提高由于損傷而降低的Bcl-2的表達(P<0.01)。這些結果提示,異鼠李素治療組可以抑制氧化應激引起的H9C2細胞凋亡,而這種保護作用是通過抑制線粒體凋亡通路來實現的。
2.4異鼠李素對H2O2損傷H9C2細胞ROS,MDA,SOD,CAT,GSH-Px產生的影響為了研究異鼠李素對H9C2細胞抗氧化能力的影響,本實驗檢測了細胞內ROS、丙二醛(MDA)、超氧化物歧化酶(SOD)、過氧化氫酶(CAT)與谷胱甘肽過氧化物酶(GSH-Px)產生的變化。本實驗首先研究了異鼠李素對H2O2造成H9C2細胞產生過量ROS的影響。結果表明(Fig 4A)異鼠李素可以保護H9C2細胞,抑制H2O2造成的過量ROS產生。與模型組相比,治療組ROS的產生明顯降低(P<0.05)。MDA是細胞內的脂質過氧化物,其含量可以反映出細胞損傷的程度,SOD、CAT與GSH-Px是細胞內的抗氧化酶,對細胞的氧化損傷起著重要的保護作用[5]。如Fig 4B所示,模型組的MDA含量較正常組明顯升高(P<0.01),經異鼠李素預孵育后則使MDA明顯降低(P<0.01)。另一方面,與正常組相比,模型組的抗氧化酶SOD、CAT與GSH-Px都明顯下降(Fig 4 C,D,E,P<0.01)。而治療組的抗氧化酶產量均較模型組明顯增加(P<0.01)。單獨給予異鼠李素處理組的ROS、MDA、SOD、CAT與GSH-Px較正常組差異均無顯著性(P>0.05)。
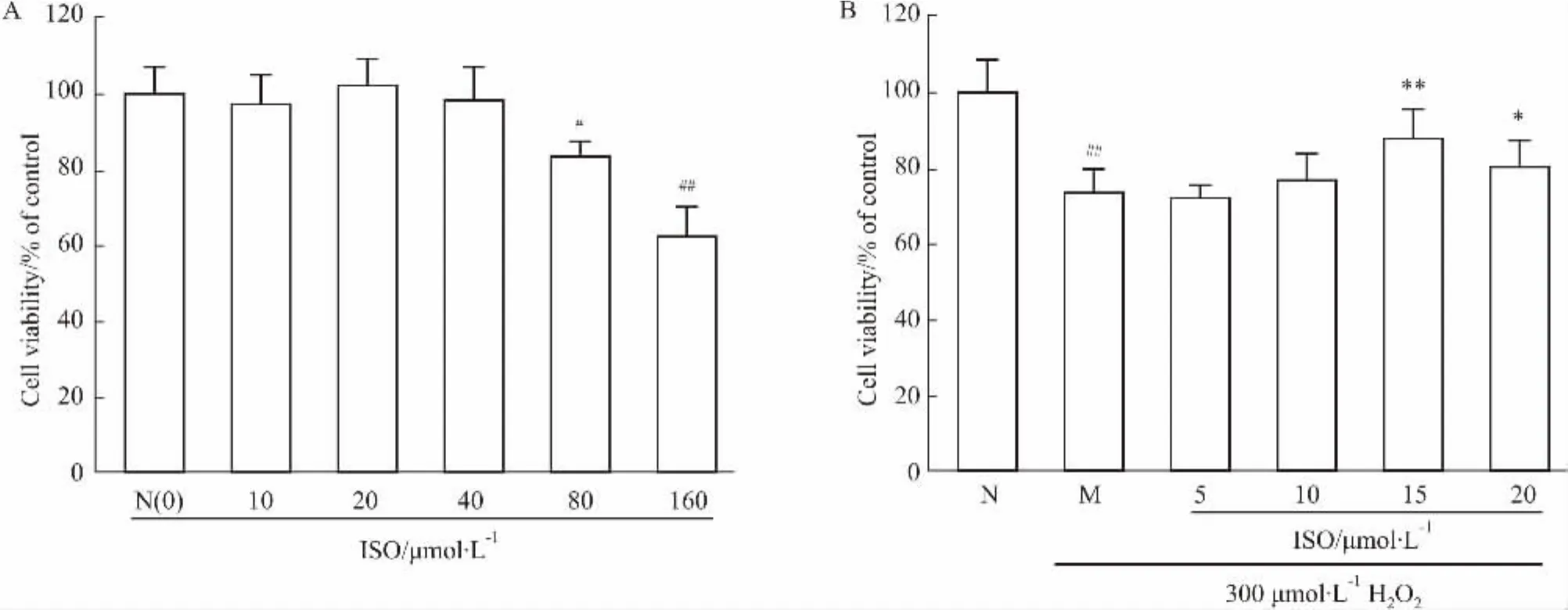
Fig 1 Toxicity of isorhamnetin and its protective effect on oxidatively injured H9C2 cell line
2.5異鼠李素對H2O2損傷的H9C2的Nrf2/ARE信號通路的影響接下來,本實驗研究了異鼠李素對抗氧化信號通路的影響。由于Nrf2/ARE信號通路是體內重要的抗氧化信號通路,本研究推測異鼠李素的抗氧化應激作用可能與該通路相關。根據Western blot的結果(Fig 5)可知,在4~24 h這段時間內,異鼠李素逐漸增加Nrf2的核轉位以及抗氧化酶HO-1的表達,抗氧化作用不斷增強。這表明異鼠李素對H9C2細胞的保護至少部分是通過Nrf2/ARE信號通路來發揮作用的。
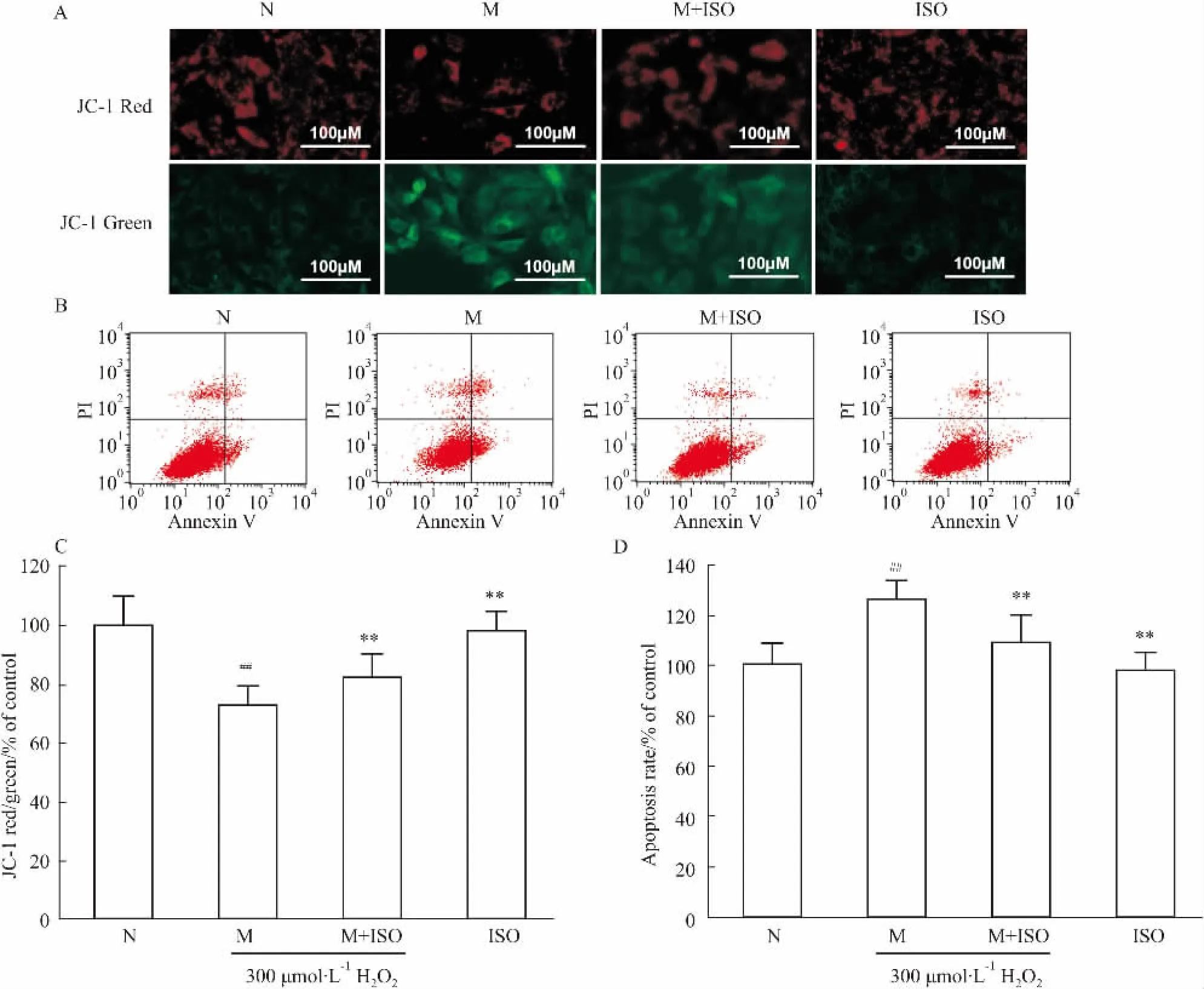
Fig 2 Effects of isorhamnetin on apoptosis of oxidatively injured H9C2 cell line
3 討論
在冠狀動脈粥樣硬化性心臟病發生及發展的過程中,氧化應激損傷起著重要的作用。氧化應激是指體內氧化與抗氧化作用失衡,傾向于氧化,導致大量氧化中間產物的產生。ROS包括超氧陰離子(·O2-)、羥自由基(·OH)和過氧化氫(H2O2)等。氧化應激損傷中產生的過量ROS會損傷心肌細胞線粒體,刺激線粒體釋放細胞色素C,繼而活化caspase家族,如caspase-9、caspase-3等,并最終導致心肌細胞死亡[6]。除此之外,ROS還能夠引起炎癥反應及低密度脂蛋白氧化,導致巨噬細胞成為泡沫細胞,血管平滑肌細胞增生,促使冠狀動脈內斑塊形成[7]。有研究表明,異鼠李素可以緩解ox-LDL對內皮細胞產生的損傷[8]。本實驗利用H2O2損傷H9C2細胞的模型來模擬過量ROS損傷心肌細胞,并探索異鼠李素對心肌細胞的保護作用。結果表明,15 μmol·L-1的異鼠李素可以保護H9C2細胞,對抗H2O2造成的氧化應激損傷。而其他濃度沒有改善效果,毒性實驗的結果表明,在孵育時間相同的條件下,異鼠李素從80 μmol·L-1的濃度才開始出現H9C2的細胞毒性作用。這些結果提示,異鼠李素能夠降低H2O2對H9C2心肌細胞的損傷,并且在15 μmol·L-1的濃度下具有最佳的保護作用。隨著濃度的增加,異鼠李素的保護作用逐漸減弱,而這種減弱并非是由于細胞毒作用造成的。
心肌細胞的凋亡是心肌損傷的重要機制。在心肌細胞的凋亡中,線粒體起著重要的作用。在線粒體內膜上,存在著名為線粒體通透性轉換孔的孔道(mPTP)。氧化應激等損傷會促使mPTP開放,而mPTP的持續開放會導致線粒體膜電位去極化,并釋放線粒體內的促凋亡物質如細胞色素C至細胞質中[9],繼而導致caspase-9、-3的活化,最終引起細胞凋亡[6]。線粒體同時也是Bcl-2基因家族發揮作用的場所,Bcl-2基因家族包括抗凋亡基因Bcl-2、Bcl-lx與促凋亡基因Bax、Bad、Bid、Bnip3。Bax轉位至線粒體中則會導致細胞色素C的釋放,而抗凋亡蛋白Bcl-2能夠保持線粒體膜的完整性、穩定性,并與Bax形成二聚體,減少細胞色素C的釋放[10]。因此本實驗研究了異鼠李素對線粒體膜電位以及細胞凋亡的影響。實驗結果表明,H2O2促進H9C2細胞線粒體膜電位去極化,使線粒體內的細胞色素C釋放至細胞質內,并使caspase-9與caspase-3相繼活化,導致心肌細胞凋亡。Bcl-2的表達下調與Bax上調也同樣表明線粒體受到損傷,線粒體凋亡通路被活化。而異鼠李素逆轉了治療組細胞的上述指標,這表明異鼠李素能夠作用于心肌細胞的線粒體凋亡通路,抑制H2O2對心肌細胞的損傷,降低了心肌細胞凋亡。

Fig 3 Effect of isorhamnetin on apoptotic signal pathway of oxidatively injured H9C2 cell line
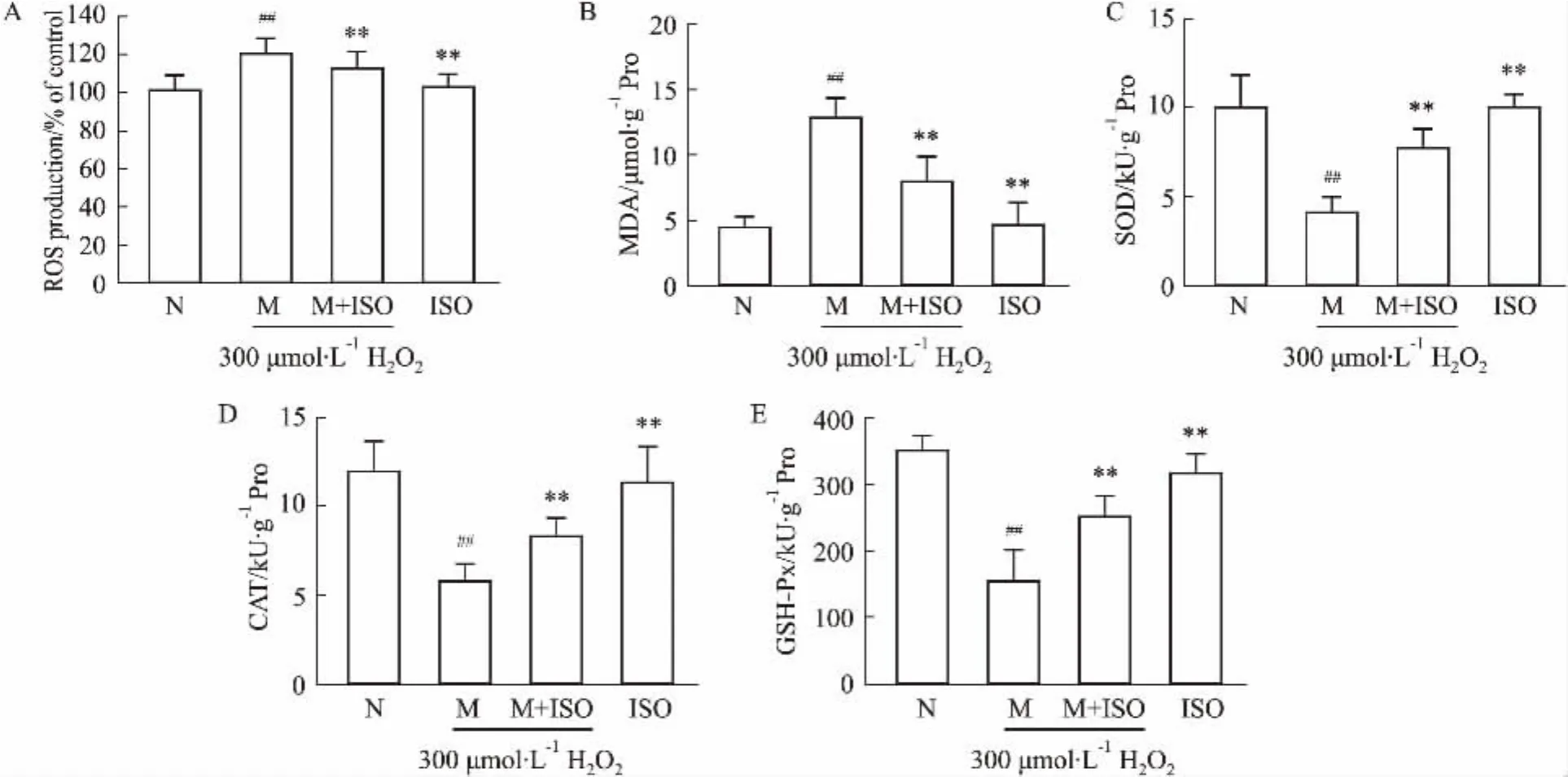
Fig 4 Effects of isorhamnetin on ROS,MDA,SOD,CAT,GSH-Px generations of oxidatively injured H9C2 cell line
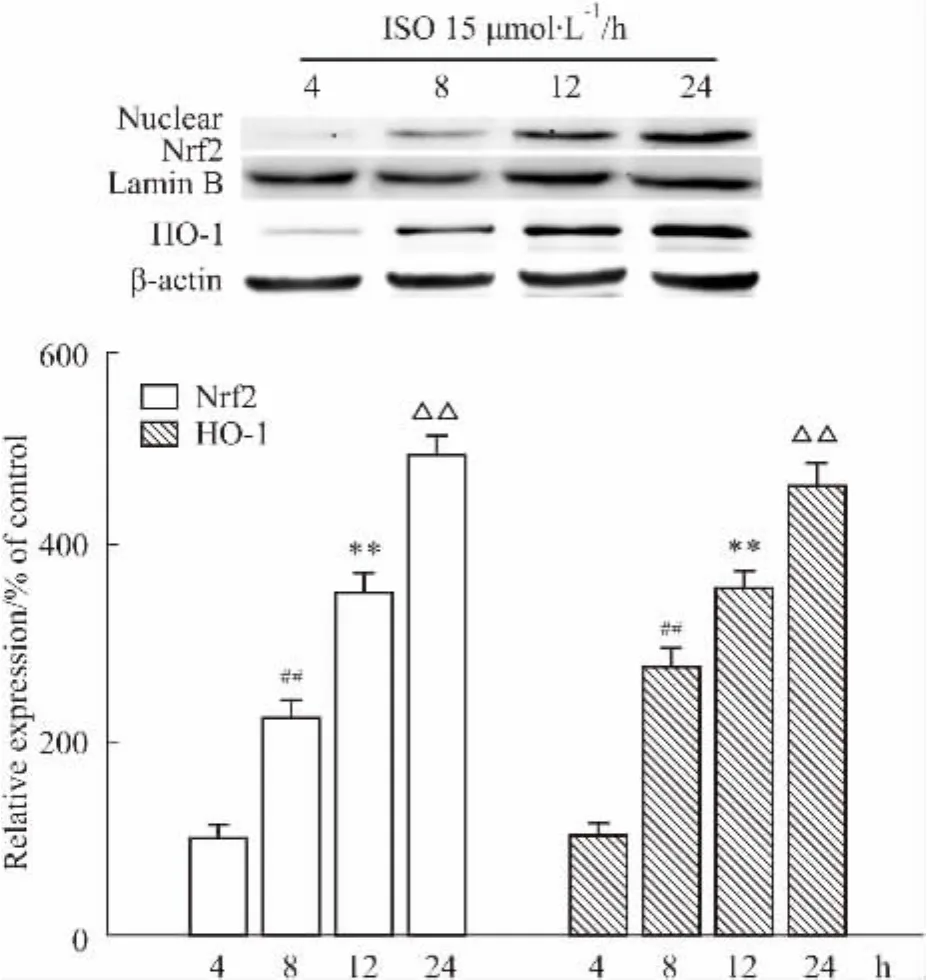
Fig 5 Effect of isorhamnetin on Nrf2/ARE signal pathway of H9C2 cell line
ROS的作用是復雜的。一方面,ROS是機體正常功能所必需的,是線粒體呼吸作用的正常副產物[11]。它還可以作為一種信號分子,活化細胞內的信號通路,維持細胞正常機能與氧化還原狀態,甚至還會參與組織的再生與修復[12];另一方面,ROS又與心肌細胞的氧化應激損傷存在著密切的關系,過量的ROS可以損傷心肌細胞的脂質、DNA及蛋白質等生物大分子,從而加重心臟的損傷[13]。在冠狀動脈粥樣硬化性心臟病的缺血階段,細胞內抗氧化物活性降低,ROS產生增加。而當再灌注發生時,線粒體受到氧化應激損傷,會產生過量的ROS,這些ROS會再次損傷線粒體,形成惡性循環,最終導致細胞的死亡[11]。實驗結果表明,單給藥組的ROS產生與正常組相比不存在差異,這說明異鼠李素并未對生理水平的ROS產生影響。而H2O2則會引起H9C2心肌細胞ROS產量增加,抗氧化酶SOD、CAT、GSH-Px產量降低,造成過量的ROS得不到有效的清除。這些過量的ROS會氧化生物膜的磷脂、酶和膜受體相關的生物大分子,并產生有害的脂質過氧化產物丙二醛(MDA)[14],因此H9C2細胞內MDA明顯增加。由于ROS也會損傷線粒體,如線粒體膜、DNA、蛋白質等[11],因此過量的ROS能夠造成線粒體氧化還原狀態失衡,引起線粒體凋亡通路活化,并導致細胞凋亡。這也可能是H2O2導致H9C2細胞凋亡的原因。而異鼠李素能夠緩解治療組H9C2細胞的氧化應激負荷,抑制細胞內ROS產生與脂質過氧化,并提高細胞內的抗氧化酶水平。憑借這些作用,異鼠李素能夠抑制H9C2心肌細胞的線粒體凋亡途徑,達到保護心肌細胞的作用。
Nrf2/ARE信號通路是抗氧化的重要通路,Nrf2 與Keap1以無活性的二聚體形式存在于細胞質內,當受到外界氧化應激刺激后,Nrf2與Keap1分離,轉位進入細胞核。在細胞核內Nrf2與Maf、抗氧化反應元件(Antioxidant responsive element,ARE)結合并調控二相抗氧化酶如HO-1等的表達[15]。在某些情況下,例如血管老化,Nrf2不能對ROS做出反應,這將導致血管及心臟的氧化應激損傷[16]。由Western blot的結果可知,隨著孵育時間的增加,異鼠李素可以逐漸增加Nrf2的核轉位以及其所調控的二相抗氧化酶HO-1的表達。這表明異鼠李素可以活化Nrf2/ARE信號通路,并增加其下游二相抗氧化酶的表達。有研究表明,Nrf2能夠上調抗凋亡蛋白Bcl-2的表達,來實現抗氧化,抗細胞凋亡的作用[17]。本研究結果提示,異鼠李素可以通過促進Nrf2的核轉位,活化Nrf2/ARE通路,并抑制細胞凋亡與氧化應激負荷,促進細胞存活。
綜上所述,本研究采用H2O2誘導的H9C2氧化損傷模型,探索異鼠李素對心肌細胞的保護作用。研究的結果表明,異鼠李素具有抗氧化、抗凋亡作用,其機制是通過活化Nrf2通路來提高心肌細胞的抗氧化能力,抑制心肌細胞凋亡。上述實驗結果為臨床應用異鼠李素治療冠狀動脈粥樣硬化性心臟病提供了支持,也為開發治療冠狀動脈粥樣硬化性心臟病藥物提供了依據。
(致謝:本研究于中國醫學科學院北京協和醫學院藥用植物研究所藥理毒理中心完成。感謝實驗室的各位老師與同學給予的大力支持和無私幫助。)
參考文獻:
[1]Rodrigo R,Libuy M,Feliu F,et al.Molecular basis of cardioprotective effect of antioxidant vitamins in myocardial infarction[J].Biomed Res Int,2013,2013: 437613.
[2]Lee J H,Khor T O,Shu L,et al.Dietary phytochemicals and cancer prevention: Nrf2 signaling,epigenetics,and cell death mechanisms in blocking cancer initiation and progression[J].Pharmacol Ther,2013,137(2) : 153-71.
[3]Bozaykut P,Karademir B,Yazgan B,et al.Effects of vitamin E on peroxisome proliferator-activated receptor gamma and nuclear factor-erythroid 2-related factor 2 in hypercholesterolemia-inducedatherosclerosis[J].Free Radic Biol Med,2014,70: 174-81.
[4]趙增光,劉應才.異鼠李素的心血管保護作用[J].醫學綜述,2008 (15) : 2321-3.
[4]Zhao Z G,Liu Y C.Cardiovascular protective effect of isorhamnetin[J].Med Recap,2008 (15) : 2321-3.
[5]Meng X B,Sun G B,Wang M,et al.P90RSK and Nrf2 Activation via MEK1/2-ERK1/2 pathways mediated by Notoginsenoside R2 to prevent 6-hydroxydopamine-induced apoptotic death in SHSY5Y cells[J].Evid Based Complement Alternat Med,2013,2013: 971712.
[6]Rajendran P,Nandakumar N,Rengarajan T,et al.Antioxidants and human diseases[J].Clin Chim Acta,2014,436C: 332-47.
[7]Vichova T,Motovska Z.Oxidative stress: Predictive marker for coronary artery disease[J].Exp Clin Cardiol,2013,18(2) : e88 -91.
[8]Bao M,Lou Y.Isorhamnetin prevent endothelial cell injuries from oxidized LDL via activation of p38MAPK[J].Eur J Pharmacol,2006,547(1-3) : 22-30.
[9]Solesio M E,Saez-Atienzar S,Jordan J,et al.3-Nitropropionic acid induces autophagy by forming mitochondrial permeability transition pores rather than activating the mitochondrial fission pathway [J].Br J Pharmacol,2013,168(1) : 63-75.
[10]謝飛,魏珂,閔蘇,等.神經生長因子對H9c2心肌細胞缺氧/復氧后凋亡的保護作用及其機制[J].中國藥理學通報,2014,30(4) : 506-10.
[10]Xie F,Wei K,Min S,et al.Anti-apoptotic effect of NGF on H9c2 cardiac myocytes in a hypoxia/reoxygenation injury model[J].Chin Pharmacol Bull,2014,30(4) :506-10.
[11]Dai D F,Chiao Y A,Marcinek D J,et al.Mitochondrial oxidative stress in aging and healthspan[J].Longev Healthspan,2014,3: 6.
[12]Urao N,Ushio-Fukai M.Redox regulation of stem/progenitor cells and bone marrow niche[J].Free Radic Biol Med,2013,54: 26 -39.
[13]Rodrigo R,Prieto J C,Castillo R.Cardioprotection against ischaemia/reperfusion by vitamins C and E plus n-3 fatty acids: molecular mechanisms and potential clinical applications[J].Clin Sci (Lond),2013,124(1) : 1-15.
[14]Han S,Zhang H,Qin L,et al.Effects of dietary carbohydrate replaced with wild rice (Zizania latifolia (Griseb) Turcz) on insulin resistance in rats fed with a high-fat/cholesterol diet[J].Nutrients,2013,5(2) : 552-64.
[15]Kansanen E,Kuosmanen S M,Leinonen H,et al.The Keap1-Nrf2 pathway: Mechanisms of activation and dysregulation in cancer[J].Redox Biol,2013,1(1) : 45-9.
[16]Cho Y H,Cha M J,Song B W,et al.Enhancement of MSC adhesion and therapeutic efficiency in ischemic heart using lentivirus delivery with periostin[J].Biomaterials,2012,33(5) : 1376-85.
[17]Fan J,Xu G,Jiang T,et al.Pharmacologic induction of heme oxygenase-1 plays a protective role in diabetic retinopathy in rats [J].Invest Ophthalmol Vis Sci,2012,53(10) : 6541-56.
Protective effect of isorhamnetin on H9C2 cell line against oxidative stress
DONG Xi1,SUN Gui-bo2,LUO Yun2,SUN Xiao-bo2,CHEN Su-hong1
(1.Wenzhou Medical University,Wenzhou Zhejiang 325035,China; 2.Institute of Medicinal Plant Development,Chinese Academy of Medical Sciences and Peking Union Medical College,Beijing 100193,China)
Abstract:AimTo investigate the protective effect of isorhamnetin on H9C2 myocardial cell line and its mechanisms.Methods The toxicity and optimal protective concentration of isorhamnetin were determined by MTT assay.The experimental subjects were divided into four groups: group N (normal),group M (model),group M+ ISO (model+ isorhamnetin),and group ISO (isorhamnetin only).Group M+ ISO and ISO were pre-incubated with isorhamnetin for 12 hours while other groups with plain DMEM.Group M and M+ ISO were treated with 300μmol·L(-1)H2O2for 4 hours after pre-incubation.Mitochondrial membrane potential depolarization of H9C2 was measured by fluorescence microscope.Apoptotic rate and ROS production of injured myocardial cell line were detected using flow cytometry.The oxidative indictors were measured by spectrophotometry.The expressions of cytoplasmic cytochrome C,caspase-9,caspase-3,Bcl-2,Bax,Nrf2 and HO-1 were examined by Western blot.Result There was no difference in mitochondrial membrane potential depolarization,apoptotic rate,ROS production,oxidative indictors production and expressions of cytoplasmic cytochrome C,caspase-9,caspase-3,Bcl-2,Bax between groups ISO and N (P>0.05).Apoptotic rate,ROS production,expressions of cytoplasmic cytochrome C,caspase-9,caspase-3,Bax,MDA production of group M+ ISO were significantly lower than those of group M (P<0.01).And mitochondrial membrane potential,Bcl-2,CAT,SOD and GSH-Px of group M+ ISO were increased compared to group M.book=860,ebook=125Nuclear translocation of Nrf2 and expression of HO-1 in myocardial cell line were increased with the prolonged isorhamnetin incubation time.ConclusionIsorhamnetin could protect myocardial cell line against H2O2-induced oxidative injury and apoptosis through the interruption of mitochondrial dependent apoptotic pathway and activation of Nrf2/ARE pathway.
Key words:isorhamnetin; myocardial cells; oxidative stress; apoptosis; anti-oxidation; atherosclerosis
作者簡介:董曦(1985-),男,碩士生,研究方向:心血管藥理學,E-mail: dx5212004@126.com;陳素紅(1973-),女,研究員,博士生導師,研究方向:中藥藥效學與中藥新產品開發,通訊作者,Tel/Fax: 0571-86613601,E-mail: chensuhong06@ yahoo.com.cn;孫曉波(1958-),男,教授,博士生導師,研究方向:中藥及復方藥效物質基礎及分子機制,通訊作者,Tel/Fax: 010-57833013,E-mail: sun-xiaobo@163.com
基金項目:國家自然科學基金資助項目(No 81374011)
收稿日期:2015-02-16,修回日期:2015-03-02
文獻標志碼:A
文章編號:1001-1978(2015) 06-0853-08中國圖書分類號: R282.71; R322.11; R329.25; R349.1; R543.5
doi:10.3969/j.issn.1001-1978.2015.06.023

