云南省迪慶藏族自治州19株耐甲氧西林的金黃色葡萄球菌分子流行病學(xué)分析
楊麗天,何寸英,秦?濤,古文鵬
(1.迪慶州疾病預(yù)防控制中心,云南 迪慶 674400;2.云南省疾病預(yù)防控制中心,云南 昆明 650000)
● 疾病控制與防治 ●
云南省迪慶藏族自治州19株耐甲氧西林的金黃色葡萄球菌分子流行病學(xué)分析
楊麗天1,何寸英1,秦?濤1,古文鵬2
(1.迪慶州疾病預(yù)防控制中心,云南 迪慶 674400;2.云南省疾病預(yù)防控制中心,云南 昆明 650000)
[目的]對云南省迪慶藏族自治州2012-2013年兩家醫(yī)院分離的金黃色葡萄球菌(MRSA)菌株進(jìn)行了分子流行病學(xué)分析,以此了解該地區(qū)MRSA耐藥情況。[方法]采用脈沖場凝膠電泳(Pulsed-Feld Gel Electrophoresis ,PFGE)、多位點(diǎn)測序分析(multilocus sequence typing ,MLST),藥物敏感試驗(yàn)和毒力基因檢測等方法對19株MRSA進(jìn)行分析研究。[結(jié)果]所有菌株對β-內(nèi)酰胺類抗生素耐藥,部分菌株對喹諾酮類、大環(huán)內(nèi)酯類、四環(huán)素以及磺胺類藥物耐藥;毒力基因檢測結(jié)果表明,所有菌株均攜帶有溶血素基因以及不同組合的腸毒素基因;PFGE結(jié)果顯示19個(gè)菌株共產(chǎn)生11個(gè)PFGE帶型,具有非常高的分辨率水平;MLST分型結(jié)果顯示,19株MRSA共產(chǎn)生3個(gè)ST型別,其中以ST59和ST121型菌株為主。[結(jié)論]云南省迪慶藏族自治州MRSA菌株耐藥水平不容忽視,菌株的毒力基因攜帶情況增加了病原菌的致病能力;MRSA的流行株在迪慶藏族自治州地區(qū)均有不同程度的分布,同時(shí)PFGE對MRSA的分型水平高于MLST,同時(shí)又與MLST分型方法具有良好的相關(guān)性。
金黃色葡萄球菌;耐藥菌株;分子特征;迪慶藏族自治州
金黃色葡萄球菌是臨床上一類非常重要的條件致病菌,雖然其是人體內(nèi)微生物菌群的正常組分之一,但該菌可通過不同的機(jī)制致病引起人類廣泛的感染和一系列臨床癥狀的發(fā)生[1]。近年來,耐甲氧西林的金黃色葡萄球菌的發(fā)病水平逐漸升高,成為醫(yī)院獲得性或是社區(qū)獲得性感染的重要來源之一,已經(jīng)成為世界范圍內(nèi)需要共同面對的嚴(yán)重問題[2-4]。因此,加強(qiáng)監(jiān)測力度和對病原菌進(jìn)行分子特征方面的分析具有十分重要的臨床意義。
迪慶藏族自治州位于云南省西北高寒地區(qū),毗鄰西藏,是云南省地理位置、氣候條件較為特殊的地區(qū)之一。既往對于該地區(qū)的金黃色葡萄球菌的監(jiān)測和研究幾乎沒有報(bào)道過,這是第一次對迪慶藏族自治州分離的金黃色葡萄球菌的分子特征進(jìn)行系統(tǒng)的分析和研究。
目前,對于金黃色葡萄球菌主流的分子分型方法主要有PFGE、MLST、spa Typing以及SCCmec typing等[5]。PFGE被認(rèn)為是對金黃色葡萄球菌分子分型的金標(biāo)準(zhǔn),被認(rèn)為具有較高的分辨率水平,而MLST則主要應(yīng)用于菌株的克隆群和進(jìn)化關(guān)系的研究,其它分型方法也均具有各自的適用性并具有較高的分辨率[6]。為了從菌株的整個(gè)基因組角度進(jìn)行分析研究,選取了PFGE和MLST兩種分型方法,并結(jié)合藥敏試驗(yàn)和毒力基因檢測等對迪慶藏族自治州分離的金黃色葡萄球菌菌株進(jìn)行研究。
1 材料和方法
1.1 實(shí)驗(yàn)材料——菌株來源
19株金黃色葡萄球菌來源于2012-2013年,從迪慶藏族自治州兩家三甲醫(yī)院分離得到。其中菌株1-5為2012年從A醫(yī)院分離;菌株5-9為2013年從A醫(yī)院分離得到。菌株10-14為2012年從B醫(yī)院分離;菌株15-19為2013年從B醫(yī)院分離得到。其中,10株菌(52.63%)從患者的鼻炎抽吸物中分離得到;4株菌(21.05%)從患者的痰液中分離得到;5株菌(26.32%)從患者的血液中培養(yǎng)出來。13株菌(68.42%)是從5歲以下的嬰幼兒中分離得到的,占分離菌株的主要部分。所有患者均有不同程度的發(fā)熱、咳嗽、咳痰等臨床表現(xiàn)。
1.2 實(shí)驗(yàn)方法
1.2.1 藥敏試驗(yàn)
所有菌株均采用Vitek Compact2(梅里埃)生化鑒定儀進(jìn)行生化鑒定和復(fù)合,采用Vitek Compact2(梅里埃)微生物鑒定儀進(jìn)行藥物敏感試驗(yàn),并嚴(yán)格按照儀器說明進(jìn)行試驗(yàn)操作。采用革蘭氏陽性鑒定卡測定每個(gè)菌株的最低抑菌濃度值(MIC)。革蘭氏陽性菌藥敏板包被的抗生素依次為:青霉素G(PEN),氨芐西林(AMP),苯唑西林(OXA),慶大霉素(GEN),環(huán)丙沙星(CIP),氧氟沙星(LEV),莫西沙星(MXF),紅霉素(EM),克林霉素(CM),奎奴普丁-達(dá)福普汀(QDA),萬古霉素(VAN),四環(huán)素(TET),呋喃妥英(NIT),利福平(RIF)和復(fù)方新諾明(SXT)15種抗生素。采用ATCC29213金黃色葡萄球菌作為質(zhì)控菌株,按照臨床微生物實(shí)驗(yàn)室診斷標(biāo)準(zhǔn)(CLSI 2011版)進(jìn)行結(jié)果的判定。同時(shí),按照參考文獻(xiàn)中的引物和方法擴(kuò)增mecA基因,以確認(rèn)耐甲氧西林的金黃色葡萄球菌攜帶的基因。
1.2.2 毒力基因檢測
將菌株接種于血平板,37℃在5%CO2中培養(yǎng)24 h,然后采用細(xì)菌基因組核酸提取試劑盒提取菌株的核酸。毒力基因檢測按照參考文獻(xiàn)中的引物進(jìn)行PCR擴(kuò)增。采用Bio-Rad mycycler型PCR儀進(jìn)行擴(kuò)增,擴(kuò)增體系采用20 μl:Taq premix(TaKaRa)10 μl,水8 μl,上下游引物各0.5 μl,模板1 μl。擴(kuò)增條件為94℃ 5 min, 然后按照30個(gè)循環(huán)94℃ 15 s, 55℃ 30 s,72℃ 30 s,最后72℃ 10 min。擴(kuò)增產(chǎn)物采用1.5%的瓊脂糖進(jìn)行凝膠電泳,結(jié)果用Bio-Rad(Gel Doc)凝膠成像儀進(jìn)行觀察結(jié)果。
1.2.3 PFGE
按照PulseNet的PFGE操作方式進(jìn)行實(shí)驗(yàn),每個(gè)膠塊采用50 U的SmaI(TaKaRa)于37℃酶切4 h,采用CHEF Mapper(Bio-Rad)進(jìn)行電泳,電泳結(jié)束后采用GelRed對膠塊染色30 min后用凝膠成像儀觀察結(jié)果。1.2.4 MLST
MLST按照MLST數(shù)據(jù)庫(http://saureus.mlst.net)公布的方法進(jìn)行,擴(kuò)增基因?yàn)閍rcC, aroE, glpF, gmk, pta, tpi, 和 yqiL。擴(kuò)增引物和擴(kuò)增體系等參數(shù)均按照MLST數(shù)據(jù)庫,網(wǎng)站上提供的參數(shù)進(jìn)行,擴(kuò)增產(chǎn)物經(jīng)切膠回收后純化送到生物公司進(jìn)行雙向測序,并將測序結(jié)果提交到MLST數(shù)據(jù)庫中查詢每個(gè)等位基因號和每個(gè)菌株的ST型別。
2 結(jié)果
19株MRSA的藥敏實(shí)驗(yàn)結(jié)果顯示,所有菌株均對苯唑西林耐藥,因此為耐甲氧西林的金黃色葡萄球菌。所有菌株均對青霉素G和氨芐西林等β-內(nèi)酰胺類抗生素耐藥;8株菌(45.61%)顯示為對環(huán)丙沙星耐藥,其余菌株則表現(xiàn)為敏感或是中度敏感;2株菌(10.53%)顯示對左氧氟沙星耐藥,而大部分菌株則表現(xiàn)為中度敏感;12株菌(63.16%)表現(xiàn)為對紅霉素耐藥;6株菌對四環(huán)素耐藥,占29.82%;15株菌對復(fù)方新諾明耐藥,占77.19%;所有菌株對奎奴普丁—達(dá)福普汀和利福平均敏感。
菌株的毒力基因檢測結(jié)果顯示:所有菌株均攜帶溶血素基因;19株菌(96.49%)攜帶有不同程度組合的腸毒素基因;3個(gè)菌株攜帶eta以及etb等表皮剝脫毒素基因;10個(gè)菌株攜帶有殺白細(xì)胞毒素基因;11個(gè)菌株攜帶表皮細(xì)胞分化抑制基因。在所有的毒力基因檢測結(jié)果中,腸毒素基因see,毒性休克綜合征毒素tst以及殺白細(xì)胞毒素lukM的基因檢測結(jié)果全為陰性。
PFGE結(jié)果顯示,19個(gè)菌株共產(chǎn)生11個(gè)PFGE-SmaI帶型,見圖1所示。部分菌株形成一個(gè)單獨(dú)的聚類型別,部分菌株具有相同的PFGE帶型。其中來源于A和B醫(yī)院的菌株形成了兩個(gè)單獨(dú)的聚類群,從每個(gè)醫(yī)院分離得到的菌株具有較高的相似性,而不同醫(yī)院分離的菌株則形成了不同的聚類群。MLST分型結(jié)果顯示:菌株1、2、4、5、7、8、9為ST59型菌株,3、6菌株為ST6型菌株;而菌株10-19則全為ST121型。
3 討論
MRSA目前已經(jīng)成為全世界需要共同面對的公共衛(wèi)生問題,其造成的院內(nèi)感染或是社區(qū)獲得性感染給經(jīng)濟(jì)和人類社會的發(fā)展帶來了沉重的負(fù)擔(dān),摸清MRSA菌株的流行規(guī)律和分子特征有利于加強(qiáng)對該類菌株引起感染的控制[7]。既往對于云南省迪慶州的MRSA鮮有報(bào)道,而大部分研究主要在經(jīng)濟(jì)較為發(fā)達(dá)的地區(qū),這是首次對云南省迪慶州分離的MRSA菌株進(jìn)行分子特征方面的研究和分析,對全面了解云南省MRSA的分布特征和流行規(guī)律進(jìn)行了補(bǔ)充和完善。
在研究結(jié)果中,19株MRSA菌株中有68.42%的菌株是分離自5歲以下的兒童,其中有很大一部分是從新生兒中分離得到的,這些患者均有不同程度的發(fā)熱和肺炎等臨床表現(xiàn)。這些病例特征與國內(nèi)外的研究報(bào)道是一致的,表明兒童是MRSA感染的主要群體[8]。同時(shí),藥敏試驗(yàn)結(jié)果顯示迪慶州分離的MRSA菌株除了對β-內(nèi)酰胺類抗生素耐藥外,對于喹諾酮類、大環(huán)內(nèi)酯類、四環(huán)素以及磺胺類的耐藥性菌株比例也占很大一部分,這給臨床用藥帶來了許多問題和困難,因此加強(qiáng)對MRSA菌株的藥敏監(jiān)測并及時(shí)反饋給臨床醫(yī)師對于控制MRSA的感染具有十分重要的意義。
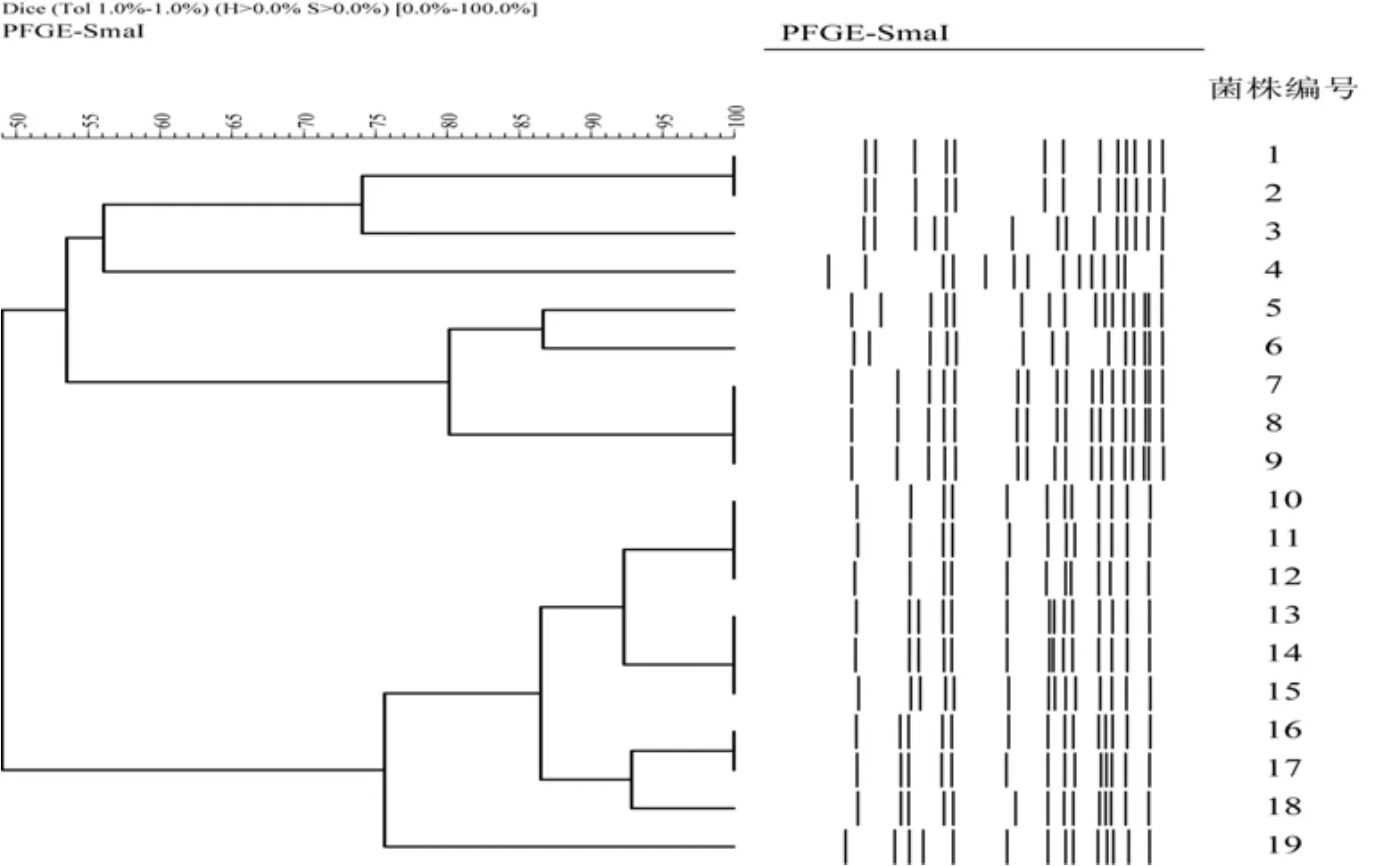
圖1 19株MRSA菌株P(guān)FGE聚類分析
通過PFGE與MLST結(jié)果比較后發(fā)現(xiàn),對MRSA而言,PFGE比MLST具有更高的區(qū)分效率,見圖1。19株MRSA形成了11個(gè)PFGE聚類群,而僅產(chǎn)生了3個(gè)ST型別,因此PFGE對于MRSA具有較高的分辨率水平[9,10]。同時(shí),PFGE也能很好的反映菌株的流行病學(xué)相關(guān)性,從研究可以看出從迪慶州不同醫(yī)院分離菌株的PFGE帶型具有較大的差異,形成了兩個(gè)大的聚類群,說明不同醫(yī)院的流行株是不同的克隆群,這對于加強(qiáng)院內(nèi)感染的控制顯得十分重要。
[1] ENRIGHT,M C ,D A ROBINSON,G RANDLE,et al.The Evolutionary History of Methicillin-resistant Staphylococcus Aureus (MRSA) [J].Proc Natl Acad Sci U S A A,2002,99(11): 7687-7692.
[2] MCVICKER,G,T K PRAJSNAR,A.WILLIAMS,et al.Clonal Expansion During Staphylococcus Aureus Infection Dynamics Reveals the Effect of Antibiotic Intervention[J].PLoS Pathog Pathog,2014,10(2):e1003959.
[3] PETRY,V,G R BESSA,C S POZIOMCZYCK,et al.Bacterial Skin
Colonization and Infections in Patients with Atopic
Dermatitis [J].An Bras Dermatol Dermatol,2012,87(5): 729-734.
[4] POLISENA,J,S Chen,K Cimon,et al. Clinical Effectiveness of Rapid Tests for Methicillin Resistant Staphylococcus Aureus (MRSA) in Hospitalized Patients: A Systematic Review [J].BMC Infect Dis Dis,2011,11:336.
[5] YOUNG,B C,T GOLUCHIK,E M BATTY,et al. Evolutionary Dynamics of Staphylococcus Aureus During Progression from Carriage to Disease [J].Proc Natl Acad Sci USA,2012,109(12):4550-4555.
[6] SONG,J H ,P R Hsueh,D R CHUNG,et al. Spread of Methicillinresistant Staphylococcus Aureus Between the Community and the Hospitals in Asian Countries: an ANSORP Study [J].J Antimicrob Chemother Chemother,2011,66(5):1061-1069.
[7] LI,J ,L WANG,M Ip,et al.Molecular and Clinical Characteristics of Clonal Complex 59 Methicillin- resistant Staphylococcus Aureus Infections in Mainland China [J]. PLoS One One,2013,8(8):e70602-70603.
[8] KO,K S,J Y Lee,J Y Suh,et al.Distribution of Major Genotypes Among Methicillin-resistant Staphylococcus Aureus Clones in Asian Countries[J].J Clin Microbiol, 2005,43(1):421-426.
[9] THWAITES,G E.The Management of Staphylococcus Aureus Bacteremia in the United Kingdom and Vietnam: A Multi-Centre Evaluation [J].PLoS One One,2010,5(12):e14170-14171.
[10] COOMBS G W ,S MONECKE,R EHRICHT ,et al.Differentiation of Clonal Complex 59 Community-Associated Methicillin-Resistant StaphyLococcus Aureus in Western Australia [J]. Antimicrob Agents Chemother Chemother,2010,54(5): 1914-1921.
(本文編輯:閆云麗)
Analysis on 19 MRSA molecular epidemiology in Diqing prefecture of Yunnan province
YANG Li-tian1, HE Cun-ying1, QIN Yan-tao1, GU Wen-pen2
(1. Diqing Center for Diseases Control and Prevention,Diqing Yunnan 674400, China 2.Yunnan Center for Diseases Control and Prevention,Kunming Yunnan 650000, China )
ObjectiveWe do epidemiological analysis on isolated MRSA(methicillin-resistant Staphylococcus aureus )bacteria strain in two hospitals from 2012 to 2013 in Diqing.MethodsAnalysis is by Pulsed-feld gel electrophoresis (PFGE) and multilocus sequence typing (MLST) methods. Analyzes and studies 19 strain MRSA by drug sensitivity test and virulence genes test detection.ResultsThe results shows all the MRSA were resistant to β-lactamase antibiotics, parts of the strains were resistant to quinolone, macrolides, tetracycline and trimethoprim/sulfamethoxazole. All the MRSA had the hemolysin genes, and different combined enterotoxin genes. 11 PFGE patterns and 3 ST types were shown for all the MRSA, ST59 and ST121 were the major types.ConclusionsThe antibiotics resistant problem become serious issue in Diqing prefecture, and different virulence genes increased the pathogenic abilities of the bacteria. PFGE shows the higher discriminatory power than MLST typing method for MRSA; meanwhile, the PFGE results had the well correlation with the MLST typing results in our study.
MRSA, tolerance, molecular features,Diqing prefecture
R181.2+6
A
1003-2800(2015)03-0172-03
2014-09-11
國家科技重大專項(xiàng)(2012ZX10004-212)
楊麗天(1966-),男,云南麗江人,專科,主管醫(yī)師,主要從事流行病學(xué)方面的研究。
古文鵬(1982-),男,云南昆明人,碩士,技師,主要從事病原微生物學(xué)方面的研究。

