尖孢鐮刀菌古巴專化型4號生理小種fpd1基因敲除與表型分析
王飛燕 郭立佳 楊臘英 汪軍 王國芬 黃俊生

摘 ?要 ?為了研究尖孢鐮刀菌古巴專化型4號生理小種fpd1基因的功能,構建了該基因敲除突變體并對其表型特征進行了分析。結果表明,與野生型菌株相比,fpd1基因敲除突變體生長減慢,產孢量顯著降低,對巴西蕉的致病性明顯減弱;fpd1基因可能在尖孢鐮刀菌古巴專化型的產孢、生長發育和致病性等方面具有重要作用。本研究結果為進一步研究fpd1基因的功能和尖孢鐮刀菌的致病機理奠定了基礎。
關鍵詞 ?尖孢鐮刀菌古巴專化型;fpd1基因;敲除;致病性;產孢
中圖分類號 ?S482.2 ? ? ? ? ?文獻標識碼 ?A
Construction and Phenotype Analysis of the fpd1 Deletion Mutants of the Fungal Pathogen Fusarium oxysporum f. sp. Cubense
WANG Feiyan1,2,GUO Lijia2,YANG Laying2,WANG Jun2,
WANG Guofen2,HUANG Junsheng1*
1 Hainan University,Haikou,Hainan 570228,China
2 Environment and Plant Protection Institute,Chinese Academy of Tropical Agricultural Sciences/
Key Laboratory of Monitoring and Control of Tropical Agricultural and Forest Invasive
Alien Pests,Ministry of Agriculture,Haikou,Hainan 571101,China
Abstract ?To investigate the function of fpd1 in Fusarium oxysporum f. sp. Cubense race 4(Foc4),the fpd1 deletion mutants were constructed and its phenotypic characteristics were analyzed. The results showed that the mutant had a slower growth rate on potato dextrose agar (PDA) plates, and reduced conidiation compared to the wild-type strain. Additionally,the mutants showed decreased pathogenicity to bananas(Musa spp. cv. Brazil). Therefore the fpd1 gene in Foc4 plays an important role on conidiation,growth, pathogenicity. The data lay the foundation for further study on the function of fpd1 gene and the pathogenic mechanism in Foc4.
Key words ?Fusarium oxysporum f. sp. Cubense;fpd1 gene;Deletion;Pathogenicity;Conidiation
doi ?10.3969/j.issn.1000-2561.2015.08.017
香蕉枯萎病又稱香蕉黃葉病、香蕉巴拿馬病,由尖孢鐮刀菌古巴專化型(Fusarium oxysporum f. sp. Cubense)從香蕉根系侵入并造成維管束萎蔫和植株枯萎,是一種典型的土傳維管束病害,病原菌主要有1號和4號生理小種[1-4]。該病菌為制約香蕉產業發展的重要病原菌之一,目前尚無理想的化學防治藥劑,生產上主要通過選育抗病品種予以防治[5]。
目前,已有許多學者對重要經濟作物枯萎病害病原菌尖鐮孢的致病基因、毒力基因、致病相關基因等進行了大量的研究[6-12]。香蕉枯萎病菌致病基因主要包括信號轉導相關基因、轉錄因子基因、克服植物防御系統相關基因以及與鐮刀菌自身定殖能力相關的基因,如fmk1、ste12 、fow1、fow2和six1等[10-12]。將T-DNA插入突變體庫和基因敲除策略是鑒定尖孢鐮刀菌的重要致病基因的主要手段[13-15]。
關于尖孢鐮刀菌fpd1基因的研究主要集中于番茄專化型,對尖孢鐮刀菌番茄專化型 fpd1基因的研究結果表明,其編碼的產物部分與非洲爪蟾(Xenopus laevis)的氯離子電導調節蛋白(chloride conductance regulatory protein, ICln)相似,為一種跨膜蛋白,是一個致病性相關基因[16-18]。而尖孢鐮刀菌古巴專化型的fpd1基因具體功能則尚未見報道。
香蕉枯萎病原菌古巴專化型4號生理小種的fpd1基因全長為1 013 bp,含有一個47 bp的內含子,編碼序列長度為966 bp。與 1 號生理小種相比,4號生理小種fpd1基因全長多24 bp,兩者有31個核苷酸堿基位點存在差異,同源性為 99.3%[19]。
筆者采用DNA重組策略敲除香蕉枯萎病菌4號生理小種致病相關基因fpd1,構建該基因敲除突變體,研究其對菌株產孢量、生長和菌落形態等特征及致病力的影響,以完善該基因的具體功能研究,為尖孢鐮刀菌的致病機理研究提供基礎理論。
1 ?材料與方法
1.1 ?材料
1.1.1 ?菌株和質粒 ? 菌株為尖孢鐮刀菌古巴專化型(Fusarium oxysporum f. sp. cubense)4號小種菌株B2。質粒為pCT74質粒,由中國熱帶農業科學院環境與植物保護研究所微生物資源研究利用課題組保存。
1.1.2 ?培養基及試劑 ? PDA培養基(馬鈴薯200 g/L、葡萄糖20 g/L、瓊脂18 g/L,不加瓊脂為PDB培養基);再生培養基(馬鈴薯200 g/L、蔗糖1.2 mol/L、瓊脂0.9%);STC溶液[山梨醇1.2 mol/L、氯化鈣0.5%、Tris-HCl 100 mmol/L(pH7.0)、EDTA 25 mmol/L];PTC溶液[將40%(W/V)PEG4000溶于STC溶液,用過濾器(孔徑0.2 μm)進行過濾];0.8 mol/L氯化鈉溶液;Driselase崩潰酶溶液(20 ?mg/mL,Sigma)和Lysing Enzyme溶壁酶(20 mg/mL,廣東省微生物研究所),均用0.8 mol/L氯化鈉溶液配制。
1.1.3 ?植物材料 ?供試香蕉品種為巴西蕉(Musa spp. cv. Brazil),由中國熱帶農業科學院組織培養中心提供。
1.2 ?方法
1.2.1 ?真菌基因組DNA提取 ? 將B2菌株接種于PDB培養基,于180 r/min、28 ℃搖床震蕩培養5 d,過濾收集菌絲體用于基因組DNA提取。DNA提取采用CTAB法[20]。
1.2.2 ?fpd1基因敲除載體構建 ?根據基因組測序序列分別設計fpd1基因5′和3′端同源臂特異引物對,分別標記為fpd1-AF和fpd1-AR、fpd1-BF和fpd1-BR(表1)。以野生型B2(WT)基因組DNA為模板,分別用特異引物對進行PCR擴增,獲得fpd1基因開放閱讀框上游5′端和下游3′端同源臂DNA片段,分別標記為A臂和B臂。PCR反應體系如下:模板50 ng,引物濃度均為10 pmol/L,2×Taq PCR master Mix(TIANGEN)12.5 μL,用ddH2O將總體系補足至25 μL。PCR反應條件為:94 ℃ 5 min;94 ℃ 30 s, 55 ℃ 30 s, 72 ℃ 1 min,30個循環;72 ℃ 10min,4 ℃保溫。經1.0%瓊脂糖凝膠電泳后回收PCR產物。
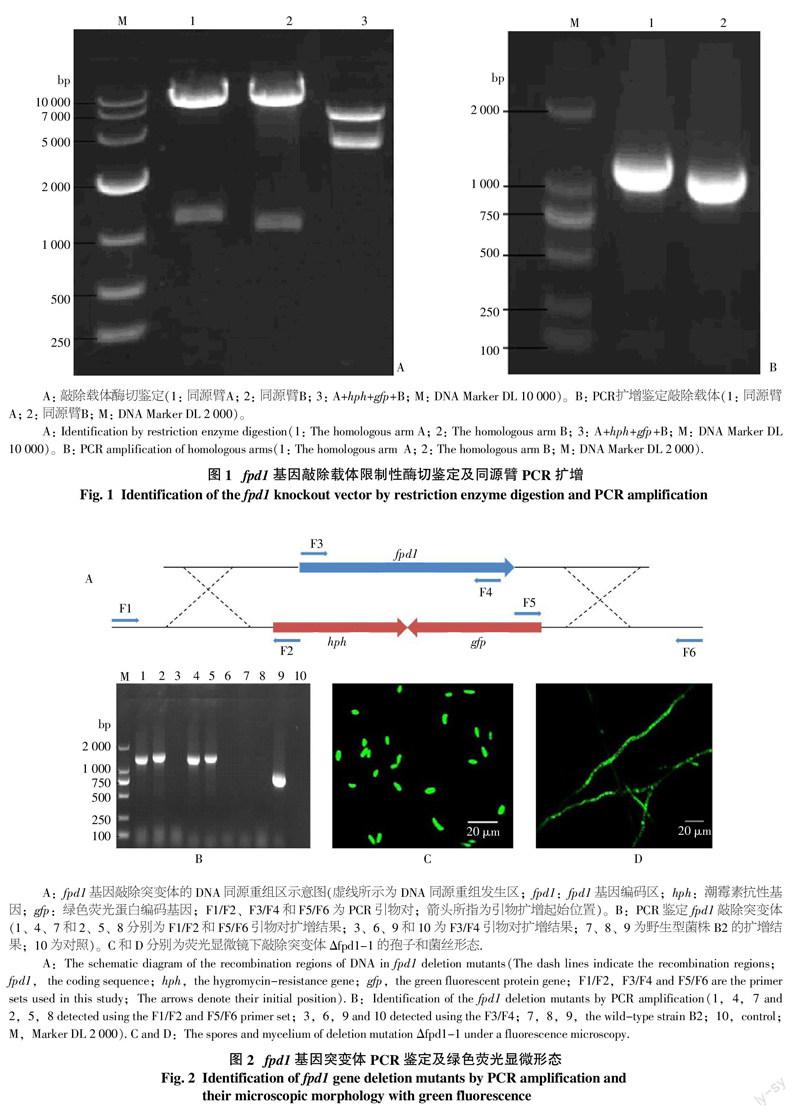
將PCR產物分別連接于pMD19T載體,構建pMD19T-A和pMD19T-B克隆載體;將克隆載體分別用限制性內切酶KpnⅠ和XhoⅠ、EcoRⅠ和 XbaⅠ組合進行酶切,獲得5′端和3′端同源臂DNA,分別先后連接于經相同限制性內切酶線性化的pCT74載體(其中含潮霉素抗性基因hph和GFP基因表達盒)中,構建fpd1基因敲除載體;再用KpnⅠ和XbaⅠ從敲除載體上切下用于轉化的DNA片斷,即A+hph+GFP+B,回收純化備用。
1.2.3 ?尖孢鐮刀菌原生質體制備和DNA轉化 ? 從新活化的尖孢鐮刀菌平板中獲取7 mm菌餅,將其接種于PDB培養基中,于28 ℃搖床培養5 d;用滅菌的2層擦鏡紙過濾去除菌絲,獲得孢子懸浮液(濃度約為107 cfu/mL);吸取2 mL孢子液接種于PDB培養基中,以28 ℃、120 r/min搖床培養9~10 h;用滅菌的6層擦鏡紙收集菌絲,并用0.8 mol/L NaCl沖洗菌絲,充分洗滌;挑取黃豆大小(直徑約3 mm)的菌絲,加入崩潰酶和溶壁酶溶液各6 mL,以28 ℃、150 r/min消化酶解2~3 h;用滅菌的2層擦鏡紙過濾,收集濾液,于室溫中以3 500 r/min 離心10 min,棄上清;加30 mL STC重懸沉淀,于室溫中以3 500 r/min 離心10 min,棄上清;加入1~2 mL STC, 將原生質體調整至濃度約為107 cfu/mL。
取5 μg上述酶切回收的DNA片段,即A+hph+GFP+B DNA片段,緩慢加到200 μL 原生質體中,輕輕混勻,于室溫中靜置20 min;緩慢加1~1.25 mL 40% 的PTC溶液至管中,輕輕混勻,于室溫中靜置20 min;將上述反應液加入100 mL冷卻至50 ℃左右的再生培養基(含有100 μg/mL Amp 和50 μg/mL 潮霉素B)中,混勻后,倒于培養皿上;于28 ℃中恒溫培養4~7 d 后獲得轉化子,并連續培養3代獲得穩定轉化子。
1.2.4 ?fpd1基因敲除突變體的鑒定 ?采用CTAB法[20]提取轉化子基因組DNA,經紫外分光光度計檢測合格后,將其作為PCR擴增的模板;分別以轉化子和野生型菌株B2基因組DNA為模板,根據基因組序列設計特異引物對進行PCR擴增檢測。其中,引物F1和F2檢測轉化子是否在fpd1基因開放閱讀框5′端發生同源重組;引物F5和F6檢測轉化子是否在fpd1基因開放閱讀框3′端發生同源重組;引物F3和F4檢測轉化子是否存在fpd1基因開放閱讀框,預計擴增長度分別約1.3、1.4、0.8 kb(表1)。如果引物F1和F2、F5和F6 的PCR擴增結果為陽性而引物F3和F4的 PCR擴增結果為陰性,則此轉化子即為fpd1基因敲除突變體。PCR反應體系如下:模板100 ng,引物濃度均為10 pmol/L,2×Taq PCR master Mix(TIANGEN)12.5 μL,用ddH2O將總體系補足至25 μL。PCR反應條件為:94 ℃ 預變性5 min;94 ℃變性 40 s, 55 ℃退火 30 s,72 ℃延伸 2 min,共30個循環;72 ℃ 10 min,4 ℃保溫。
1.2.5 ?突變體表型分析 ? 生長速率測定:將敲除突變體與野生型菌株B2 的菌餅(約7 mm)分別接種于PDA平板上培養,每個菌株接種3個重復,5 d后測量菌落直徑。
產孢量分析:分別從長有fpd1敲除突變體和野生型菌株B2(均培養了5 d) 的PDA平板上打7 mm的菌餅5個,放入含有20 mL 0.05% 吐溫-20的蒸餾水中,慢速搖5 min,然后采用血球計數板計數。
突變體形態顯微鏡觀察:從PDB培養液中吸取少量菌液到載玻片上,制片后在熒光顯微鏡(FV1000,Olympus)下觀察拍照。
1.2.6 ?致病性測定及統計 ? 選取長勢相近的巴西香蕉苗(株高約10 cm,5~6片葉子)種植于一次性塑料碗中;將培養了5 d的fpd1敲除突變體和野生型菌株經過濾離心回收孢子,并用蒸餾水制孢子懸液(約106 cfu/mL),每株苗澆50 mL孢子液,以無菌水澆苗作為對照,每個菌株致病性測定設置3個重復,每個重復取10株幼苗;處理后,按常規方法栽培管理,并觀察植株的發病情況;4周后調查病害發生情況,將球莖從中間縱向切開,觀察球莖褐變程度,記錄每株幼苗發病級數[20]。
1.3 ?數據處理
采用SAS 9.2分析軟件對產孢量、菌落直徑大小和病情指數進行顯著性分析。香蕉幼苗發病情況用病情指數表示,病情指數計算采用如下公式:
病情指數=100×∑(植株發病級數×對應株數)/(植株發病最高級數×總株數)[20]。
2 ?結果與分析
2.1 ?fpd1基因敲除載體構建
對構建的敲除載體pCT74-fpd1進行酶切驗證。結果表明,用限制酶KpnⅠ和XhoⅠ可從敲除載體pCT74-fpd1上切下約1 100 bp的DNA條帶,即A臂;用限制酶 EcoRⅠ和XbaⅠ可從載體上切下B臂,約1 004 bp;用KpnⅠ和和XbaⅠ限制酶可從載體上切下同源重組片段A+hph+gfp+B,與預計大小一致(圖1-A)。同時對載體的A臂和B臂進行PCR擴增鑒定,結果均可擴增到1條1 kb左右的DNA同源臂(圖1-B)。將載體進行測序,測序結果表明所克隆的DNA片段正確。這些結果表明fpd1基因敲除載體已構建成功。
2.2 ?PCR鑒定fpd1 敲除突變體
經再生培養和潮霉素抗性篩選,共獲得10個轉化子。分別提取野生型菌株B2基因組DNA和轉化子基因組DNA,并以之為模板,分別用引物對F1/F2、F3/F4和F5/F6進行PCR擴增(圖2-A)。結果顯示(圖2-B),以其中2個轉化子DNA為模板,用引物對F1/F2和F5/F6進行PCR擴增分別獲得約1.3、1.4 kb 的DNA條帶(泳道1和2,4和5),與預計大小一致,而野生型菌株模板無此PCR擴增條帶(泳道7和8)。用引物對F3/F4進行PCR擴增,結果顯示,以2轉化子基因組DNA和清水為模板均無擴增條帶(泳道3、6和10),而以野生型菌株DNA為模板進行PCR擴增,可擴增到約0.8 kb的DNA條帶(泳道9)。這些結果表明這2個轉化子的fpd1基因已被敲除,故將其分別命名為Δfpd1-1和Δfpd1-2。其中Δfpd1-1的孢子和菌絲熒光顯微鏡圖分別見圖2-C、D。
2.3 ?fpd1敲除突變體表型分析
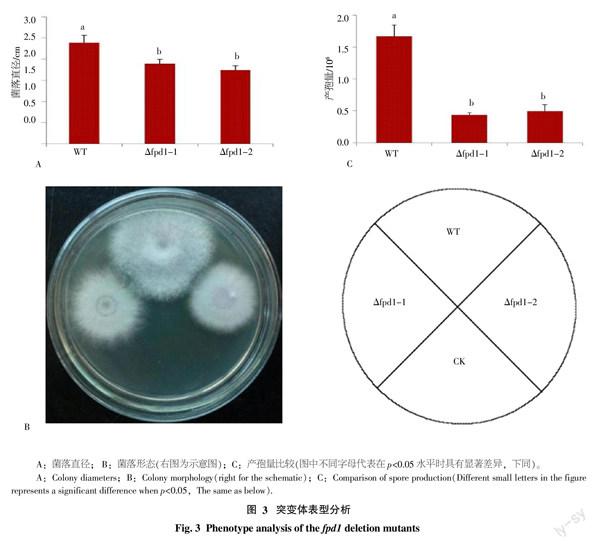
將fpd1基因敲除突變體菌株Δfpd1-1、Δfpd1-2和野生型菌株B2分別接種于PDA平板上并培養5 d,測量其菌落直徑。結果表明,野生型B2菌落平均直徑(2.39 cm)大于敲除突變體菌株Δfpd1-1和Δfpd1-2的菌落平均直徑(1.89 cm和1.74 cm),而且差異極顯著(p<0.01)。此外,與野生型相比,突變體的菌落不能形成大量氣生菌絲(圖3-A、B)。
將Δfpd1-1、Δfpd1-2突變體和野生型菌株B2分別接種于PDA平板上培養5 d,計算單菌落產孢量。結果表明,2個突變體菌株單菌落產孢量(0.44×106和0.5×106)均極顯著(p<0.01)低于野生型B2菌株單菌落產孢量(1.67×106,圖3-C)。
綜合研究表明,fpd1基因敲除突變體菌絲生長減慢,產孢量減少。由此可見,fpd1基因對尖孢鐮刀菌4號生理小種的菌絲生長和產孢具有重要的作用。
2.4 ?fpd1基因敲除突變體對巴西蕉的致病性
將fpd1基因敲除突變體菌株Δfpd1-1、Δfpd1-2與野生型菌株B2分別接種巴西蕉幼苗。根據病情指數統計,結果表明,接種fpd1基因敲除突變體菌株Δfpd1-1和Δfpd1-2的巴西蕉幼苗平均病情指數(14.4和16.2)均極顯著(p<0.01)低于野生型菌株B2(61.3)(圖4)。由此可見,fpd1基因敲除導致尖孢鐮刀菌對巴西蕉的致病性減弱。
3 ?討論與結論
氯離子電導調節蛋白(ICln)是非洲爪蟾(Xenopus laevis)膜通道蛋白離子傳導孔的一個亞基,功能上與動物溶脹相關的氯離子通道有關[16-17]。Kawabe等[18]研究發現,與非洲爪蟾的氯離子電導調節蛋白相似的番茄專化型FPD1蛋白是致病因子,該基因缺失會導致致病性減弱;而蛋白氨基酸序列比對分析發現,尖孢鐮刀菌古巴專化型的FPD1蛋白與非洲爪蟾的氯離子電導調節蛋白序列相似性僅為15.9%,與番茄專化型FPD1蛋白相似性為99.7%。因此,筆者推測尖孢鐮刀菌古巴專化型的FPD1蛋白具有與番茄專化型FPD1蛋白相似功能,可能參與尖孢鐮刀菌的致病性。
筆者通過基因敲除的策略獲得了尖孢鐮刀菌古巴專化型4號生理小種的fpd1基因敲除突變體。通過表型分析發現,與野生型菌株相比,fpd1基因敲除突變體孢子產量降低,生長較緩慢,即其在PDA平板上的菌落直徑小于野生型(圖3),這些結果與古巴專化型的fgb1、ste12、fomps1等基因敲除突變體的研究結果相似[10-12,21]。同時筆者通過致病性測定,發現fpd1基因敲除突變體的致病力明顯低于野生型,表明fpd1基因敲除導致其致病力降低,這與郭立佳等[22]報道的尖孢鐮刀菌古巴專化型fgb1基因的研究結果相似。綜上分析,筆者認為fpd1基因對尖孢鐮刀菌古巴專化型的產孢、菌絲生長情況以及致病性等方面具有調控作用。另外,根據尖孢鐮刀菌番茄專化型fpd1基因的相關研究結果,FPD1具有氯離子電導調節蛋白部分相似結構,是一種跨膜轉運蛋白,因此,筆者推測尖孢鐮刀菌古巴專化型可能通過調控離子跨膜運輸影響其產孢、菌絲生長情況和致病力。關于fpd1基因突變體致病性減弱的具體機理有待進一步研究。
參考文獻
[1] 黃小光, 徐志宏, 鄺哲師, 等. 香蕉枯萎病拮抗菌篩選試驗[J]. 廣東農業科學, 2006(11): 96.
[2] 胡莉莉, 竇美安, 謝江輝, 等. 香蕉枯萎病抗病性研究進展[J]. 廣西熱帶農業, 2006, 8(1): 57-60.
[3] Waite B H, Stover R H. Studies on fusarium wilt of bananas: VI. Variability and the cultivar concept in fusarium oxysporum f. cubense[J]. Canadian Journal of Botany, 1960, 38(6): 985-994.
[4] Su H, Hwang S C, Ko W H. Fusarial wilt of Cavendish bananas in Taiwan[J]. Plant Disease, 1986, 70(9): 814-818.
[5] Michielse C B, Rep M. Pathogen profile update: Fusarium oxysporum[J]. Molecular Plant Pathology, 2009, 10(3): 311-324.
[6] De Ascensao A R, Dubery I A. Panama disease: cell wall reinforcement in banana roots in response to elicitors from Fusarium oxysporum f. sp. cubense race four[J]. Phytopathology, 2000, 90(10): 1 173-1 180.
[7] Visser M, Gordon T R, Wingfield B D, et al. Transformation of Fusarium oxysporum f. sp. Cubense, causal agent of Fusarium wilts of banana, with the green fluorescent protein (GFP)gene[J]. Australasian Plant Pathology, 2004, 56(33): 69-75.
[8]代 ?易, 紀春艷, 王振中, 等. 香蕉多聚半乳糖醛酸酶抑制蛋白的分離與純化[J]. 華中農業大學學報, 2011, 30(6): 707-711.
[9] 吳飛宏. 香蕉枯萎病菌4號小種一個致病相關基因克隆及其功能的初步研究[D]. 海口: 海南大學, 2012: 13-26.
[10] Rispail N, Di Pietro A. Fusarium oxysporum Ste12 controls invasive growth and virulence downstream of the Fmk1 MAPK cascade[J]. Molecular Plant-Microbe Interactions, 2009, 22(7): 830-839.
[11] Michielse C B, Van Wijk R, Reijnen L, et al. Insight into the molecular requirements for pathogenicity of Fusarium oxysporum f. sp. lycopersici through large-scale insertional mutagenesis[J]. Genome Biology, 2009, 10(1): R4.
[12] Pietro A D, Madrid M P, Caracuel Z, et al. Fusarium oxysporum: exploring the molecular arsenal of a vascular wilt fungus [J]. Molecular Plant Pathology, 2003, 4(5): 315-325.
[13]蔣艷琴, 曾 ?濤, 陳漢清, 等. 尖鐮孢古巴專化型Focr4-1701突變體的生物學表型研究[J]. 基因組學與應用生物學, 2013, 32(3): 339-346.
[14] Li M H, Xie X L, Lin X F, et al. Functional characterization of the gene FoOCH1 encoding a putative alpha-1,6-mannosyltransferase in Fusarium oxysporum f. sp. cubense[J]. Fungal Genetics and Biology, 2014, 65(1): 1-13.
[15] Qi X Z, Guo L J, Yang L Y, et al. Foatf1, a bZIP transcription factor of Fusarium oxysporum f. sp. cubense, is involved in pathogenesis by regulating the oxidative stress responses of Cavendish banana(Musa spp.)[J]. Physiological and Molecular Plant Pathology, 2013, 84:76-85.
[16] Grigory B K, Michael JA, Eric AG, et al. Molecular characterization of a swelling induced chloride conductance regulatory protein, pICIn[J]. ?Cell, 1994, 76(3): 439-448
[17] Fürst J, Jakab M, Konig M, et al. Structure and function of the ion channel ICIn[J]. Cell Physiol Biochem, 2000, 10(5-6): 329-334
[18] Kawabe M, Mizutani K, Yoshida T, et al. Cloning of the pathogenicity-related gene FPD1 in Fusarium oxysporum f. sp. Lycopersici[J]. Journal of General Plant Pathology, 2004, 70(1): 16-20.
[19]唐復潤. 香蕉枯萎病菌FPD1基因的克隆、表達及其生防菌分離、 篩選[D]. 儋州: 華南熱帶農業大學, 2007.
[20]郭立佳, 彭 ?軍, 楊臘英, 等. 大蕉枯萎病病原菌的分離、 鑒定和致病性測定[J]. 熱帶作物學報, 2013, 34(1): 105-110.
[21] 戴青冬. 香蕉枯萎病菌MAPK信號通路中Fomps1基因的研究[D]. 海口: 海南大學, 2013.
[22] 郭立佳, 楊臘英, 王國芬, 等. 尖孢鐮刀菌古巴專化型fgb1基因敲除突變體的構建與表型分析[J]. 熱帶作物學報, 2014, 35(11): 2 205-2 210.

