微小RNA-143誘導胃癌細胞株BGC-S23凋亡機制的探討
霍中華,張曉燕,邱 彥,劉菲菲
·臨床醫學··論著·
微小RNA-143誘導胃癌細胞株BGC-S23凋亡機制的探討
霍中華,張曉燕,邱 彥,劉菲菲
目的 探討微小RNA-143(miRNA-143)誘導胃癌細胞BGC-823產生凋亡的機制。方法 生物信息學預測B淋巴細胞瘤-2基因(B-cell lymphoma-2,bcl-2)3'非編碼區(untranslation region,UTR)是否存在miRNA-143的結合位點;熒光定量及免疫印跡方法檢測胃癌細胞株(BGC-823)及正常胃黏膜細胞株(GES-1)中Bcl-2 mRNA及其蛋白含量;熒光素酶報告基因法驗證結合位點;化學法合成miRNA-143-mimics、inhibitor及NC序列并轉染BGC-823細胞,轉染后48 h收集細胞、蛋白質印跡法檢測細胞內Bcl-2蛋白含量;實時定量PCR檢測轉染后不同時間點BGC-823細胞內miRNA-143含量變化,同時流式法檢測BGC-823細胞凋亡。結果 與GES-1細胞比較,BGC-823細胞中Bcl-2蛋白含量及miRNA-143含量差異有統計學意義(P<0.01);miRNA-143-mimics、miRNA-143-inhibitor與野生型熒光素酶報告基因共轉染組可以明顯抑制或者增強熒光素酶活性,轉染后48 h,組間酶活性差異有統計學意義(P<0.05),miRNA-143-mimics和miRNA-143-inhibitor轉染對突變型熒光素酶報告基因活性無明顯影響,差異無統計學意義(P>0.05);BGC-823細胞轉染miRNA-143-mimics和miRNA-143-inhibitor能夠明顯抑制或者促進細胞內Bcl-2蛋白表達,差異有統計學意義(P<0.05);miRNA-143-mimics和miRNA-143-inhibitor轉染細胞能夠明顯引起細胞內miRNA-143含量的改變,轉染后48 h,miRNA-143-mimics轉染組細胞內miRNA-143含量明顯上升,miRNA-143-inhibitor轉染組細胞內miRNA-143含量明顯下降,差異有統計學意義(P<0.05),陰性對照轉染對照組和轉染對照組比較,差異無統計學意義(P>0.05);細胞凋亡檢測結果表明,miRNA-143表達量的升高能夠明顯引起BGC-823細胞的凋亡,基因干預組與轉染對照組相比較,差異具有統計學意義(P<0.05)。結論 miRNA-143通過抑制Bcl-2基因表達,可引起胃癌細胞株BGC-823細胞產生凋亡。
B淋巴細胞瘤-2;胃癌細胞株;微小RNA-143;凋亡
據統計,近5年來,我國每年新發胃癌40萬例,發病率占全世界的42%左右,我國胃癌患者約占全球胃癌患者總數的40%[1]。預計到2015年,我國胃癌的發病率還將以每年1.6%的幅度攀升,數據驚人,研究胃癌發病機制,尋找新的有效治療途徑,刻不容緩。
在Bcl-2蛋白家族中,目前已發現25種Bcl-2同源蛋白,其成員與細胞凋亡具有密切的關系。人Bcl-2基因于1984年被發現,Bcl-2基因在眾多調節細胞程序性凋亡家族基因中被發現[2]。細胞增殖異常性疾病,同時也是細胞凋亡異常性疾病,細胞凋亡失控是導致腫瘤發生發展的重要方面,有研究表明, Bcl-2做為凋亡的抑制物,其與胃癌的關系密切[3-4]。胃癌的形成與Bcl-2的高表達有關,而且主要作用階段在癌變的早期,提示Bcl-2蛋白可能在胃癌的發病和治療反應性方面起重要作用[5]。由于Bcl-2基因異常表達導致腫瘤惡性程度不斷升高,Bcl-2基因不同程度地參與了胃癌的凋亡調控[3],故Bcl-2基因與胃癌的演進有關,在腫瘤的化療中Bcl-2基因可通過抑制腫瘤細胞的凋亡而影響有效的治療。本研究對胃癌細胞株BGC-823細胞及正常胃黏膜細胞GES-1細胞中Bcl-2的基因蛋白表達進行檢測和差異分析,通過生物信息預測可能對Bcl-2基因表達進行調控的miRNAs,通過熒光素酶報告基因系統對預測靶位關系進行驗證,最終在BGC-823細胞中干預miRNA表達,通過調整Bcl-2蛋白表達來誘導腫瘤細胞凋亡的可行性,為胃癌的臨床治療提供新的基因靶點。
1 材料與方法
1.1 細胞與試劑
實驗用細胞株均購于中國科學院上海細胞所。胎牛血清,RPMI-1640細胞培養基、胰蛋白酶為Hyclone公司產品,轉染試劑、Trizol,cDNA制備試劑盒均購于美國Invitrogen公司,熒光素酶報告基因表達載體和熒光素酶活性檢測均為Promega公司產品,蛋白一抗及二抗為美國CST公司產品,細胞總蛋白提取、定定量試劑盒、化學發光試劑盒均為美國Pierce公司產品,miRNA合成、測序均在上海生工進行,細胞凋亡檢測試劑盒為BD公司產品。
1.2 儀器和設備
細胞培養箱為日本三洋公司產品,離心機為Beckman公司產品,微量移液器為Gilson公司產品,電泳儀,垂直電泳槽及濕法轉膜儀均為Bio-rad公司產品,酶標儀Thermo公司產品,PCR儀購于ABI公司,流式細胞儀為BD公司產品。
1.3 實驗方法
1.3.1 以Bcl-2為靶基因的miRNAs預測 采用targetscan預測軟件對Bcl-2(NM_000633)3'UTR區是否存在miRNA的結合位點。分析結果顯示,miRNA-143在Bcl-2基因3'UTR區存在結合位點,預測結果顯示(圖1),hsa-miRNA-143在Bcl-2基因的3' UTR區存在7個堿基的種子區。

圖1 hsa-m iRNA-143與Bcl-2的靶位關系預測
1.3.2 胃癌細胞株BGC-823及正常胃黏膜上皮細胞GES-1中Bcl-2蛋白含量及miRNA-143相對含量分析 取對數生長期的BGC-823細胞及GES-1細胞各5×106個,離心5 min收集細胞沉淀,分別提取細胞總蛋白和細胞總RNA,Western blotting檢測Bcl-2蛋白含量,RT-PCR檢測細胞內miRNA-143含量。(1)蛋白質印跡分析Bcl-2蛋白相對含量:向細胞沉淀中加入1 ml無菌磷酸鹽緩沖液(dPBS)洗細胞兩遍,去掉dPBS,每孔加入0.5 ml細胞裂解液,按照試劑盒說明書提取細胞總蛋白,BCA法定量細胞總蛋白濃度。定量后的細胞總蛋白,每組10μl進行垂直電泳,SDS-聚丙烯酰胺凝膠分離膠濃度為10%,經110 V電壓90 min電泳后,立春紅染色觀察蛋白條件是否完整,400 mA電流轉膜90 min,轉膜后5%的脫脂牛奶封閉2 h,4℃一抗過夜孵育,Bcl-2和GAPDH一抗稀釋(TBST)比分別為1∶300和1∶1 000;TBST洗膜3次,加入二抗孵育2 h,羊抗鼠二抗稀釋比為1∶4 000;TBST洗膜3次,添加化學發光液反應底物,暗室曝光,掃描曝光底片,統計目的條帶光密度值。目的蛋白光密度值/GAPDH光密度值,即為檢測蛋白相對含量。(2)成熟體miRNA-143含量檢測:對于每組細胞沉淀,使用4℃預冷dPBS洗去細胞表面殘留的培養液及血清;去掉PBS,每孔加入1 ml。4℃預冷的Trizol細胞裂解液,震蕩培養板充分裂解細胞,4℃5 min,將分層后的溶液上清轉移到無菌1.5 m l離心管,酚氯仿法抽提RNA,得到沉淀后用20μl DEPC水溶解,瓊脂糖凝膠電泳觀察RNA純度及完整性,紫外分光光度測定RNA濃度。取2μl的總RNA,逆轉錄制備cDNA,特異反轉錄引物,H.sapiens 6 snRNA:5'-TACCTTGCGAAGTGCTTAAAC-3',miRNA-143:5'-GTCGTATCCAGTGCGTGTCGTGGAGTCGGCAATTGCACTGGATACGAAGAGCT-3',取2μl反轉錄產物作為PCR反應模板,熒光定量法檢測miRNA-143含量檢測。2ΔΔCt法分析定量結果,內參選用U6(NM_001101. 3)。PCR反應引物序列為:U6-上游引物,5'-GTGCTCGCTTCGGCAGCACAT-3',U6-下游引物5'-TACCTTGCGAAGTGCTTAAAC-3';miRNA-143-上游引物5'-GCCGGCGCCCGAGCTCTGGCTC-3',miRNA-143-下游引物5'-TGAGATGAAGCACTGTAGCTC-3'。PCR反應使用20μl體系,其中,SYBR Premix Ex Tap 10μl,引物(20μM)各取0.2μl,模板使用量為2μl,反應體系用無菌H2O補足。PCR反應條件: 95℃變性10 s;58℃退火10 s;72℃延伸10 s,循環數設置為40。
1.3.3 hsa-miRNA-143與Bcl-2預測靶位關系的驗證 取對數生長期293細胞,Trizol裂解法提取細胞總RNA,反轉錄制備cDNA。設計針對Bcl-2基因3' UTR區設計PCR引物:上游引物為,5'-GCTCTAGA TTATATACCATTTATCTG-3',下游引物為,5'-GCTCTAGA TTTGCTCACAAATAGTGTATAGG-3',引物兩端分別添加XbaI酶切位點,PCR擴增包含miRNA-143靶位“5'-CAUCUCA-3'”在內的162 bp長的堿基序列。取2μl cDNA為模板,使用上面引物進行PCR擴增,94℃變性30s,55℃退30 s,72℃延伸10s,循環數為38個。擴增后使用XbaI對PCR產物進行酶切處理,酶切回收目的片段后克隆到PGL3-promoter熒光素酶報告基因表達載體,重組載體經序列分析后命名為pGL3-Pro-WT-Bcl-2。以pGL3-Pro-WT-Bcl-2為基礎,對miRNA-143靶位進行點突變,即將“5'-CATCTCA-3'”突變為“5'-ACCTATC-3'”,構建突變型熒光素酶報告基因表達載體pGL3-Pro-MT-Bcl-2。對2組熒光素酶報告基因表達載體進行無內毒素質粒DNA提取。同時,化學法合成RNA:miRNA-143-mimics,miRNA-143-inhibitor, miRNA-143-NC。
選取生長狀況良好且處于對數生長期的第三代293細胞,用胰酶消化并制備細胞懸液,臺酚藍染色后使用血小球計數板進行活細胞計數,使用完全培養基(DMEM+10%胎牛血清)調整細胞密度為1× 105個/m l,將細胞接種到6孔板,每孔加2 m l細胞懸液,37℃和5%CO2條件下培養24 h,參照Lipofectmaine 2000轉染試劑說明書進行質粒和RNA共轉染,同時每組細胞轉染100 ng的pGL-TK(海腎熒光素酶報告基因)作為熒光霉素活性的檢測參照。轉染后48 h,使用Promega公司的雙熒光素酶檢測系統和熒光素酶檢測儀進行熒光素酶含量檢測。
1.3.4 轉染miRNA-143對胃癌細胞株BGC-823胞內Bcl-2蛋白表達影響檢測 細胞轉染取對數生長期的BGC-823細胞,胰酶消化后收集細胞,使用含10%胎牛血清的DMEM培養基重懸細胞,調整細胞濃度至1×105個/ml,接種細胞到6孔細胞培養板,每孔添加2 ml細胞懸液,37℃和5%CO2條件下培養24 h,后進行轉染實驗,轉染過程按照Lipofectmaine 2000說明書進行。收集轉染后48 h的細胞,提取細胞總蛋白,Western blotting檢測細胞內Bcl-2蛋白相對含量。
1.3.5 轉染后細胞凋亡及細胞內miRNA-143含量檢測 實驗分為未轉染組、轉染對照組(NC)和miRNA-143-mimics單構轉染組,取轉染后48 h的BGC-823細胞,使用不含EDTA的0.25%胰酶消化細胞,收集細胞沉淀,使用dPBS洗細胞2遍,收集細胞沉淀,按Annexin V-FITC凋亡檢測試劑盒說明書加入PI及FITC,避光室溫孵育20 min后,上機檢測。激發波長Ex=488 nm,Annexin V-FITC的綠色熒光通過FITC通道(FL1)檢測,紅色熒光通過PI通道(FL2)檢測。同時,收集細胞,提取細胞總RNA, RealTime-PCR檢測細胞內miRNA-143相對含量。
1.4 統計學處理
所有操作均以SPSS 13.0統計軟件完成,實驗所得數據計量資料采用均數±標準差(±s)表示,采用單因素方差分析,其中多組資料兩兩比較采用LSD多重檢驗,檢驗水準a=0.05。P<0.05為差異有統計學意義。
2 結果
2.1 胃癌細胞BGC-823及胃黏膜上皮細胞GES-1細胞中Bcl-2蛋白及miRNA134含量檢測
2組細胞中Bcl-2蛋白含量檢測結果(圖1A)顯示,BGC-823細胞中Bcl-2蛋白相對含量(2.17± 0.28)明顯高于GES-1細胞(1.00±0.81),差異有統計學意義(P<0.01),這說明Bcl-2在胃癌細胞中呈高表達。miRNA-134相對含量檢測數據(圖1B)說明,BGC-823細胞中miRNA-143相對含量(0.21± 0.01)明顯低于GES-1細胞(1.00±0.10),差異有統計學意義(P<0.01)。2組結果說明,在胃癌細胞中Bcl-2蛋白表達與miRNA143含量顯著負相關(相關系數為0.91)。
2.2 熒光素酶報告基因表達載體構建
PCR擴增得到特異的PCR產物,通過與DNA Marker比對,其大小與理論值(172 bp)完全相符(圖2A)。成功構建野生型熒光素酶報告基因表達載體,并通過點突變成功構建野生型熒光素酶基因表達載體,測序分析與標準序列完全一致(圖2B)。
2.3 hsa-miRNA-143與Bcl-2基因靶位關系驗證
分別共轉染miRNA-143-mimics、miRNA-143-inhibitor、miRNA-143-NC與2組熒光素酶報告基因表達載體pGL3-Pro-WT-Bcl-2和pGL3-Pro-MT-Bcl-2,轉染后48 h,對于野生型熒光素酶報告基因表達載體,miRNA-143-mimic能夠明顯抑制熒光素酶活性,從36.80±6.18降至7.20±1.23,差異有統計學意義(P<0.01),而miRNA-143-inhibitor轉染組熒光素酶相對活性則從36.80±6.18上升到55.40± 9.12,與單獨野生型熒光素酶轉染組(37.8±4.2)比較,差異有統計學意義(P<0.05);對于突變性熒光素酶報告基因表達載體,miRNA-143-mimic共轉染(40.2±4.5)與pGL3-Pro-MT-Bcl-2單獨轉染組(39.8±4.1)比較,差異無統計學意義(P>0.05), miRNA-143-inhibitor轉染(39.2±4.9)對突變型熒光素酶報告基因活性(49.8±4.1)也無明顯影響(P>0.05);miRNA-143-NC與pGL3-Pro-WT共轉染組(36.60±7.22)對野生型熒光素酶報告基因表達載體轉染組熒光素酶活性(36.80±6.18)明顯影響,差異無統計學意義(P>0.05),miRNA-143-NC與pGL3-Pro-MT共轉染組(49.7±4.4)對突變型熒光素酶報告基因表達載體轉染組熒光素酶活性(49.8± 4.1)明顯影響,差異無統計學意義(P>0.05)。以上數據和結果說明,miRNA-143與Bcl-2基因之間的預測靶位確實存在。
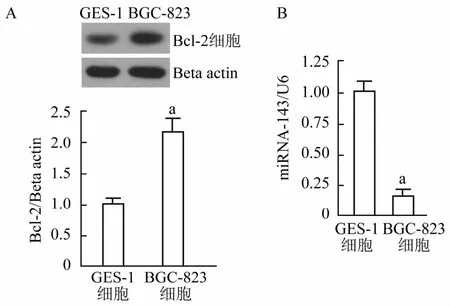
圖1 胃癌細胞BGC-S23及胃黏膜上皮細胞GES-1細胞中Bcl-2蛋白及m iRNA134含量檢測
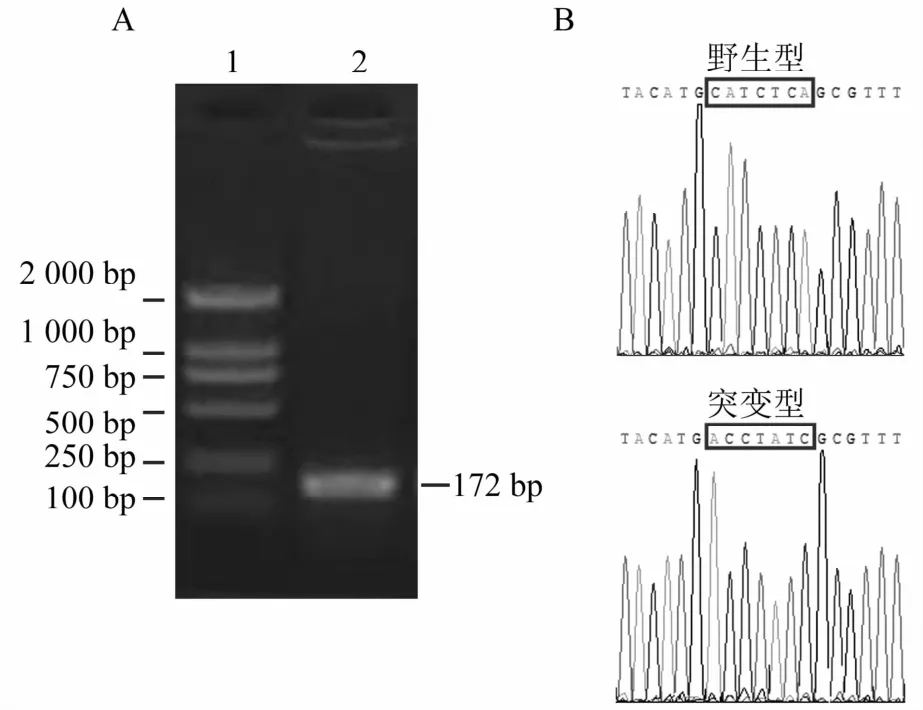
圖2 克隆構建及序列分析
2.4 轉染后BGC-823細胞內Bcl-2蛋白含量檢測
Western blotting檢測轉染miRNA-143后BGC-823細胞中Bcl-2蛋白相對含量。細胞轉染48 h后,轉染組細胞內Bcl-2蛋白含量較轉染對照組及對照轉染組均有明顯變化,其中轉染對照組Bcl-2蛋白含量為1.00±0.25,mimics轉染組細胞內Bcl-2蛋白含量為0.19±0.02,組間差異有統計學意義(P<0.01),inhibitor轉染組的細胞內Bcl-2蛋白則上升至1.36±0.36,與轉染對照組(1.00±0.25)比較,差異有統計學意義(P<0.05),轉染對照組(1.00± 0.25)與未轉染組(0.96±0.12)比較,差異無統計學意義(P>0.05),說明轉染試劑及轉染過程對BGC-823細胞內Bcl-2蛋白表達無明顯影響。見圖3。
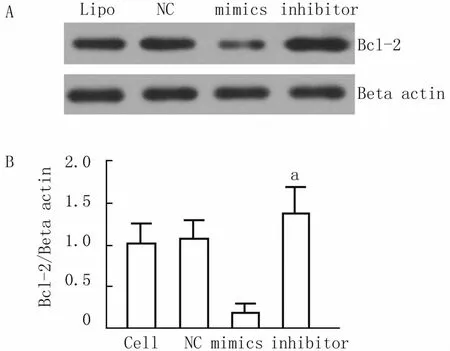
圖3 轉染后細胞內Bcl-2蛋白含量檢測圖
2.4 miRNA-143含量變化對BGC-823細胞凋亡的影響
細胞轉染后48 h,收集細胞,雙染法檢測轉染miRNA-143后細胞凋亡變化。流式檢測結果顯示,未轉染組,NC轉染組和miRNA-143-mimics轉染組細胞的凋亡率分別為(16.22±2.11)%、(16.92± 1.83)%和(48.25±4.13)%,miRNA-143轉染組與未轉染組及陰性對照轉染組比較,均有統計學差異(P<0.05)。這說明,miRNA143表達升高,可以使腫瘤細胞BGC-823產生凋亡。見圖4。
3 討論
microRNAs(miRNAs,微小RNA)是一類分布廣泛的內源性非編碼蛋白質的RNA,核酸長度一般為20~25個堿基。miRNAs具有高度保守的遺傳學特性,通過與基因3'UTR區的靶點結合,對基因進行轉錄后調控[6]。miRNAs與腫瘤的形成和發展具有密切關系,其在腫瘤發生發展中的作用更已成為國際生命醫學研究的熱點之一[7]。miRNA的表達與多種腫瘤進展及預后相關,可作為腫瘤標志分子。研究顯示,固有的miRNA調控機制失常,是多種腫瘤中癌基因及抑癌基因異常表達的內在原因[8]。
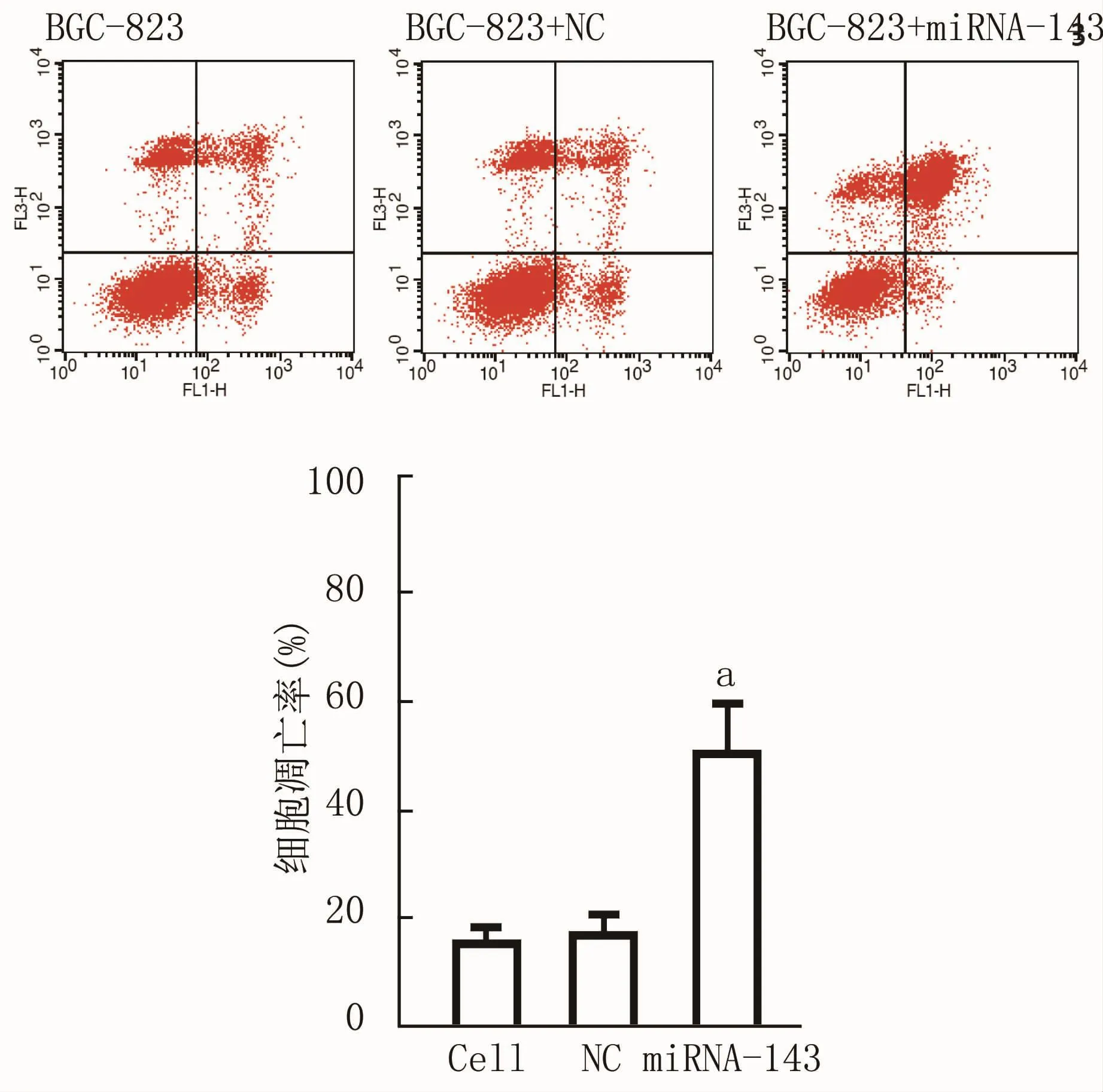
圖4 細胞增殖活性及m iRNA-143含量檢測圖
miRNA可以作為癌基因或抑癌基因發揮促癌或抑癌作用,miRNA與胃癌關系密切[9-10]。有研究人員使用miRNA芯片技術對胃癌及癌旁組織進行表達譜分析,結果發現miRNA-21、miRNA-191、miRNA-223、miRNA-24、miRNA-107、miRNA-92和miRNA-221等在胃癌中呈高表達[11],也有研究發現,相比于正常組織,胃癌組織中miRNA-128b、miRNA-129和miRNA-148的表達顯著降低[12]。胃癌是一種多基因疾病,其發生發展是一個多步驟參與、多種相關基因失活的結果,而miRNA在胃癌的發生發展中具有致癌或者作抑癌的雙重作用,microRNA在胃癌中表達失調的情況被相繼報道,Zhang等[13]研究發現miRNA-650在胃癌中表達上調,miRNA-21在人胃癌組織及細胞株中顯著性過表達[14],而miRNA-218被證實有潛力作為抑制胃癌轉移的靶向治療候選基因之一,miRNA-101在胃癌組織和胃癌細胞中顯著低表達。并且miRNA-101過表達可以明顯抑制細胞的增殖、侵襲和遷移[15]。盡管胃癌與miRNA關系的研究已取得一定的進展,尋找miRNA的靶蛋白或靶基因,研究調控miRNA表達的分子機制從而指導基因治療仍是該領域重要的研究方向。miRNAs是否通過Bcl-2對胃癌細胞凋亡產生調控作用,是一個值得研究的課題。
實驗中,筆者嘗試并尋找miRNA-143通過其靶基因Bcl-2基因對胃癌細胞凋亡具有調控作用的,并最終應運miRNA理論來解釋miRNA-143-Bcl-2與BGC-823細胞之間的關系。研究中,首先利用miRNA靶位的生物學預測在線軟件TargetScan進行分析,發現在Bcl-2的3'UTR有兩處位置存在miRNA-145的結合位點,對于預測的結合位點,則進一步通過熒光素酶報告基因進行了驗證,miRNA-143可以用過其位于保守區的結合位點,結合于3'UTR,并對其上有的基因翻譯產生抑制作用。而非保守區位點為無效位點,之所以出現這樣的原因,可能與位點所處位置有關,另外,從miRNA進化的角度考慮,其對于靶基因結合區域的物種間保守性也是要求較高的。
研究結果表明,胃癌細胞株BGC-823細胞中的Bcl-2蛋白表達明顯高于正常胃黏膜細胞株,而miRNA-143含量在兩組細胞中的趨勢與Bcl-2蛋白含量負相關;通過脂質體轉染法在BGC-823細胞內可以有效干預miRNA-143的表達,在BGC-823細胞中,過表達miRNA-143可以通過抑制Bcl-2蛋白的表達誘導腫瘤細胞產生凋亡增加的趨勢。這些實驗結果和數據提示,miRNA-143的低表達可能是BGC-823細胞中Bcl-2基因異常的關鍵原因,通過基因干預的方法在BGC-823細胞中過表達miRNA-143,可以通過抑制其靶基因Bcl-2基因的表達,有效誘導腫瘤細胞凋亡的過程在實驗中均得到證實。本研究的意義在于證實miRNA-143的低表達是BGC-823細胞中Bcl-2蛋白高表達的主要原因,在細胞內過表達miRNA-143可以增加腫瘤細胞凋亡,這為以新的基因為靶點的藥物開發提供了新的思路。
[1] 徐學新,張煒.晚期胃癌的治療進展[J].中國腫瘤臨床與康復,2010,37(3):171.
[2] Noureini SK,Wink M.Dose-dependent cytotoxic effects of boldine in hepG-2 cells-telomerase inhibition and apoptosis induction[J]. Molecules,2015,20(3):3730-3743.
[3] Korbakis D,Scorilas A.Quantitative expression analysis of the apoptosis-related genes BCL2,BAX and BCL2,L12in gastric adenocarcinoma cells following treatmentwith the anticancer drugs cisplatin,etoposide and taxol[J].Tumour Biol,2012,33(3):865-875.
[4] Wang T,Ge G,Ding Y,etal.MiR-503 regulates cisplatin resistance of human gastric cancer cell lines by targeting IGF1R and BCL2[J].Chin Med J(Engl),2014,127(12):2357-2362.
[5] He M,Gao L,Zhang S,et al.Prognostic significance ofmiR-34a and its target proteins of FOXP1,p53,and BCL2 in gastric MALT lymphoma and DLBCL[J].Gastric Cancer,2014,17(3): 431-441.
[6] Bartel DP.Micrornas:Genomics,biogenesis,mechanism,and function[J].Cell,2004,116:281-297.
[7] Li PF,Chen SC,Xia T,et al.Non-coding RNAs and gastric cancer[J].World Gastroenterol,2014,20(18):5411-5419.
[8] Ciela M,Dulak J,Józkowicz A.MicroRNAs and epigeneticmechanisms of rhabdomyosarcoma development[J].Int JBiochem Cell Biol,2014,(14):147-152.
[9] Yang M,Shan X,Zhou X,etal.miR-1271 regulates cisplatin resistance of human gastric cancer cell lines by targeting IGF1R, IRS1,mTOR,and BCL2[J].Anticancer Agents Med Chem, 2014,14(6):884-891.
[10]Hu J,Fang Y,Cao Y,etal.miR-449a Regulates proliferation and chemosensitivity to cisplatin by targeting cyclin D1 and BCL2 in SGC7901 cells[J].Dig Dis Sci,2014,59(2):336-345.
[11]Volinia S,Calin GA,Liu CG,et al.A microRNA expression signature of human solid tumors defines cancer gene targets[J].Proc Natl Aead Sci USA,2006,103(7):2257-2261.
[12]Katada T,Ishiguro H,Kuwabara Y,etal.microRNA expression profile in undifferentiated gastric cancer[J].Int J Oncol,2009,34 (2):537-542.
[13]Zhang X,Zhu W,Zhang J,et al.MicroRNA-650 targets ING4 to promote gastric cancer tumorigenicityⅢ[J].Biochem Biophys Res Commun,2010,395(2):275-280.
[14]Zhang Z,Li Z,Gao C,et al.MiR-21 plays a pivotal role in gastric cancer pathogenesis and progression[J].Lab Invest,2008,88 (12):1358-1366.
[15]Tie J,Pan Y,Zhao L,etal.MiR-218 inhibits invasion and metastasis of gastric cancer by targeting the Robol receptor[J].PLOSGenet,2010,6(3):e1000879.
Study on themechanism involving the apoptosis of BGC-S23 strain induced by m iRNA-143
Huo Zhonghua,Zhang Xiaoyan,Qiu Yan,Liu Feifei
(No.454 Hospital of CPLA,Nanjing 210002,China)
Objective To investigate the mechanism involving the apoptosis of BGC-823 strain induced by miRNA-143. M ethods Fluorometry and Western blotwere used to detect Bcl-2 mRNA and the protein contents in the gastric cancer strain(BGC-823)and normal gastric mucosa strain(GES-1).We verified the binding site by a Lnciferase reportermethod.MiRNA-143-mimics,inhibitor and NCwere chemically synthesized.Bcl-2 protein levelsweremeasured byWestern blotting 48 hours after transiently transfected with eithermiRNA-143mimics,inhibitors,or negative controlmiRNAs into BGC-823 cells.Apoptosis assayswere employed to evaluate cell apoptosis in BGC-823 strain,and miRNA-143 expression levels in BGC-823 weremeasured by quantitative PCR(qPCR)simultaneously at different time points after transfection.Results The study successfully predicted and verified the putative miRNA-143 binding site in the 3'UTR of human Bcl-2 gene.Bcl-2 level in BGC-823 cellswas significantly increased andmiRNA-143 levelwas decreased,as compared with that of GES-1 cells,and significant differences could be noted,when comparisons were made between the groups(P<0.01).Research results indicated thatmiRNA-143-mimics/miRNA-143-inhibitor and the wild type luciferase reporter geneco-transfection significantly reduced and induced the activity of luciferase.Forty-eight hours after transfection,statistical significance could be noticed,when the co-transfection group was compared with the single transfection group(P<0.05).The transfection ofmiRNA-143-mimics and miRNA-143-inhibitors had no significanteffects on the activity ofmutant luciferase reporter gene.Statistical significance could be seen,when the co-transfection group was compared with the single transfection group(P<0.05).Furthermore,the transfection ofmiRNA-143-mimics and miRNA-143-inhibitor could significantly inhibit or enhance the expression of Bcl-2 protein,and statistical significance could be found,when itwas compared with the control group(P<0.05).miRNA-143-mimics and miRNA-143-inhibitor transfected cells could induce changes inmiRNA-143 level.Forty-eighthours after transfection,miRNA-143 level in themiRNA-143-mimics transfected cellswas obviously elevated,while that in themiRNA-143-inhibitor was significantly reduced,and statistical significance could also be noted,when itwas compared with the control group(P<0.05).There were no significant differences in miRNA-143 levels,when the negative control group was compared with the transfected control group(P<0.05).Results of apoptosis detection indicated that the elevated expression levelofmiRNA-143 could significantly induce apoptosis of BGC-823,and statistical significance could be seen,when the gene intervention group was compared with the transfected control group(P<0.05).Conclusion Through the inhibition of Bcl-2 gene expression,miRNA-143 could induce the apoptosis of the gastric cancer BGC-823 strain.
Bcl-2;BGC-823;miRNA-143;Apoptosis
R34
A
10.3969/j.issn.1009-0754.2015.06.012
2015-07-07)
(本文編輯:張陣陣)
210002 南京,解放軍第四五四醫院(霍中華、邱彥);南京軍區聯勤部衛生部苜蓿園路干休所(張曉燕);濟南軍區空軍司令部門診部(劉菲菲)

