伊立替康聯合順鉑或5-FU治療UGT1A1*28野生型TA6/6患者不良反應的比較
秦瓊 黃鏡 楊林 周愛萍 陶云霞 王金萬#
1天津醫科大學總醫院腫瘤科,天津300052
2中國醫院科學院腫瘤醫院腫瘤內科,北京100021
3江蘇省徐州市中心醫院腫瘤科,徐州221009
伊立替康聯合順鉑或5-FU治療UGT1A1*28野生型TA6/6患者不良反應的比較
秦瓊1黃鏡2楊林2周愛萍2陶云霞3王金萬2#
1天津醫科大學總醫院腫瘤科,天津300052
2中國醫院科學院腫瘤醫院腫瘤內科,北京100021
3江蘇省徐州市中心醫院腫瘤科,徐州221009
目的比較尿苷二磷酸葡萄糖醛酸轉移酶1A1(UGT1A1)*28啟動子為野生型的TA6/6患者在使用伊立替康(irinotecan,CPT-11)聯合順鉑與CPT-11聯合5-FU/亞葉酸鈣治療時不良反應方面的差異。方法根據采取的治療方案將98例UGT1A1*28野生型TA6/6患者分為CPT-11聯合順鉑組(IP組,n=47)和CPT-11聯合5-FU/亞葉酸鈣組(FOLFIRI組,n=51),對患者進行UGT1A1*28啟動子多態性檢測,比較不良反應差異。結果在總體3~4級不良反應方面,IP組的發生率(61.7%)明顯高于FOLFIRI組(39.2%),且組間差異具有統計學意義(P=0.026)。在血液學不良反應方面,IP組3~4級白細胞減少、中性粒細胞減少、血小板減少和血紅蛋白減少發生率分別為34.0%、51.1%、14.9%和8.5%,FOLFIRI組的發生率分別為11.8%、29.4%、2.0%、0,組間差異均有統計學意義(均P<0.05);在非血液學方面,FOLFIRI組3~4級遲發性腹瀉發生率為9.8%,IP組未發生3~4級腹瀉,兩組間發生率的差異有統計學意義(P=0.028)。結論UGT1A1*28野生型TA6/6患者在接受CPT-11聯合順鉑和CPT-11聯合5-FU/亞葉酸鈣兩種化療方案治療的不良反應譜存在差異;應用CPT-11時,不但要考慮到UGT1A1*28啟動子多態性對不良反應的影響,而且還要考慮CPT-11聯合不同藥物出現不良反應情況。
伊立替康;順鉑;5-FU;不良反應;UGT1A1*28野生型
Oncol Prog,2015,13(4)
伊立替康為半合成水溶性喜樹堿衍生物,是DNA拓撲異構酶Ⅰ抑制劑,對結直腸癌、胃癌、肺癌、胰腺癌、卵巢癌等多種實體瘤有效[1]。CPT-11的主要不良反應是3~4級中性粒細胞減少和遲發性腹瀉[2],尤其是嚴重遲發性腹瀉的發生限制了其在臨床上的廣泛應用,因此預測其不良反應的發生尤為重要。國外Meta分析的結果顯示在CPT-11高劑量組(>125mg/m2)中,3~4級遲發性腹瀉、中性粒細胞減少的發生與UGT1A1*28位點啟動子的多態性具有相關性:與UGT1A1*28野生型TA6/6患者相比,UGT1A1*28雜合突變型TA6/7患者、UGT1A1*28純合突變型TA7/7患者發生3~4級腹瀉的風險明顯升高(OR=1.92,95%CI:1.31~2.82,P=0.001;OR=3.69,95%CI:2.00~6.83,P<0.001)[3];與UGT1A1*28野生型TA6/6患者和 UGT1A*28雜合型 TA7/6患者相比,UGT1A1*28純合突變型TA7/7患者發生3~4級中性粒細胞減少的風險明顯升高(OR=27.8,95% CI:4.0~195,P=0.005;OR=3.22,95%CI:1.52~6.81,P=0.008)[4]。國內學者也認為UGT1A1*28基因多態性與CPT-11所致3級及以上遲發性腹瀉和中性粒細胞減少相關[5-6]。即使在UGT1A1*28野生型TA6/6患者中,CPT-11聯合不同化療藥物所致的不良反應也存在差異。而UGT1A1*28野生型TA6/6患者在中國人群中所占比例最高,為72.9%~77.2%[5,7-9],因此,針對這類患者,分析CPT-11聯合不同化療藥物不良反應的差異對指導臨床工作意義重大。
1 資料和方法
1.1 臨床資料
收集2011年3月至2013年5月中國醫學科學院腫瘤醫院內科收治的符合入組條件的患者的臨床資料。入組條件:經病理學證實的晚期胃癌和結直腸癌患者;患者年齡≥18歲;美國東部腫瘤協作組(Eastern Cooperative Oncology Group,ECOG)評分為0~2分;預計生存時間≥3個月;中性粒細胞≥1.5×109/L,血小板≥80×109/L;經UGT1A1*28基因檢測為UGT1A1*28野生型TA6/6的患者;初次使用含CPT-11聯合順鉑或者CPT-11聯合5-FU/亞葉酸鈣化療方案;心肺功能基本正常。
1.2 治療方案
根據所采取的治療方案將患者分為CPT-11聯合順鉑組(IP組)和CPT-11聯合5-FU/亞葉酸鈣組(FOLFIRI組)。具體用藥方案如下:
CPT-11聯合順鉑組(IP組):CPT-11 100~125 mg/m2靜脈滴注90分鐘,d1;DDP 50~60mg/m2靜脈滴注≥2小時,d2;每14天重復。
CPT-11聯合5-FU/亞葉酸鈣組(FOLFIRI組):CPT-11 180 mg/m2靜脈滴注90分鐘,d1;CF 200 mg/m2靜脈滴注2小時,5-FU 400mg/m2靜脈滴注,d1、d2,5-FU 600mg/m2持續滴注22小時,d1、d2。或改良FOLFIRI:CPT-11 180 mg/m2靜脈滴注90分鐘,d1;CF 200mg/m2靜脈滴注2小時,5-FU 400 mg/m2靜脈滴注,d1,5-FU 2400mg/m2持續滴注44小時;每14天重復。
1.3 毒性反應評價標準
依據美國國立癌癥研究所(National Cancer Institute,NCI)的常見不良反應評價標準(common term inology criteria for adverse events,CTCAE)3.0版對毒性反應進行評價分級。所有患者于下一個治療周期的前1天進行毒性反應評價,將治療期間出現的最嚴重不良反應作為最終的不良反應。
1.4UGT1A1基因啟動子基因型的檢測
化療前采集患者血液,采用Qiagen試劑盒(上海源奇生物醫藥科技有限公司)提取基因組DNA,并嚴格按照說明書操作,使DNA純級合格;設計引物序列,正向引物序列為5′-AAATTCCAGCCAGTTCAACTGTT-3′,反向引物序列為5′-CTGCTGGATGGCCCCAAG-3′;對抽取物進行PCR擴增,擴增程序為:42℃,5 m in;94℃,5 m in;(94℃,15 s;55℃,25 s;72℃,50 s)40個循環;72℃,5min。將PCR產物和標準分子量內標混合,進行毛細管電泳。電泳時,帶有熒光染料標記的DNA片段按片段大小依次通過測序儀的檢測窗口,由激光誘發熒光而檢測。用GeneMapper軟件分析檢測結果。
1.5 統計學分析
采用SPSS 16.0軟件進行統計學分析。采用χ2檢驗或Fisher精確檢驗,比較IP組和FOLFIRI組在遲發性腹瀉、中性粒細胞減少、血小板減少及其他化療不良反應方面的差異。檢驗水準α=0.05。
2 結果
2.1 兩組患者的基本資料
IP組有47例患者,全部為晚期胃癌患者,中位年齡為56歲(33~69歲),隨訪周期為2~8個周期,中位隨訪時間為4周期;FOLFIRI組有51例患者,其中有16例為晚期胃癌患者,35例為晚期結直腸癌患者,中位年齡為59歲(36~76歲),隨訪周期為3~12周期,中位隨訪時間為5周期。兩組患者在年齡、性別、ECOG評分等方面的差異均無統計學意義(P>0.05),具體見表1。在腫瘤原發部位方面IP組患者全部為胃癌,而FOLFIRI組患者以結直腸癌為主,胃癌所占的比例在兩組間的差異有統計學意義(P<0.001)。
2.2 兩組患者不良反應發生情況的比較
總體上,IP組的3~4級不良反應發生率明顯高于FOLFIRI組,兩組差異具有統計學意義(61.7%vs 39.2%;HR=1.57,95%CI:1.045~2.369;P=0.026)。在血液學不良反應方面,IP組的3~4級不良反應(包括白細胞減少、中性粒細胞減少、血小板減少和血紅蛋白減少)的發生率也明顯高于FOLFIRI組,組間差異均具有統計學意義(P<0.05);并且IP組的3~4級血液學不良反應的發生時間明顯早于FOLFIRI組(中位周期分別為第1周期和第3周期)。在非血液學不良反應方面,FOLFIRI組的3~4級遲發性腹瀉發生率要明顯高于IP組,兩組間的差異具有統計學意義(P=0.028)。另外,在總體不良反應方面,兩組間嘔吐、黏膜炎、白細胞減少、血小板減少、血紅蛋白減少的發生率差異具有統計學意義(均P<0.05)。(表2)
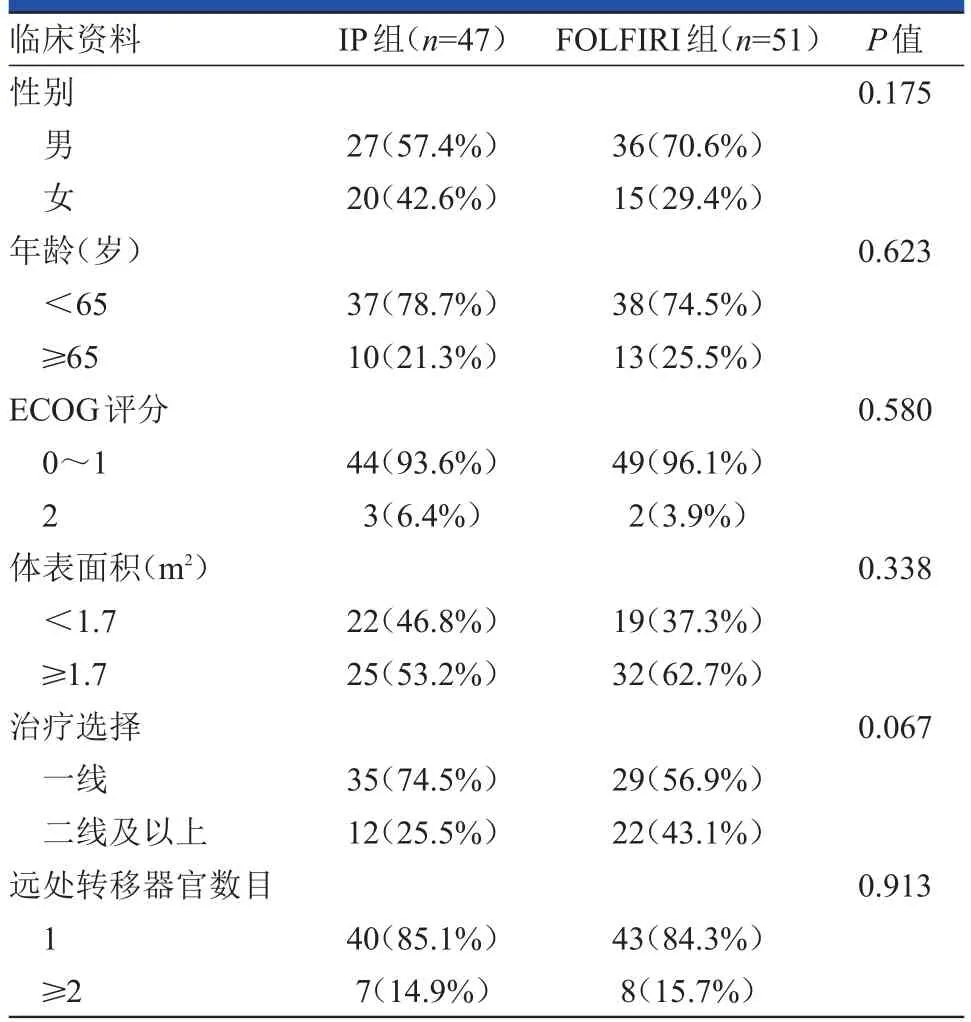
表1 兩組患者的基本資料比較
2.3 接受一線和二線治療的患者的不良反應發生情況比較
在IP組中,接受一線治療和接受二線治療的患者,其3~4級血液學不良反應發生率差異無統計學意義(均P<0.05)。同樣,在FOLFIRI組中,接受一線治療和接受二線治療的患者,其3~4級遲發性腹瀉和血液學不良反應的發生率差異無統計學意義(均P<0.05)。(表3)
3 討論
UGT1A是影響CPT-11代謝滅活途徑的關鍵酶,其中UGT1A1*28基因啟動子多態性與CPT-11所致不良反應的關系最為密切。既往國內外研究主要探討UGT1A1*28基因啟動子多態性與遲發性腹瀉、血液學不良反應的關系,認為UGT1A1* 28啟動子野生型TA6/6患者對CPT-11的耐受性較好,不良反應發生率較低[4-5]。而對于UGT1A1*28啟動子野生型TA6/6患者接受CPT-11聯合順鉑和聯合5-FU治療的不良反應發生率是否存在差異,國內外相關研究尚少。
本研究除腫瘤原發部位不同外,兩組間患者的其他基本資料無統計學差異,具有可比性。在不良反應方面,無論是IP組還是FOLFIRI組總體不良反應譜和既往報道一致,但發生率均低于既往類似劑量級治療時的發生情況[10-12]。同時,本研究中FOLFIRI組不良反應要略低于既往報道[13-14]。出現以上情況的原因可能是在本研究中將UGT1A1*28雜合突變型TA7/6和UGT1A1*28純合突變型TA7/7患者被剔除,而這兩種基因型患者被認為是會明顯增加3~4級毒副反應的發生。
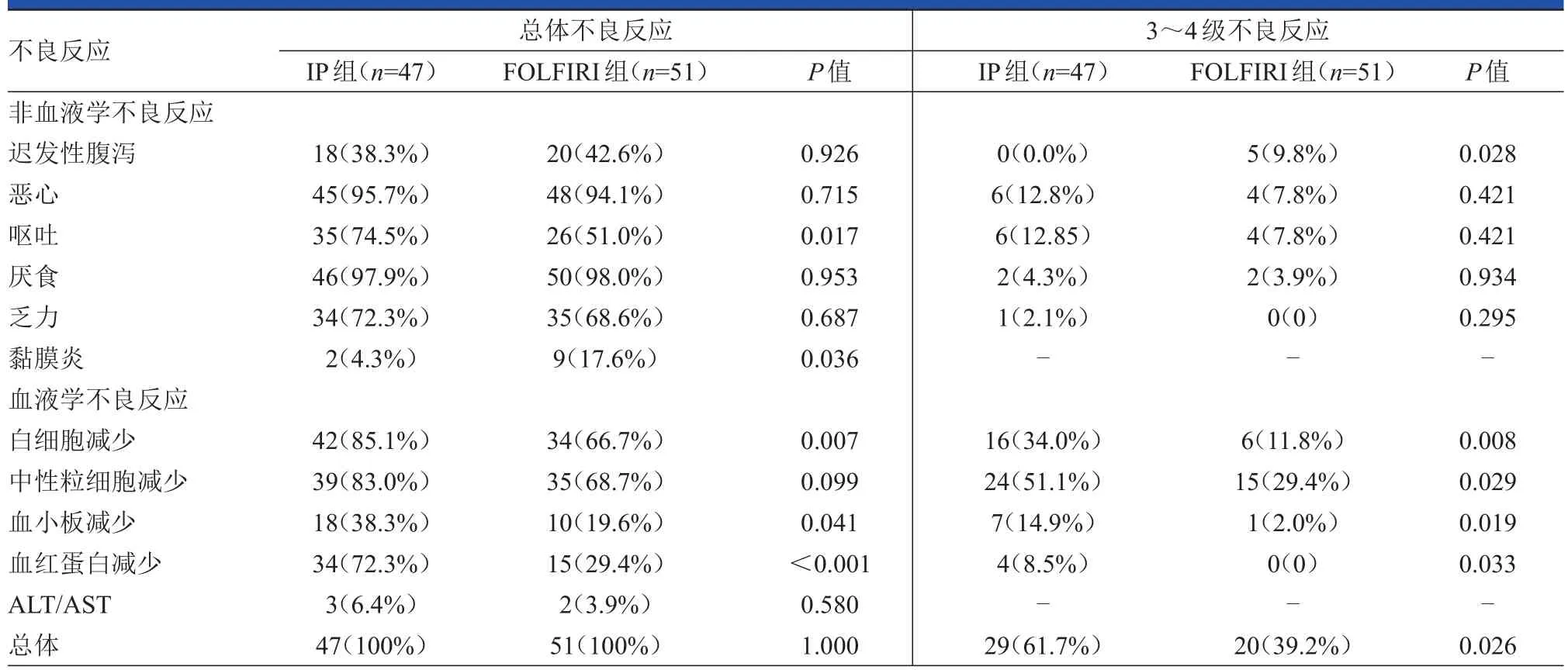
表2 兩組的不良反應發生情況的比較
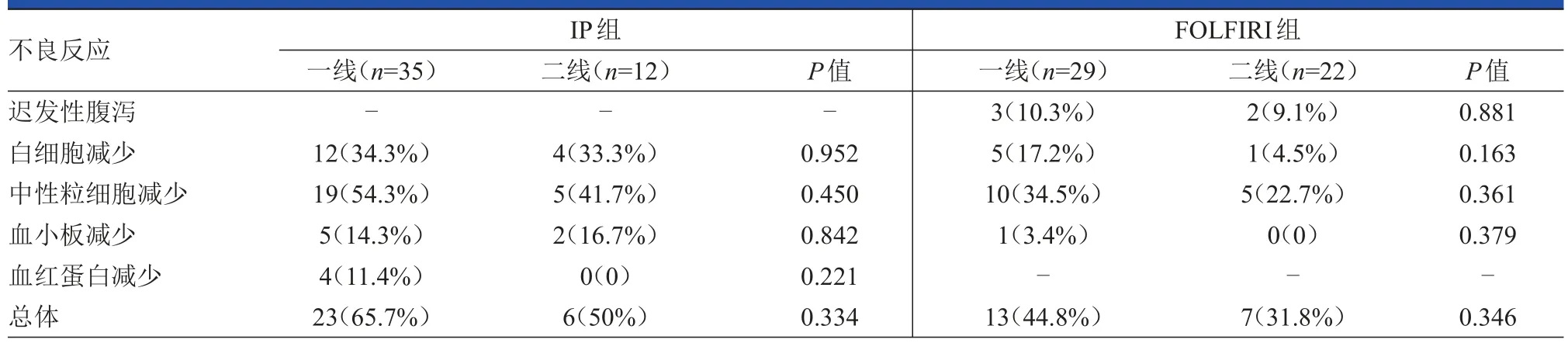
表3 接受一線治療和接受二線治療的患者的3~4級不良反應發生情況比較
然而,兩組患者毒副反應譜方面存在明顯差異。首先,在3~4級遲發性腹瀉及中性粒細胞減少的發生率方面兩組差異明顯。最有可能的原因是CPT-11聯合藥物的不同導致。CPT-11在體內需要轉換成7-乙基-10-羥喜樹堿(SN38)才能發揮抗腫瘤的活性,而SN38也是導致CPT-11相關不良反應的主要原因。Sasaki等報道持續滴注5-Fu可能減緩CPT-11轉換成SN38[15];在CPT-11轉換為SN38速度方面,在CPT-11聯合順鉑組要明顯高于CPT-11聯合持續5-Fu泵入組,前者約為后者3倍,而在SN38轉換成SN38G速度方面兩組間并沒有明顯差異[16-17],因此,高濃度SN38可增加3~4級遲發性腹瀉、粒細胞減少和口腔黏膜炎的發生。其次,兩組患者在貧血的發生率方面也存在差異,一方面是可能和高濃度SN38對骨髓造血抑制作用更強相關;另一方面可能是和兩組患者腫瘤原發部位不同相關,IP組所有患者為晚期胃癌,貧血的發生率高可能與胃癌的發生破壞胃壁細胞或者行全胃切除術后引起血紅蛋白生成障礙相關,而FOLFIRI組患者主要為結直腸癌患者,因此,貧血的發生相對較少。此外,UGT1A1基因其他位點突變也可能會影響毒副反應,其中在亞洲人群中比較常見的是UGT1A1*6基因多態性。韓國學者報道,UGT1A1*6/*6基因型可能和CPT-11導致的嚴重不良反應相關[17];但是國內學者對于UGT1A1*6基因多態性研究的結論不一致:王等認為UGT1A1*6位點多態性和3~4級遲發性腹瀉和粒細胞減少無關[5],但呂等認為UGT1A1*6位點多態性和3~4級遲發性腹瀉和粒細胞減少相關[18],因此,對于UGT1A1*6位點多態性和CPT-11嚴重毒副反應相關性有待進一步證實。
同時,本研究還發現在CPT-11用藥劑量方面IP組要明顯低于FOLFIRI組(≤125 mg/m2vs 180 mg/m2),但即便如此IP組患者出現3~4級中性粒細胞減少的發生率仍明顯高于常規劑量的FOLFIRI組,因此,在使用該方案時,更要密切關注患者的血象變化,以便及時給予患者必要的集落粒細胞刺激因子治療,以免引起更嚴重的后果。綜上可知,在UGT1A1*28野生型TA6/6患者中,CPT-11聯合不同藥物組合治療所產生的嚴重不良反應有非常明顯的差異。因此,在臨床應用CPT-11時,不僅要考慮到UGT1A1*28啟動子多態性對不良反應的影響,更要考慮到CPT-11聯合不同藥物出現不良反應情況,尤其是聯合順鉑時,骨髓抑制明顯而且出現早,須密切觀察并及時處理。
[1]王麗焱,湯致強.抗腫瘤藥伊立替康的研究進展[J].國外醫學藥學分冊,2004,31(1):7-11.
[2]Toffoli G,Cecchin E,Gasparini G,et al.Genotype-driven phase I study of irinotecan adm inistered in combination w ith fluorouracil/leucovorin in patients w ith metastatic colorectal cancer[J].J Clin Oncol,2010,28(5): 866-871.
[3]Hoskins JM,Goldberg RM,Qu P,et al.UGT1A1*28 genotype and irinotecan-induced neutropenia:dose matters[J].JNatl Cancer Inst,2007,99(17):1290-1295.
[4]Hu ZY,Yu Q,Zhao YS.Dose-dependent association between UGT1A1*28 polymorphism and irinotecan-induced diarrhoea:ameta-analysis[J].Eur JCancer,2010, 46(10):1856-1865.
[5]王巖,徐建明,沈琳,等.中國人尿苷二磷酸葡糖苷酸轉移酶1A基因多態性與伊立替康毒性的相關性[J].中華腫瘤雜志,2007,29(12):913-916.
[6]秦瓊,楊林,周愛萍,等.尿苷二磷酸葡萄糖醛酸轉移酶1A1*28基因多態性和伊立替康毒副反應相關性研究[J].癌癥進展,2013,11(4):369-373;387.
[7]季楚舒,何義富,胡冰,等.UGT1A1*28基因多態性與晚期結直腸癌伊立替康化療療效及不良反應的關系[J].腫瘤,2010,30(10):870-874.
[8]楊立學,馬韜,張俊,等.伊立替康化學治療的不良反應與UGT1A1*28基因多態性的關系[J].內科理論與實踐,2009,4(4):300-304.
[9]Zhang A,Xing Q,Qin S,et al.Intra-ethnic differences in genetic variants of the UGT-glucuronosyltransferase 1A1 gene in Chinese populations[J].Pharmacogenomics J,2007,7(5):333-338.
[10]Pozzo C,Barone C,Szanto J,etal.Irinotecan in combination w ith 5-fluorouracil and folinic acid orw ith cisplatin in patients w ith advanced gastric or esophageal-gastric junction adenocarcinoma:results of a random ized phase IIstudy[J].Ann Oncol,2004,15(12):1773-1781.
[11]Boku N,Yamamoto S,Fukuda H,et al.Fluorouracil versus combination of irinotecan plus cisplatin versus S-1 in metastatic gastric cancer:a randomised phase 3 study[J].Lancet Oncol,2009,10(11):1063-1069.
[12]Park SH,Nam E,Park J,et al.Randomized phase II study of irinotecan,leucovorin and 5-fluorouracil(ILF) versus cisplatin plus ILF(PILF)combination chemotherapy for advanced gastric cancer[J].Ann Oncol, 2008,19(4):729-733.
[13]Colucci G,Gebbia V,Paoletti G,et al.Phase III random ized trial of FOLFIRI versus FOLFOX4 in the treatment of advanced colorectal cancer:a multicenter study of the Gruppo Oncologico Dell′Italia Meridionale [J].JClin Oncol,2005,23(22):4866-4875.
[14]劉華敏,梁軍,趙建東,等.伊立替康聯合氟尿嘧啶/醛氫葉酸治療晚期大腸癌[J].臨床腫瘤學雜志,2006,11(5):377-379.
[15]Sasaki Y,Ohtsu A,Shimada Y,et al.Simultaneous administration of CPT-11 and fluorouracil:alteration of the pharmacokinetics of CPT-11 and SN-38 in patients w ith advanced colorectal cancer[J].J Natl Cancer Inst, 1994,86(14):1096-1098.
[16]Falcone A,Di Paolo A,Masi G,et al.Sequence effect of irinotecan and fluorouracil treatment on pharmacokinetics and toxicity in chemotherapy-naive metastatic colorectal cancer patients[J].J Clin Oncol,2001,19 (15):3456-3462.
[17]Han JY,Lim HS,Shin ES,et al.Comprehensive analysis of UGT1A polymorphisms predictive for pharmacokinetics and treatment outcome in patients w ith nonsmall-cell lung cancer treated w ith irinotecan and cisplatin[J].JClin Oncol,2006,24(15):2237-2244.
[18]呂雅蕾,劉巍,杜玉娟,等.UGT1A1基因多態性與伊立替康安全性和有效性的臨床研究[J].中國腫瘤臨床,2012,39(20):1542-1546.
Comparison of irinotecan plus cisplatin versus irinotecan plus infusional fluorouracil/ leucovorin inmanagementof adverseevents in patientsw ith UGT1A1*28w ild genotype
QIN Qiong1HUANG Jing2YANG Lin2ZHOU Ai-ping2TAO Yun-xia3WANG Jin-wan2#1DepartmentofOncology,Tianjin MedicalUniversity GeneralHospital,Tianjin 300052,China
2DepartmentofMedicalOncology,Chinese Academy ofMedicalSciences,CancerHospital,Beijing 100021,China3Departmentof Oncology,Xuzhou CentralHospital,Xuzhou 221009,China
ObjectiveTo investigate the difference regarding adverse events management between irinotecan (CPT-11)plus cisplatin or plus fluorouracil/leucovorin in patients w ith UGT1A1*28 w ild genotype(TA6/6).MethodGenomic DNA was extracted from peripheral blood to identify the UGT1A1*28 w ild genotype(TA6/6)in patients treated w ith both irinotecan-contained chemotherapy.Irinotecan plus cisplatin(IP group,n=47)and irinotecan plus flu-orouracil/leucovorin(FOLFIRI group,n=51)were compared in patients w ith UGT1A1*28 w ild genotype TA6/6.c2 testwas used to investigate the difference of toxicity between IP group and FOLFIRIgroup.ResultThe overall incidence of grade 3 or 4 toxicity was higher in IP group than in FOLFIRI group(61.7%vs 39.2%;HR=1.57,95%CI: 1.045-2.369;P=0.026).Serious hematological toxicity was also higher in IP group compared w ith the FOLFIRIgroup in respect of grade 3/4 neutropenia(51.1%vs 29.4%,P=0.029),grade 3/4 anem ia(8.5%vs 0,P=0.033)and grade 3/ 4 thrombocytopenia(14.9%vs 2.0%,P=0.019).However,grade 3/4 delayed diarrhea wasmore common in FOLFIRI group than in IP group(9.8%vs 0,P=0.028).ConclusionThe adverse events profile was different in IP-and FOLFIRI-treated patients w ith UGT1A1*28 w ild genotype(TA6/6).As in CPT-11 adm inistration,not only the polymorphism of UGT1A1*28 promotor,but also the adverse events profile of CPT-11 in combination w ith differentmedication should be considered.
irinotecan;cisplatin;fluorouracil;adverse events;UGT1A1*28 w ild genotype
R735.2
A
10.11877/j.issn.1672-1535.2015.13.04.13
#通信作者(corresponding author),e-mail:jwwang@csco.org.cn
2014-11-23)

