萘甲酰胺衍生物TW918的合成及體外活性考察
王立強,雷春花,邱飛,楊會勇
(華僑大學 生物醫學學院,福建 泉州362021)
隨著分子醫學和分子生物學的發展,抗癌藥物的研究已從傳統的、非特異的細胞毒藥物向作用于多信號傳導分子、多環節的選擇性靶向抗癌藥物發展[1-2].在各種分子靶點中,蛋白酪氨酸激酶是目前國際上抗腫瘤藥物研發的熱點[3].本課題組針對現有酪氨酸激酶抑制劑的空間結構特點[4-5],整合計算機輔助藥物設計手段,以及生物電子等排、骨架遷越原理設計合成了一系列結構新穎的活性喹啉類萘甲酰胺衍生物,以期發現具有更高抗癌活性、更低毒性和更高生物利用度的小分子靶向藥物.經前期體外活性驗證及結構優化,從中篩選出候選化合物TW918(a),化學名稱為N-(2-苯胺基)-6-(7-氯喹啉-4-醚氧基)-2-萘酰胺,分子式為C26H18ClN3O2,相對分子質量為439.本文主要對TW918的合成方法、體外抗腫瘤活性、與EGFR 蛋白的結合性及抑制作用進行研究.
1 實驗部分
1.1 試劑和儀器
4,7-二氯喹啉、6-羥基-2-萘甲酸和鄰苯二胺(百靈威科技有限公司);其他合成試劑(國藥集團化學試劑公司);人小細胞肺癌NCI-H446、人非小細胞肺癌A549、人食管癌Eca-109、人肝癌HepG2、正常人臍靜脈內皮細胞HUVEC和正常人胚肺成纖維細胞MRC-5(上海中科院細胞庫);正常人肝細胞LO2和正常人食管上皮細胞HEEC(ATCC);RPMI-1640、MEM、F-12K 培養基、胎牛血清、胰蛋白酶(美國Gibco公司);二甲基亞砜(DMSO)、四氮唑鹽(MTT)(美國Sigma公司);兔抗人EGFR 抗體、兔抗人Actin抗體、辣根過氧化物酶標記的羊抗兔二抗(美國Abcam 公司);超敏ECL化學發光試劑盒(碧云天物技術研究所);吉非替尼對照品(大連美侖生物技術有限公司);THF(四氫呋喃)和DCM(二氯甲烷)經分子篩干燥后直接使用;其他溶劑未特別指出則未經處理.
TLC硅膠板和柱層析硅膠(青島海洋化工廠);96孔細胞培養板(美國Coring公司);Q Exactive型高分辨質譜儀(美國Thermo公司);AV400型核磁共振(德國Bruker公司);WRR 熔點儀(上海精密科學儀器有限公司);CO2培養箱(美國Thermo公司);Infinite M200型全功能酶儀(瑞士Tecan公司);HJ-4型四聯磁力攪拌機(江蘇金壇市天竟實驗儀器廠);BS224S 型電子天平(德國Sartorius公司);Forma-86℃超低溫冰箱(美國Thermo公司);ChemiDoc XRS型凝膠成像系統、Mini-PROTEAN Tetra C型垂直板電泳和轉膜裝置(Bio-Rad公司).
1.2 TW918的合成方法
目標化合物TW918的合成路線,如圖1所示.
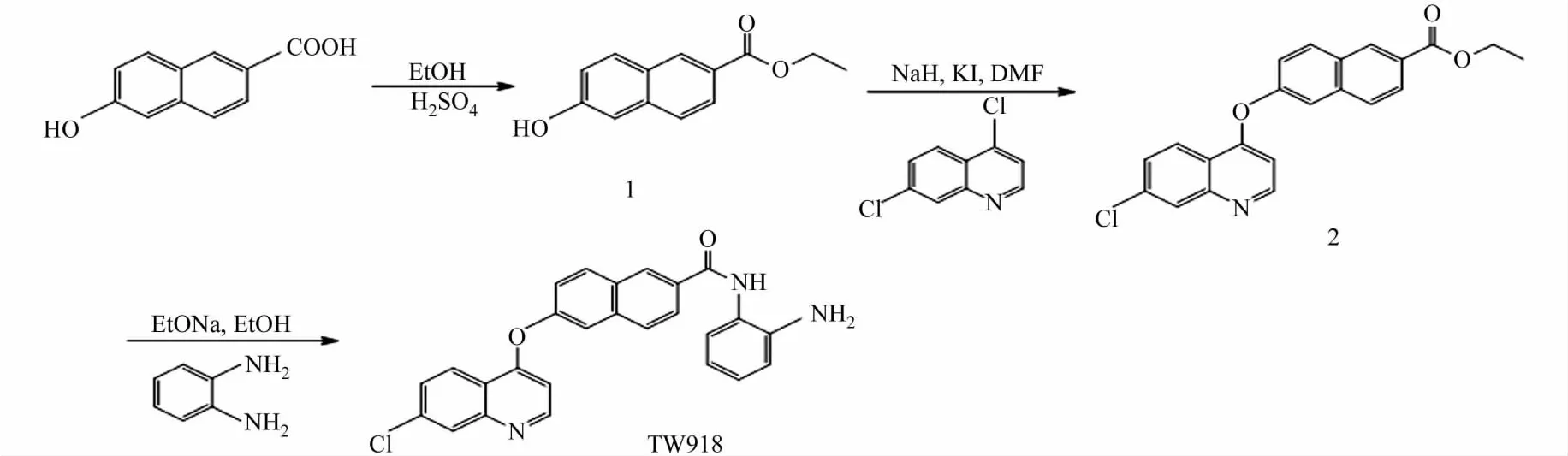
圖1 TW918的合成路線Fig.1 Synthesis route of TW918
1.2.1 6-羥基-2-萘甲酸乙酯(1)的合成 稱取1.88g(10mmol)6-羥基-2-萘甲酸溶于50mL 無水乙醇,攪拌下加入4滴濃硫酸,78~85 ℃加熱回流4~5h.TLC 監測反應結束后,將反應液冷卻,減壓除去溶劑,殘留物用10mL乙酸乙酯溶解.飽和碳酸氫鈉萃取3次,每次10mL,收集有機相加入無水硫酸鈉靜置干燥,30min后減壓除去溶劑,得到棕色固體(1)1.99g,產率為92%.1H-NMR(400 MHz,DMSO),δ值:8.56(d,J=8.62 Hz,1H),8.02(dd,J=8.61 Hz,1.88 Hz,1H),7.86(d,J=8.46 Hz,1H),7.69(d,J=8.50Hz,1H),7.22(s,1H),7.19(dd,J=8.72Hz,2.42Hz,1H),6.11(s,1H),4.48(q,J=7.01 Hz,2H),1.47(t,J=7.05 Hz,3H).13C-NMR(400 MHz,DMSO),δ值:17.56,60.05,125.02,127.04,127.13,129.16,130.42,130.64,131.62,132.04,138.39,142.37,163.72.
1.2.2 6-(7-氯喹啉-4-醚氧基)-2-萘甲酸乙酯(2)的合成 稱取2.16g(10mmol)6-羥基-2-萘甲酸乙酯溶于50mL N,N-二甲基甲酰胺(DMF).冰浴攪拌下,緩慢滴加含有0.48g(20mmol)氫化鈉(NaH)的DMF溶液5mL,冰浴攪拌30min,撤去冰浴.待溫度恢復至室溫,緩慢滴入含有1.97g(10mmol)4,7-二氯喹啉以及0.33g(2mmol)碘化鉀(KI)的DMF溶液10mL,室溫攪拌30min,110 ℃下反應6~10 h.TLC監測反應結束后,減壓除去溶劑,加入15mL甲醇超聲溶解,重復洗滌3次,真空干燥,得白色固體(2)3.20g,產率為85%.1H-NMR(400MHz,DMSO),δ值:8.76(d,J=9.02Hz,1H),8.73(dd,J=8.74Hz,2.13Hz,1H),8.36(d,J=8.54Hz,1H),8.14(d,J=8.62Hz,1H),8.04(s,1H),7.92(dd,J=8.80Hz,2.56Hz,1H),7.73(d,J=7.04 Hz,1H),7.62(dd,J=7.24 Hz,1.86 Hz,1H),6.82(s,1H),8.06(d,J=7.80Hz,1H),6.84(d,J=8.54Hz,1H),4.40(q,J=7.14Hz,2H),1.39(t,J=7.21 Hz,3H).13C-NMR(400 MHz,DMSO),δ值:18.72,60.63,109.24,116.07,119.68,122.50,124.21,126.47,126.65,127.73,128.74,128.90,130.24,131.18,132.41,135.61,139.76,140.83,151.02,156.20,161.08,164.46.
1.2.3 N-(2-苯胺基)-6-(7-氯喹啉-4-醚氧基)-2-萘甲酰胺(TW918)的合成 稱取6-(7-氯代喹啉-4-醚氧基)-2-萘甲酸乙酯3.78g(10mmol)溶于10mL乙醇.冰浴攪拌下,緩慢滴加含有1.56g(20mmol)乙醇鈉(NaOEt)的乙醇溶液5mL,冰浴攪拌30min,撤去冰浴.待溫度恢復至室溫,緩慢滴入含有1.08 g(10mmol)鄰苯二胺的乙醇溶液10mL,攪拌30min,78~85 ℃下反應6~10h.TLC 監測反應完全后,將反應液用飽和碳酸氫鈉和食鹽水分別萃取3次,每次15mL.收集有機相無水硫酸鈉干燥30min,減壓除去溶劑,再將固體與適量硅膠攪拌均勻,以體積比為3∶1的石油醚∶乙酸乙酯為洗脫劑進行硅膠柱層析分離得到白色固體(TW918)3.70g,產率為83%,熔點為165.7~166.4 ℃.1H-NMR(400 MHz,DMSO),δ值:9.88(s,1H),8.76(d,J=5.27 Hz,1H),8.46(d,J=9.29 Hz,1H),8.42(d,J=9.03Hz,1H),8.14(d,J=2.01Hz,1H),8.10(d,J=8.28Hz,1H),7.97(d,J=2.50 Hz,1H),7.91(d,J=6.78Hz,1H),7.73(dd,J=9.03Hz,2.26Hz,1H),7.68(t,J=15.31Hz,8.03Hz,1H),7.62(dd,J=2.51Hz,9.29Hz,1H),7.37(brt,J=8.03Hz,6.78Hz,1H),7.01(t,J=13.80Hz,6.53Hz,1H),6.83(d,J=9.03Hz,1H),6.77(d,J=5.27Hz,1H),6.65(t,J=14.81 Hz,7.78 Hz,1H),5.00(s,2H).13C-NMR(400 MHz,DMSO),δ值:110.88,113.01,116.20,116.40,121.11,121.43,121.82,121.96,124.09,124.65,125.25,125.64,125.97,127.30,128.50,128.78,133.27,134.23,134.62,136.63,141.52,142.99,151.27,156.41,157.04,163.29.HR-MS(+),m/z為440.884 6([M+H]+,C26H18ClN3O2H+calcd:440.884 9).
1.3 細胞培養
NCI-H446,Eca-109,LO2 和HEEC 細 胞 單 層 接 種 于 含10%胎 牛 血 清 的RPMI-1640 培 養 基;HepG2和MRC-5細胞單層接種于含10%胎牛血清的MEM 培養基;A549和HUVEC 細胞單層接種于含10%胎牛血清的F-12K 培養基中,分別置于37 ℃,5%二氧化碳培養箱中培養.
1.4 MTT法測定TW918對腫瘤細胞的抑制活性
取對數生長期的NCI-H446,A549,Eca-109,HepG2,HUVEC,LO2,MRC-5和HEEC 細胞用體積濃度為0.25%的胰酶消化,制成1×104mL-1懸液接種于96孔培養板中,每孔100μL.細胞完全貼壁后,分別給予不同濃度的TW918,每組3 個復孔,陽性對照組為吉非替尼(Gefinitib),陰性對照組為DMSO.分別孵育72h后,每孔加入5mg·mL-1的MTT 20μL,繼續培養4h,吸棄培養液,加入150 μL DMSO,振蕩10min使結晶物充分溶解,用酶標儀在570nm 處測定各孔的吸光值值,采用SPSS 17.0軟件計算半數抑制濃度(IC50).重復測試3次,取平均值為最終結果.
1.5 分子對接軟件考察TW918與受體激酶EGFR的親和力
運用AutoDock 4.2.5軟件將TW918與受體激酶EGFR 進行分子對接,計算TW918 與EGFR(PDB ID∶4HJO)靶蛋白的自由結合能,模擬在自由結合能最低的情況下化合物與EGFR 蛋白結合的空間構象,探討其與受體間的親合力,確定活性腔內與配體結合的關鍵殘基[8].
1.6 Western Blot檢測受體激酶EGFR 蛋白的表達
將NCI-H446,A549,Eca-109和HepG-2細胞以5×105個·孔-1的密度接種于96孔板中.細胞完全貼壁后,分別給予不同濃度的化合物(2,4,8μmol·L-1的TW918,DMSO 含量為0.1%),陰性對照組給予同體積的DMSO.給藥48h后吸棄培養基,用預冷的1×PBS洗滌細胞2次,每孔加入150μL Western及IP細胞裂解液,冰浴裂解30 min,1 000r·min-1離心5 min,收集上清液,以12%SDSPAGE凝膠電泳分離蛋白質.電泳后,將蛋白轉印至PVDF膜上,5%脫脂奶粉封閉后,一抗4 ℃封閉過夜,再以辣根過氧化物酶標記的的二抗室溫封閉2h,ECL 顯色液顯色1~2min,轉移到熒光成像儀內曝光、檢測,實驗重復3次.
2 結果與討論
2.1 TW918的合成
合成的小分子化合物TW918是一種新的喹啉類萘甲酰胺衍生物.合成反應中,首先利用無水乙醇保護6-羥基-2-萘甲酸的羧酸基團;然后,將其與4,7-二氯喹啉進行親核取代,再胺解得到TW918,其產率為64.9%.此法操作簡便,原料便宜易得,反應效率高,易于進行工業化生產.
2.2 TW918的體外抗腫瘤活性
采用四氮唑鹽(MTT)[6]還原法,選擇人小細胞肺癌NCI-H446,非小細胞肺癌A549,食管癌Eca-109和肝癌HepG2四種腫瘤細胞模型,以吉非替尼為陽性對照,對合成的目標化合物進行體外抗腫瘤活性評價,并以人正常臍靜脈內皮細胞HUVEC、肝細胞LO2、胚肺成纖維細胞MRC-5和食管上皮細胞HEEC考察化合物的體外毒性,結果如表1所示.表1中:n=3;與吉非替尼比較,a表示P<0.01,b表示P<0.001.
由表1可知:TW918對NCI-H446,A549,Eca-109和HepG2四種腫瘤細胞的抑制活性均高于吉非替尼;其中,對人非小細胞肺癌A549和人肝癌HepG2細胞的抑制作用較強,表明化合物TW918可能具有潛在對肺癌、食管癌和肝癌的治療作用.但對HUVEC,LO2,MRC-5和HEEC四種正常細胞而言,TW918和吉非替尼對它們的抑制作用明顯弱于對腫瘤細胞的作用,預示TW918相對較為安全.
表1 TW918對腫瘤細胞和正常細胞的體外抗增殖活性(±s)Tab.1 Anti-proliferation activity of TW918on tumor cells and normal cells in vitro(±s)

表1 TW918對腫瘤細胞和正常細胞的體外抗增殖活性(±s)Tab.1 Anti-proliferation activity of TW918on tumor cells and normal cells in vitro(±s)
化合物 IC50/μmol·L-1 G2 HUVEC LO2 MRC-5 HEEC TW918 0.88±0.74a 0.18±0.57a 1.04±0.90b 0.39±0.28b 107±4.86b 69.1±2.91b 74.6±1.86 110±0.86 NCI-H446 A549 Eca-109 Hep b.1±3.84 102±0.16 72.5±2.73 92.1±1.66吉非替尼 6.58±1.43 3.71±0.97 10.36±1.27 5.37±0.86 83
2.3 TW918與受體激酶EGFR的分子對接驗證
運用AutoDock 4.2.5軟件[7]模擬底物小分子TW918與受體激酶EGFR 的分子對接,如圖2所示.結果表明:TW918能以母核喹啉為頭,深入占據到EGFR 的活性口袋中與ATP結合位點結合(圖2),其中萘環結合激酶的疏水區域,喹啉環類似于ATP的腺苷片段,與激酶的“鉸鏈區”結合,其最低自由結合能為-46.1kJ·mol-1,提示TW918可能具有潛在的EGFR 抑制活性.
一般認為,小分子抑制劑與靶酶結合,起主要相互作用的是抑制劑周圍的氨基酸殘基,而這些氨基酸殘基可認為是活性殘基.TW918 與EGFR 活性殘基的對接作用模式,如圖3 所示.由圖3 可知:TW918上喹啉環與萘環間的醚鍵氧原子與LYS721殘基上的氫發生了氫鍵相互作用,鍵長約為0.22 nm.氫鍵的形成有利于化合物分子更好地占據靶蛋白分子的活性口袋,提高與靶蛋白結合的緊密性.

圖2 TW918與EGFR 活性位點的立體對接圖Fig.2 Stereo view of TW918bound in the active site of EGFR
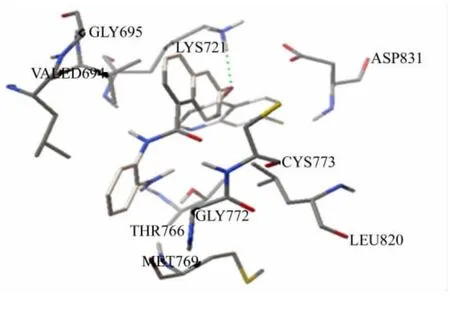
圖3 TW918與EGFR 活性殘基的對接作用模式Fig.3 Docking interaction pattern of EGFR active residues with TW918
2.4 TW918對EGFR蛋白表達的抑制作用
采用Western Blot 研 究TW918 對SMMC-7721,A549,Eca-109和SMMC-7721細胞EGFR 蛋白表達的影響,結果如圖4所示.由圖4可知:與陰性對照組(DMSO)相比,TW918能明顯抑制四種腫瘤細胞中EGFR 蛋白的表達,且該結果呈劑量依賴性,驗證了分子對接結果,表明該化合物可能通過與受體酪氨酸激酶EGFR 結合,抑制其表達,從而發揮體外抗腫瘤活性.

圖4 TW918對受體激酶EGFR 蛋白表達的影響Fig.4 Effects of TW918on expression of EGFR protein
3 結論
文中合成的小分子化合物TW918是一種新的喹啉類萘甲酰胺衍生物,化合物結構經核磁共振氫譜、碳譜和高分辨質譜表征確證.MTT 結果顯示:TW918對腫瘤細胞具有一定的抑制活性,但對正常細胞影響較小.分子對接結果表明:TW918能很好地深入EGFR 蛋白的活性口袋中,并與活性口袋周圍的氨基酸殘基形成氫鍵,具有潛在的EGFR 抑制活性.Western Blot實驗闡明:TW918能夠以劑量依賴性方式抑制EGFR 蛋白的表達,進一步驗證了分子對接結果.
綜上所述,TW918可能通過與受體酪氨酸激酶EGFR 結合,抑制其表達,從而發揮體外抗腫瘤活性.體外篩選和體內藥效學評估是評價抗腫瘤候選藥物有效性的兩個重要指標.在此基礎上,后續還需要通過更多的體內外實驗評價TW918的抗腫瘤活性,同時深入研究其作用機理,探索是否存在除EGFR 靶點外的其他作用位點[9-10].
[1]CHEN Xiao-guang,ZHANG Yi.Recent advance in the study of novel anti-tumor targets and drugs:Aurora kinase and Pin1[J].Acta Pharm Sin,2009,44(3):264-269.
[2]李娟,李延團,李曉明,等.分子靶向抗腫瘤藥物研究進展[J].生物技術通訊,2009,20(3):411-416.
[3]WEI L,MALHOTRA S V.Recent development of cyclic amide(pyridone/lactam)moiety containing heterocycles as protein kinase inhibitors[J].Curr Med Chem,2010,17(3):234-253.
[4]YOSHIMURA N,KUDOH S,KIMURA T,et al.EKB-569,a new irreversible epidermal growth factor receptor tyrosine kinase inhibitor,with clinical activity in patients with non-small cell lung cancer with acquired resistance to gefitinib[J].Lung Cancer,2006,51(3):363-368.
[5]姜夢,劉丹,蘭帥鵬.喹啉類蛋白酪氨酸激酶抑制劑的研究進展[J].化學試劑,2013,35(4):333-336.
[6]MOON D O,KIM M O,HEO M S,et al.Gefitinib induces apoptosis and decreases telomerase activity in MDA-MB-231human breast cancer cells[J].Arch Pharm Res,2009,32(10):1351-1360.
[7]COSCONATIL S,FORLI A,PERRYMAN A L,et al.Virtual screening with AutoDock:Theory and practice[J].Expert Opinion on Drug Discovery,2010,5(6):597-607.
[8]CARMI C,CAVAZZONI A,VEZZOSI S,et al.Novel irreversible epidermal growth factor receptor inhibitors by chemical modulation of the cysteine-trap portion[J].Journal of Medicinal Chemistry,2010,53(5):2038-2050.
[9]唐健紅,曾慶友.阿魏酸異辛酯的綠色合成[J].華僑大學學報:自然科學版,2011,32(5):551-553.
[10]NIE Jian-yun,LIU Xin,JIN Cong-guo,et al.The effect of histone deacetylase inhibitors on cell cycle of breast cancer cell line MCF-7[J].Clinical Medicine of China,2009,25(12):1238-1240.

