腦不對稱性對大鼠局灶性腦缺血模型的梗死體積及行為功能的影響
翟志永,趙桂鋒,馮娟
線栓法制作大腦中動脈閉塞(middle cerebral artery occlusion,MCAO)模型是采用血管內插入線栓阻斷大鼠大腦中動脈制成腦缺血損傷模型的方法[1]。目前對MCAO模型的研究主要集中于動物種類、性別、體重、線栓的選擇和處理、切口、線栓的插入方法等方面。至于動物手術的側別絕大多數情況只是根據個人的習慣選擇,很少有這方面的研究。研究者們近年來采用不同的動物模型對腦不對稱分別從結構上和功能上進行了大量研究,并且發現了海馬、前額葉、下丘腦等都存在不對稱[2-3]。這種不對稱對MCAO模型側別的選擇是否造成影響,研究者仍知之甚少。本研究通過不同時間點應用線栓法制作不同側別MCAO模型探討對大鼠神經功能和腦梗死體積的影響。
1 材料與方法
1.1 實驗動物及分組 SPF級健康雄性SD大鼠36只,體質量250~280 g,由北京華阜康生物科技有限公司提供。將其隨機分為左側MCAO組和右側MCAO組。各組再隨機分為缺血再灌注后1、3、7 d三個亞組,每個亞組6只大鼠。
1.2 實驗方法
1.2.1 缺血再灌注模型的制備 根據Zea-Longa線栓法[1],將所有大鼠以10%水合氯醛(0.35 ml/100 g)腹腔麻醉后仰臥固定在手術臺上。切開大鼠頸部正中皮膚及淺筋膜,鈍性分離胸鎖乳突肌與胸骨舌骨肌,暴露分離一側頸總動脈(common carotid artery,CCA)、迷走神經、頸外動脈(external carotid artery,ECA)和頸內動脈(internal carotid artery,ICA)。結扎ECA及CCA近心端,在CCA結扎的上端距離CCA分叉處剪一“V”形切口,用制備好的線栓沿CCA插至ICA分叉處,進線長度(18.5±0.5)mm(ECA與ICA分叉處為起點),然后固定栓線,順序縫合好肌肉皮膚。栓塞90 min后抽出栓線實現再灌注。
1.2.2 行為功能測試
1.2.2.1 神經功能缺損評分 采用Zea-longa評分法[1],于大鼠造模后1、3、7 d時分別進行神經功能缺損評分。0分:無神經缺損癥狀;1分:無法完全伸展梗塞對側前肢;2分:行走時向梗塞對側轉圈;3分:行走時向梗塞對側傾倒;4分:不能自發行走,痙攣、昏睡、意識喪失。術后清醒時評分在1~3分表示造模成功;0分和4分表示造模失敗,剔除。
1.2.2.2 Morris水迷宮試驗 取一不銹鋼桶,直徑120 cm,高40 cm,水池壁標明東南西北4個入水點將其分為4個象限。于其中一象限中心置一圓形平臺,高28 cm,直徑10 cm。內容自來水,水溫(24±2)℃,水高30 cm,平臺低于水面2 cm。用不透明的白色塑料泡沫碎屑均勻覆蓋水面。將大鼠頭朝池壁按東、南、西、北順時針4個入水點輕輕放入池中。記錄大鼠自入水至找到平臺所需的時間作為逃避潛伏期。每天訓練4次,每次間隔20 s,4次潛伏期的平均值作為當日最終成績進入最后統計。
1.2.2.3 梯形平衡木試驗 梯形平衡木由上窄下寬兩層梯形木條組成,大鼠從寬的一端走到窄的一端。如果大鼠的前爪(或后爪)放在寬的木條上,為一個錯誤腳步,記為1分。如果搭在了上面窄的木條的邊緣上,為半個錯誤腳步,記為0.5分。如果放在了上面窄的木條上,為一個正確腳步,記為0分[4]。計數老鼠通過平衡木的腳步總數,計算腳步錯誤率。
1.2.3 取材 大鼠斷頭取腦后用等滲鹽水沖凈,放入-20℃冰箱冰凍20 min。取出置于大鼠腦模具中,自視交叉水平做連續6片的冠狀切片(片厚2 mm)。將切片放于37℃ 1%TTC溶液中,避光孵育30 min,每隔10 min翻動一次。染色后腦片置于4%多聚甲醛中固定24 h,拍照。采用Image-Pro Plus 5.0圖像處理軟件計算每張切片患側腦梗死面積和對側全腦面積。公式計算腦梗死體積百分比(%)=患側梗死面積/對側全腦面積×100%。
1.3 統計學分析 采用SAS 9.1軟件,正態分布的計量資料以表示,組間比較采用t檢驗,以P<0.05為差異有顯著性。
2 結果
2.1 兩組大鼠神經功能缺損評分比較 術后造模不成功大鼠2只,不明原因死亡2只,引起蛛網膜下腔出血1只,給予隨機補充大鼠。造模成功的所有實驗動物均觀察到了神經功能缺失。兩組大鼠在術后3 d時神經功能缺損評分最高,7 d時都有顯著改善。在MCAO再灌注后的不同時間點(1、3、7 d),左側MCAO組大鼠的Zealonga評分均明顯高于右側MCAO組,而7 d時差異更為顯著(P<0.01)(表1)。
2.2 Morris水迷宮試驗 缺血再灌注后3 d時兩組大鼠的逃避潛伏期明顯增加,而在術后7 d時都有所改善。在MCAO再灌注后的不同時間點(1、3、7 d),右側MCAO組大鼠的逃避潛伏期均明顯高于左側MCAO組,表明右側MCAO組記憶功能損害更為嚴重,而7 d時差異最為顯著(P<0.01)(表2)。
2.3 梯形平衡木試驗 兩組大鼠的腳步錯誤率在缺血再灌注后3 d時最高,7 d時最少。在MCAO再灌注后的不同時間點(1、3、7 d),左側MCAO組大鼠的腳步錯誤率均明顯高于右側MCAO組,表明左側MCAO組的平衡運動功能損害更為嚴重,而7 d時差異最為顯著(P<0.01)(表3)。
2.4 兩組大鼠腦梗死部位及體積的比較 TTC染色顯示正常腦組織呈紅色,梗死區為白色。梗死多位于大腦皮層、紋狀體等部位,兩組在梗死累及的部位上基本相同。兩組腦梗死體積在I/R后3 d時最大(圖1),7 d時最小(圖2)。在I/R后1 d左右側腦梗死體積百分比分別為(24.18±4.55)%、(25.34±3.24)%,3 d時分別為(32.43±6.25)%、(35.17±4.63)%,比較差異均無顯著性;而I/R后7 d時,左側組梗死體積百分比(20.33±4.09)%顯著高于右側組(15.17±3.62)%,比較差異有顯著性(P<0.05)。
3 討論
以往認為腦不對稱性是人類大腦的特性,大腦左右半球無論在結構上還是功能上都存在差異。但隨著腦成像技術和分子生物學等的發展,發現腦不對稱性還普遍存在于脊椎動物及某些無脊椎動物[5-6]。大鼠及其他嚙齒類動物具有單側優勢現象[7]。研究者們近年來采用不同的動物模型對腦不對稱分別從結構上和功能上進行了大量研究,并且發現了海馬、前額葉、下丘腦等都存在不對稱[2-3]。
Longa等[1]以改良線栓法制備了MCAO模型,隨后該模型便被廣泛應用于動物腦缺血的研究。MCAO模型具有不開顱、效果肯定、可準確控制缺血再灌注時間及與人類腦缺血病理過程相似的特點,對于探索缺血性卒中的病理機制和治療評價具有重要價值。但在手術制作模型的側別選擇上絕大多數研究者只是根據個人的習慣,很少會考慮腦的不對稱性對MCAO后梗死體積和神經功能缺損的影響。
表1 兩組大鼠Zea-longa評分比較(±s)

表1 兩組大鼠Zea-longa評分比較(±s)
注:與右側MCAO組比較,aP<0.05,bP<0.01
表2 兩組大鼠的逃避潛伏期(±s)

表2 兩組大鼠的逃避潛伏期(±s)
注:與右側MCAO組比較,aP<0.05,bP<0.01
表3 兩組大鼠的梯形平衡木試驗腳步錯誤率(±s)
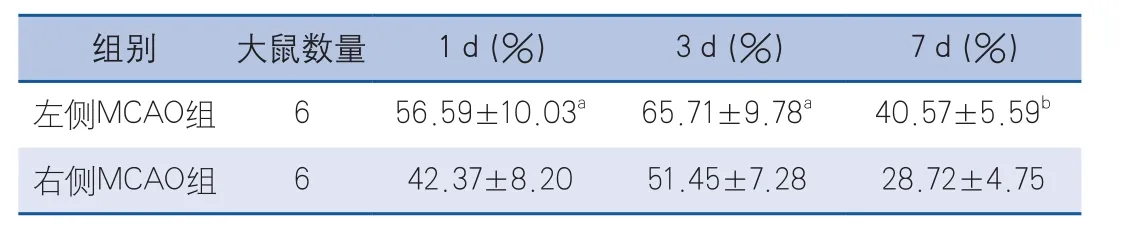
表3 兩組大鼠的梯形平衡木試驗腳步錯誤率(±s)
注:與右側MCAO組比較,aP<0.05,bP<0.01
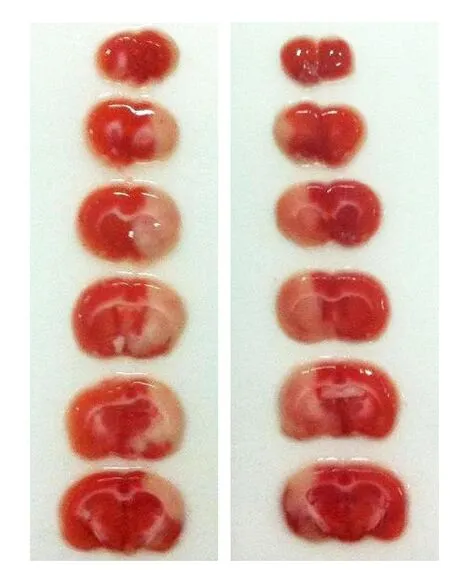
圖1 腦缺血再灌注后3 d左側和右側MCAO的TTC染色結果對比
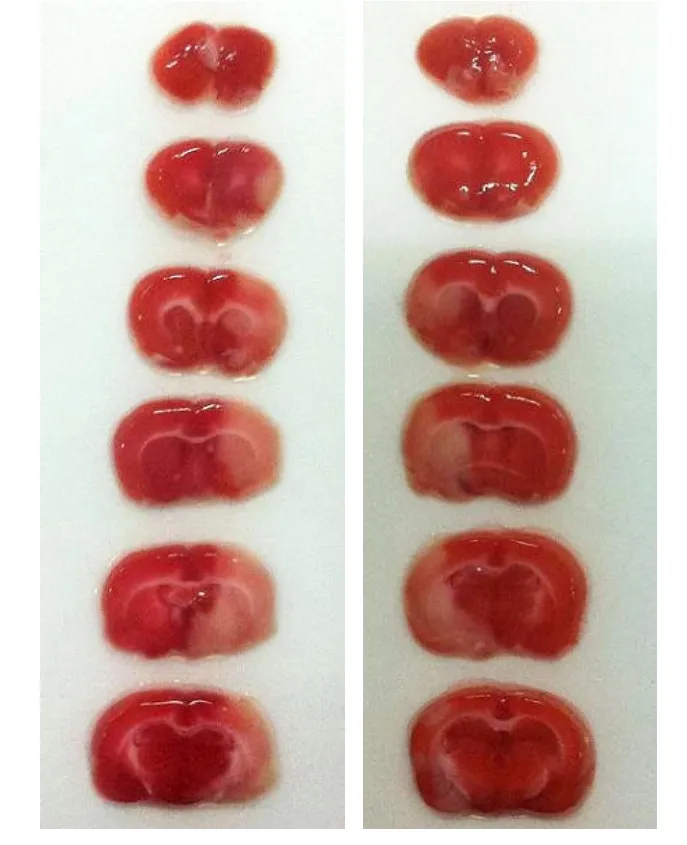
圖2 腦缺血再灌注后7 d左側和右側MCAO的TTC染色結果對比
本研究發現在MCAO再灌注后的不同時間點(1、3、7 d),左側MCAO組大鼠的神經功能缺損和腳步錯誤率均明顯高于右側MCAO組,表明左側MCAO組的平衡及運動功能損害更為嚴重,從而推測可能存在大鼠左側運動皮質功能占優勢。Klur等[8]發現,經歷過空間導航訓練的大鼠右側海馬CA1區的、與導航相關的空間信息處理基因表達發生變化數為623,而左側海馬CA1區基因發生變化數僅為74。Shinohara等[9]通過對小鼠腹側海馬聯合和胼胝體橫切,同時分別進行左右側眼球摘除手術的研究發現在記憶階段,小鼠的右側海馬占優勢。這就解釋了本研究在MCAO再灌注后的不同時間點(1、3、7 d),右側MCAO組大鼠的逃避潛伏期均明顯高于左側MCAO組,表明右側海馬功能占優勢,MCAO記憶功能損害也更為嚴重。Robinson[10]報道,大鼠右側MCAO后出現活動增多現象,病灶同側和對側的皮質及藍斑核內的去甲腎上腺素水平降低30%,黑質內多巴胺濃度降低20%,而左側MCAO后未見類似改變,提示大鼠左右半球腦缺血后行為和生化改變是大腦解剖和生理功能不對稱的結果。
有研究通過對成年大鼠MCAO術后的行為功能評價和病理學研究觀察到,優勢半球的梗死所致梗死體積更大、更嚴重,并伴有持久而顯著的神經功能缺損[11]。但本研究的實驗結果提示左側和右側MCAO模型引起的腦梗死均位于大腦皮層、紋狀體等部位,兩組在梗死累及的部位上無明顯差異。而且兩組腦梗死體積百分比在I/R后1及3 d時比較無明顯差異,提示MCAO早期對左右側梗死體積影響不大,神經功能缺損的差異來自于左右腦結構或功能的不對稱而非梗死體積的差別。而I/R后7 d時,左側組梗死體積百分比(20.33±4.09)%顯著高于右側組(15.17±3.62)%,比較差異有顯著性(P<0.05)。這可能是因為右側MCAO組開始時運動功能損害較輕,因此患肢得到更多的功能鍛煉。肢體的功能鍛煉促進了缺血側腦的神經再生和血管再生[12],進而更促進了肢體功能的恢復,因此在缺血再灌注后7 d時右側MCAO組大鼠的神經功能水平較左側有更明顯的改善(P<0.01)。
本研究只是從神經功能和梗死體積方面去推測大鼠大腦半球差異對MCAO模型的影響,后續研究可以檢測功能蛋白,采用蛋白組學及基因組學等方法考察大鼠左右大腦半球差異的分子機制。
1 Longa EZ,Weinstein PR,Carlson S,et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke,1989,20:84-91.
2 Halpern ME,Güntürkün O,Hopkins WD,et al.Lateralization of the vertebrate brain:taking the side of model systems[J]. J Neurosci,2005,25:10351-10357.
3 Goto K,Kurashima R,Gokan H,et al. Left-right asymmetry defect in the hippocampal circuitry impairs spatial learning and working memory in iv mice[J]. PLoS One,2010,5:e15468.
4 Zhao CS,Puurunen K,Schallert T,et al. Effect of cholinergic medication,before and after focal photothrombotic ischemic cortical injury,on histological and functional outcome in aged and young adult rats[J]. Behav Brain Res,2005,156:85-94.
5 Ocklenburg S,Güntürkün O. Hemispheric asymmetries:the comparative view[J]. Front Psychol,2012,3:5.
6 Vallortigara G,Rogers LJ. Survival with an asymmetrical brain:advantages and disadvantages of cerebral lateralization[J]. Behav Brain Sci,2005,28:575-589.
7 Elalmis DD,Ozgünen KT,Binokay S,et al.Differential contributions of right and left brains to paw skill in right- and left-pawed female rats[J]. Int J Neurosci,2003,113:1023-1042.
8 Klur S,Muller C,Pereira de Vasconcelos A,et al. Hippocampal-dependent spatial memory functions might be lateralized in rats:An approach combining gene expression profiling and reversible inactivation[J]. Hippocampus,2009,19:800-816.
9 Shinohara Y,Hosoya A,Yamasaki N,et al. Righthemispheric dominance of spatial memory in splitbrain mice[J]. Hippocampus,2012,22:117-121.
10 Robinson RG. Differential behavioral and biochemical effects of right and left hemispheric cerebral infarction in rat[J]. Science,1979,205:707-710.
11 高煥民,倪同尚,楊學偉,等. 腦的不對稱性影響大鼠局灶性腦缺血的結局[J]. 神經解剖學雜志,2009,25:87-90.
12 翟志永,馮娟. 腦缺血后運動療法的神經再生與血管再生機制[J]. 中國卒中雜志,2015,10:88-91.

