血糖波動對糖尿病大鼠小腸上皮細胞凋亡的影響及可能機制
李勝男 李 偉 周冬梅
(徐州醫學院附屬醫院內分泌科,江蘇 徐州 221000)
?
血糖波動對糖尿病大鼠小腸上皮細胞凋亡的影響及可能機制
李勝男李偉周冬梅
(徐州醫學院附屬醫院內分泌科,江蘇徐州221000)
〔摘要〕目的探討血糖波動對糖尿病大鼠小腸黏膜上皮細胞凋亡的影響及可能機制。方法用鏈脲佐菌素(STZ)誘導,間斷短效胰島素應用輔助高糖高脂飲食制備2型糖尿病(T2DM)血糖波動模型。12 w后,檢測大鼠血清丙二醛(MDA)水平及超氧化物歧化酶(SOD)活性;TUNEL法檢測小腸上皮細胞凋亡,免疫組化法檢測凋亡基因Bcl-2、Bax的表達。結果血糖波動組大鼠MDA水平、SOD活性與正常組、持續性高血糖組比較差異顯著(P<0.05);持續高血糖組大鼠小腸上皮可見少數陽性凋亡細胞表達,與正常組相比明顯增多(P<0.05);血糖波動組凋亡陽性細胞較持續高血糖組增多更加明顯(P<0.01)。血糖波動組、持續高血糖組Bcl-2的表達較正常組顯著下降,Bax顯著升高(P<0.05),血糖波動組Bcl-2的表達較持續高血糖組進一步下降,Bax進一步升高(P<0.05)。結論糖尿病大鼠血糖波動可明顯加速小腸上皮細胞凋亡。腸黏膜上皮細胞凋亡與血糖波動所致的氧化應激有關,Bcl-2/Bax參與氧化應激的過程。
〔關鍵詞〕血糖波動;凋亡;小腸;氧化應激;糖尿病
高血糖是糖尿病(DM)的標志,也是導致DM慢性并發癥的主要因素,臨床表現為慢性波動性高血糖與慢性持續性高血糖。有研究顯示〔1〕,血糖波動可通過不同途徑產生活性氧(ROS),誘導氧化應激反應,并介導凋亡基因的改變,造成組織、細胞的結構和功能障礙,導致DM并發癥的發生和發展。有關血糖波動對機體腸道的影響少見報道。本實驗擬通過建立2型糖尿病(T2DM)大鼠血糖波動模型,深入探討血糖波動下小腸上皮黏膜細胞凋亡情況及氧化應激相關因子表達情況。
1材料與方法
1.1建模和分組選用清潔級2月齡雄性SD大鼠45只〔徐州醫學院動物中心,合格證號:SCXK(蘇)2013-007〕。高糖高脂飼料配方為66.5%普通飼料,20%蔗糖,10%豬油,2.5%膽固醇,1%豬膽鹽,由徐州醫學院動物中心配制。將45只雄性SD大鼠隨機分成2組:正常組(n=15);模型組(n=30)。模型組用鏈脲佐菌(STZ,Sigma)35 mg/kg腹腔注射,48 h血糖≥16.7 mmol/L成模,將26只成模大鼠分成2組:①持續高血糖組(S組)14只,繼續高脂高糖飲食,不予任何治療;②血糖波動組(F組)12只,每日皮下注射1次普通胰島素12~16 U,根據血糖調整胰島素劑量,血糖10~20 mmol/L。飲食同S組。另15只未用STZ大鼠為對照組(N組),予普通飲食,3組大鼠均不限制飲水。S組和N組同時皮下注射等量生理鹽水。每周測血糖2 d,每天4次、滿12 w處死。
1.2取材連續觀察12 w后收集標本。稱量體重后,用10%水合氯醛按3~3.5 ml/kg腹腔注射麻醉,腹主動脈取血,3 000 r/min離心15 min后保存于-80℃冰箱,測血紅蛋白(HbA1c)(層析法);開腹取距回盲部2 cm處回腸組織,生理鹽水沖洗,行石蠟包埋,免疫組織化學。
1.3形態學光鏡觀察將石蠟包埋的小腸組織切片行蘇木精-伊紅(HE)染色,光鏡下觀察損傷程度。
1.4細胞凋亡用TUNEL法,按試劑盒說明書進行。檢測小腸組織切片中凋亡細胞的核酸斷裂片段并計算凋亡指數(AI)。結果判斷:以腸上皮細胞核內發現棕色顆粒為陽性.光鏡下計數每100個上皮細胞中凋亡細胞個數,每張切片任選5個視野,求其平均值。
1.5免疫組化檢測Bcl-2、Bax采用ABC法,實驗步驟按試劑盒說明進行,DAB顯色。每張切片隨機選擇2~3個視野(×400),采用美國 IPP5.0(Image-Pro plus)彩色圖像分析系統測定其吸光度值。
1.6統計學分析采用SPSS16.0軟件進行單因素分析、LSD及q檢驗。
2結果
2.1體重、血糖、HbA1c測定實驗前,3組大鼠體重比較無統計學差異(P>0.05);造DM模型后,S組、F組與N組比較差異顯著(P<0.01),S組和F組無統計學差異(P>0.05);造血糖波動模型后即處死前,S組、F組和N組比較,差異顯著(P<0.01),F組和S組比較差異顯著(P<0.05)。與N組相比,S組大鼠血糖水平明顯增高(P<0.05),即12 w內穩定處于高水平,而N組大鼠血糖則始終處于正常范圍內。F組24 h血糖波動較大,計算每組大鼠血糖變異系數(CV值),結果顯示CV與N組、S組比較差異顯著(P<0.05)。實驗結束時,F組和S組HbA1c均顯升高,與N組相比差異有統計學意義(P<0.01);F組和S組之間HbA1c水平差異無統計學意義(P>0.05)。見表1。
2.2血清丙二醛(MDA)水平及超氧化物歧化酶(SOD)活性比較F組及M組大鼠血清MDA水平及SOD活性與N組比較,差異顯著(P<0.01);F組大鼠血清MDA、SOD水平值與M組比較差異顯著(P<0.05),見表2。
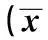
表1 各組大鼠體重及血糖的變化±s)
與N組比較:1)P<0.01;與S組比較:2)P<0.05,下表同

表2 各組大鼠血清MDA、SOD水平比較
2.3光鏡下N組回腸黏膜顯示規則的絨毛,有刷狀緣,絨毛上皮細胞核呈柱狀,排列整齊;S組回腸黏膜絨毛結構斷裂,絨毛高度降低,組織充血,黏膜及黏膜下層伴有炎細胞浸潤,絨毛上皮細胞核形態不規則;F組較S組更加明顯。見圖1。
2.4免疫組化染色結果3組大鼠Bax、Bcl-2在小腸上皮黏膜細胞均有陽性;光鏡下可見小腸黏膜上皮細胞Bax在胞質中棕褐色表達,胞質中有許多細小顆粒結構,胞核不著色,各組著色強度不一;S組Bax蛋白表達較N組明顯升高,F組較S組升高;F組Bcl-2蛋白表達較N組明顯下降,F組較S組下降。見圖2。
2.5TUNEL檢測TUNEL染色可見細胞核呈棕褐色反應的陽性凋亡細胞,胞核內染色質濃縮形成密集顆粒位于核膜下,有的胞核被降解,胞質不著色。S組大鼠小腸黏膜上皮細胞AI明顯高于N組(P<0.01),F組高于S組(P<0.05)。見圖3,表3。

圖1 各組大鼠小腸黏膜組織形態學(HE,×400)


圖2 各組大鼠小腸組織Bax、Bcl-2蛋白表達(SABC法,×400)

組別nAI凋亡率(%)N組125.8±6.518.28±6.02S組1221.98±7.131)32.81±5.801)F組1036.16±5.161)2)48.64±7.231)2)

圖3 各組大鼠小腸組織細胞凋亡情況(TUNEL,×400)
3討論
氧化應激是指反應性氧簇 (ROS)產生增多和(或)清除減少,導致ROS在體內蓄積而引起的分子、細胞和機體的損傷〔2〕。已有研究顯示血糖波動可通過不同途徑產生ROS,誘導氧化應激反應,造成組織、細胞的結構和功能障礙,導致DM并發癥的發生和發展〔3〕。本研究發現血糖波動大鼠血清MDA水平及SOD活性顯著高于血糖持續大鼠,反映血糖波動促進機體出現顯著的氧化應激反應。Ge等〔4〕將豬腸內皮細胞置于波動性高血糖和持續性高血糖中,相比持續性高血糖,NADPH氧化酶活性明顯增高,在某種程度上細胞內ROS產物與增強的NADPH活性有關。本研究結果與既往研究一致。細胞凋亡是細胞配體與細胞死亡受體結合或細胞損傷誘導各種水解酶激活,導致細胞蛋白分解、DNA碎裂、染色體積聚等一系列受嚴格調控的病理生理過程〔5〕。高血糖可引起腸道組織結構和功能改變。DM可引起腸道上皮細胞凋亡。有研究顯示〔6〕,應激狀態下腸上皮細胞氧化應激水平與其凋亡程度呈正相關,氧化應激可導致腸上皮細胞凋亡調控基因與蛋白表達的變化,腸上皮細胞凋亡水平的變化可能與凋亡相關蛋白表達的失衡有關,Bcl-2基因家族參加腸道上皮細胞凋亡的發生,Bcl-2和Bax蛋白水平高低與凋亡直接相關,Bax的表達能促進細胞凋亡,而bcl能抑制凋亡。Jafari等〔7〕研究發現,DM大鼠Bax/Bcl-2表達增加,Caspase-3活性增強,細胞凋亡增加。李偉等〔8〕發現血糖波動可明顯加速DM大鼠海馬CA1區神經元凋亡,引起Bcl-2、Bax異常表達。本實驗結果顯示,F組和S組較N組而言其Bax含量顯著升高,Bcl-2含量顯著減低,與S組比F組大鼠小腸上皮細胞中Bax表達顯著增加。而Bcl-2的表達較M組明顯減少。結合本實驗同時觀察到血糖波動組大鼠小腸上皮細胞出現核染
色質濃縮和邊集等凋亡的早期表現更加明顯,本研究認為細胞凋亡參與了上述DM腸道上皮損壞的病理過程,血糖波動作為一種獨立危險因素誘導Bax蛋白的表達,介導了Bcl-2的裂解,促使Bax/Bcl-2的比值升高,破壞線粒體膜,放大死亡信號,使細胞最終不可逆的走向凋亡〔9〕。結果支持血糖波動可能具有直接促凋亡的作用,提示DM大鼠血糖波動可加重其腸道損傷。目前對于這種波動性血糖較持續者更為嚴重的機制尚不清楚。Monnier等〔10〕的臨床研究表明波動性高血糖較持續性高血糖更能激活DM患者的氧化應激;在慢性高血糖狀態下,機體可通過一定程度的適應能力調節代謝,使其發生改變來部分對抗葡萄糖的毒性效應,而波動性高血糖則這種適應能力受損,引起嚴重的糖毒性效應。因此,減少血糖波動,逆轉氧化應激對組織細胞的損害,可能會對DM及其并發癥的防治起到重要的作用。
4參考文獻
1Brownlee M.Biochemistry and tool ecular cell biology of diabetic complications〔J〕.Nature,2001;414:813-20.
2Kiyomoto H,Rafiq K,Nosbofa M,etal.Possible underlying mechanisms responsible for aldosterone and mineralocorticoi receptor-dependent renal injury〔J〕.J Pharmacol Sci,2008;108(4):399-405.
3Brownlee M.Biochemistry and molecular cell biology of diabetic complications〔J〕.Nature,2001;414:813-20.
4Ge QM,Dong Y,Zhang HM,etal.Effects of intermittent high glucose on oxidative stress in endothelial cells〔J〕.Acta Diabetol,2010;47(1):97-103.
5Orrenius S,Gogvadze V,Zhivotovsky B.Mitochondrial oxidative stress:implications for cell death〔J〕.Ann Rev Pharmacol Toxical,2007;47:143-83.
6周靜,王杉,葉穎,等.應激狀態下腸上皮細胞凋亡水平的變化及其機制〔J〕.中國危重病急救醫學,2005;17(5):268-72.
7Jafari AI,Sankian M,Ahmadpour S,etal.Evaluation of Bcl-2 family gene expression and Caspase-3 activity in hippocampus STZ-induced diabetic rats〔J〕.Exp Diabet Res,2008;2008(1):69-70.
8李偉,孫娟,殷松樓,等.血糖波動對糖尿病大鼠海馬神經元凋亡相關蛋白表達的影響〔J〕.基礎醫學與臨床,2009;29(10):1065-9.
9Loy R,Tariot PN.Neuroprotective properties of valproate:potential benefit for AD and tauopathies〔J〕.Mol Neurosci,2002;19(3):303-7.
10Monnier L,Mas E,Ginel C,etal.Activation of oxidative stress by acute glucose fluctuations compared with sustained chronic hyperglycemia in patients with type 2 diabetes〔J〕.JAMA,2006;295:1681-7.
〔2014-12-03修回〕
(編輯趙慧玲/曹夢園)
·《中國老年學雜志》鄭重聲明·
中國老年學雜志從未設任何網站,唯一投稿方式為郵箱投稿,投稿郵箱為:okgood911@126.com 。唯一咨詢電話:0431-88923384 。唯一匯款方式為郵局匯款,匯款地址:長春市建政路971號《中國老年學雜志》編輯部收,郵編:130061。
〔中圖分類號〕R587.1
〔文獻標識碼〕A
〔文章編號〕1005-9202(2016)07-1598-03;
doi:10.3969/j.issn.1005-9202.2016.07.027
通訊作者:李偉(1957-),男,教授,主任醫師,碩士生導師,主要從事內分泌疾病發病機制研究。
第一作者:李勝男(1988-),女,碩士,主要從事糖尿病并發癥的診斷及治療研究。

