玉米須多糖研究現狀
宮春宇+鄭喜群+陳澤峰
摘要: 玉米須多糖是傳統中草藥玉米須的主要功能性成分之一,具有廣泛的生物學活性,具備開發潛力。主要就玉米須多糖在提取、純化、組成以及生物學活性方面的研究現狀作一綜述,以期為玉米須多糖研究及開發提供理論借鑒。
關鍵詞: 玉米須;多糖;提取方法;純化技術;多糖組合;研究現狀;生物活性
中圖分類號: TS201.1;R284.1 文獻標志碼: A 文章編號:1002-1302(2016)03-0004-05
玉米須是禾本科植物玉米(Zea mays L.) 的干燥花柱,為《中華人民共和國衛生部藥材標準》1985版(一部)[1]收錄的常用藥材品種之一,具有多種生物學活性,如調節免疫[2]、抗氧化[3-5]、降血糖[6]等。我國民間食用玉米須水用于防病、治病歷史悠久,美國1991年認定玉米須為非處方藥品[7]。Wang 等連續喂食雄性和雌性Wistar大鼠8%(相當于 9.354 g/kg 和10.308 g/kg 體質量)玉米須90 d,未發現有不良影響,進一步了證實玉米須的安全性[8]。研究發現玉米須中含有多糖、黃酮、植物甾醇、生物堿、隱黃素和有機酸等多種功能成分[9]。
玉米須多糖是其主要功能性成分之一,近年來有關玉米須多糖制備和生物活性研究方面的報道增加迅猛,本文重點就玉米須多糖提取、純化、組成以及生物學活性方面的研究進展作一綜述,以期為玉米須多糖未來研究和開發利用提供理論借鑒。
1 玉米須多糖提取
多糖是單糖通過糖苷鍵連接形成的水溶性高分子聚合物,不溶于乙醇等有機溶劑,因此傳統的多糖提取主要采用水提醇沉的方法。近年來隨著超聲波、微波和酶解等技術的蓬勃發展,很多學者將其作為多糖提取的輔助技術,以期進一步提高多糖提取率。
1.1 水提醇沉法
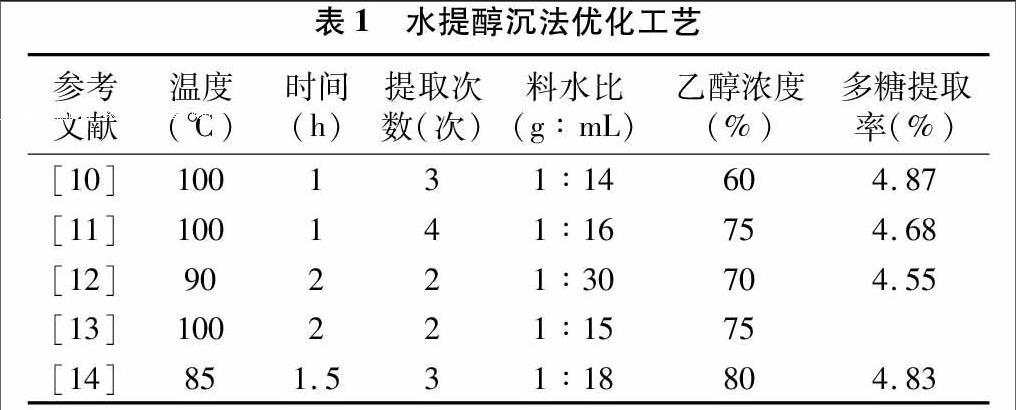
水提醇沉法是多糖提取的傳統方法,在多種來源的多糖提取中被應用。其原理是利用多糖具有大量的羥基親水基團易溶于水的特性,采用熱水將原料中多糖組分溶出,再利用乙醇等有機溶劑將多糖從水溶液中沉淀分離。影響多糖提取的因素主要包括提取溫度、提取時間、提取次數、料水比,沉淀多糖時乙醇濃度[10-14]等。采用水提醇沉法提取多糖的研究比較多,優化后的提取工藝差異較小,多糖提取率比較穩定(表1)。也有學者報道,采用高溫121 ℃提取玉米須多糖可以將提取時間縮短至25 min[15]。醇沉法雖具有操作簡單,提取效果好等優點,但由于需要消耗大量的有機試劑,對環境有一定影響,不符合節能環保的發展理念,因此并不適用于規模化生產。
1.2 超聲波輔助提取法
超聲波是物質介質中的一種彈性機械波,其頻率范圍為2×104~2×109 Hz,超聲波在物質介質中形成介質粒子的機械振動,可引起與媒質的相互作用,超聲波在液體內的作用主要來自超聲波的熱作用、機械作用和空化作用[16],有利于增加多糖溶質的溶出。又因超聲波為物理作用,無需外加任何化學試劑,不會破壞多糖,因此被認為是良好的輔助提取方法。影響超聲波作用效果的主要是超聲時間、固液比、超聲波功率等。Prakash Maran 等運用Box-Behnken 響應面分析方法,優化了玉米須多糖超聲波提取工藝,獲得最優工藝:提取溫度56℃、提取時間17 min、固液比1 g ∶ 20 mL,多糖提取率達6.06%[17]。
1.3 微波輔助提取法
微波是波長介于1 mm~1 m(頻率介于3×105~3×106 Hz)的電磁波。微波提取過程中,微波輻射導致植物細胞內的極性物質,尤其是水分子吸收微波能,產生大量熱量,使細胞內溫度迅速上升,液體水汽化產生的壓力將細胞膜和細胞壁沖破,形成微小的孔洞,進一步加熱,細胞內部和細胞壁水分減少,細胞收縮,表面出現裂紋,有利于細胞外溶劑進入細胞內,溶解釋放出胞內物質[18]。趙文竹等采用Plackett-Burma設計方法、中心組合試驗及響應面分析方法,優化微波法提取玉米須多糖的工藝條件,獲得最優工藝參數:溫度為85 ℃,功率為400 W,液固比為80 mL ∶ 1 g[19]。
1.4 酶水解輔助提取法
酶輔助提取是近幾年發展起來的一種新技術,主要是利用酶將生物質材料中束縛多糖溶出的成分進行分解,以利于多糖提取。由于酶處理條件較溫和,因此酶處理可以提高多糖的得率,同時保持多糖的構象與生物活性[20]。酶水解提取過程通常有2種,第1種是先進行酶水解,再經滅酶操作后,用熱水提取;第2種是先熱水提取,再利用酶水解原料殘渣進一步提取[21]。多糖提取率受到酶種類、酶解溫度、pH值、酶添加量等多種因素的影響[21-22]。常采用的酶種類主要包括纖維素酶、木瓜蛋白酶、半纖維素酶、果膠酶[21]等細胞壁成分分解酶。這主要由于纖維素、半纖維素、果膠質及木質素等物質構成致密結構的植物細胞壁在保持細胞形態、調節胞內外物質擴散等方面起著至關重要的作用[23]。
何余堂等選取花絲種類(嫩花絲、半老花絲和老花絲)、酶添加量、水浴溫度以及水浴時間4 個因素,運用L9(34)正交試驗方法,優化了酶水解玉米花絲多糖提取工藝:采用半老花絲,纖維素酶添加量為4%,水浴溫度55 ℃,時間2.5 h[24]。酶法分離花絲多糖的提取率為4.35%,比不加酶提取高2.5百分點。
由于多糖大多存在于細胞壁或細胞內,酶水解破壞細胞壁,降低傳質阻力,被認為是有效的提高多糖提取率的方法,并且酶水解對設備要求也遠遠低于超聲波和微波輔助技術,因此酶解輔助提取玉米須多糖更適合規模化生產,缺點是酶價格較高,因此成本會有所提高。
1.5 多種輔助提取技術聯合應用
除各種輔助提取技術單獨被應用到多糖提取研究中之外,學者們還對不同輔助提取技術組合應用對玉米須多糖提取的影響進行了研究。
孫海濤等采用單因素試驗(超聲時間、料液比、pH、酶用量)和正交試驗的方法研究了超聲輔助纖維素酶解(先酶解后超聲)提取玉米須多糖工藝,最終確定影響提取率的主次因素分別是料液比、酶用量、超聲時間和pH值,最佳工藝條件是超聲時間為90 min,料液比為1 g ∶ 20 mL,pH值為5.0,酶用量為2.0%,多糖提取率達4.93%[25]。陳紅等采用先纖維素酶水解再微波的方法提取玉米須多糖,并運用正交試驗對微波功率、微波時間、纖維素酶用量和酶解溫度進行了優化,最終獲得最佳提取工藝為微波功率500 W、微波處理時間2 min、液料比30 mL ∶ 1 g、纖維素酶用量1.5%、酶解溫度50 ℃、酶解時間40 min、pH值5.0[26]。易延逵等采用正交試驗方法研究了沸水提取玉米須多糖后再輔助以纖維素酶或木瓜蛋白酶水解提取對玉米須多糖提取率的影響。結果表明纖維素酶輔助提取最佳提取工藝為酶解時間40 min、酶解溫度80 ℃、酶解濃度1.0%,多糖提取率4.926%;木瓜蛋白酶輔助提取最佳提取工藝為酶解時間120 min,酶解溫度40 ℃、酶濃度1.5%,提取率達5.44%[27]。
多種輔助提取技術組合應用,不僅可以發揮每種輔助提取技術的優點,并且相互之間還有促進作用,能最大程度的提高多糖提取率,但其缺點是提取周期長,設備投入大。
2 玉米須多糖純化
多糖由于聚合度不同,分子量分布比較廣,數量級104~106 u,甚至更高。由于多糖提取主要采用水為溶劑,因此提取到的多糖中還含有水溶性蛋白、色素等雜質。多糖純化就是將粗多糖中雜質去除和分離多糖純品的過程。目前玉米須多糖純化研究主要集中在蛋白質和色素等雜質的脫除,而對多糖純品的制備研究比較少。
2.1 脫蛋白
對于體系中的游離蛋白脫除,可以采用Sevag法、TCA法(三氯乙酸)和等電點沉淀法等。其中Sevag法條件比較溫和,有利于多糖結構和構象的穩定,是目前應用較多的蛋白脫除方法。該方法根據蛋白質在氯仿等有機溶劑中變性沉淀的特點,將蛋白質脫除,但Sevag單次脫除率較低,一般需要4~5次,因此常需對脫蛋白工藝進行優化[28-29]。周鴻立等優化了Sevag法脫蛋白質條件,獲得最優工藝為氯仿與正丁醇比5 ∶ 1,樣液與試劑比2 ∶ 1,振蕩時間8 min,脫蛋白次數4 次。利用此工藝蛋白脫除率達64.2%,多糖損失率為34.3%[30]。另外,周鴻立等還研究了Sevag 法與酶法聯用脫除蛋白工藝,脫蛋白順序為先酶水解再加入Sevag 試劑,獲得最佳工藝為酶底比2.5(mg/L)、溫度50 ℃、振蕩時間8 min、脫蛋白次數2 次[31]。采用此工藝蛋白脫除率69.97%,多糖剩余率94.51%。可見,Sevag法與酶法聯用的蛋白脫除率略好于單獨采用Sevag法,更重要的是降低了多糖損失。這主要是由于減少了Sevag法脫蛋白次數,而多糖的損失與Sevag法脫蛋白次數成負相關。趙文竹等采用Sevag法6次脫蛋白,蛋白質脫除率達到了80%,但多糖損失嚴重,損失率達到54.47%[32]。三氯乙酸(TCA)法對玉米須多糖的蛋白脫除效果也非常好,應用TCA法脫蛋白后,在280 nm 附近不存在明顯的吸收峰,說明糖結合蛋白基本除盡[33]。但這樣就有可能破壞糖與蛋白的結合綴合物(糖蛋白),而糖蛋白是很重要的一類具有生物學活性的糖綴合物[34]。
2.2 脫色素
成熟玉米須為深褐色,色素含量較高,提取的粗多糖顏色比較深,因此需要脫色處理。常用脫色方法包括,活性炭吸附法、氧化法、樹脂吸附和離子交換法等。何余堂等報道活性炭吸附和大孔陰離子交換樹脂D315脫色效果優于次氯酸鈉和過氧化氫,其中活性炭的脫色率為87.9%,多糖保留率為81.5%,樹脂D315 的脫色率為83.4%,多糖保留率為76.6%[35]。但活性炭脫色后,通常會有殘留,不容易清除,易發生二次污染。同時,何余堂等還發現離子交換樹脂D392 和吸附樹脂AB-8 也具有良好的脫色效果,但要比D315差。他們通過正交試驗優化了D315脫色條件,獲得最優工藝為添加量為0.5 g/mL,pH值6.0,溫度45 ℃。在此工藝下脫色率達85.4%,多糖保留率為76.8%[36]。但也有學者的研究結果與之不符,周鴻立等就報道過氧化氫氧化脫色法優于活性炭吸附法,采用優化后脫色工藝,脫色率達90.70%,損失率18.80%,而活性炭法脫色率僅為14.76%[37]。因此,對于玉米須多糖的脫色研究還有待進一步深入。
2.3 小分子雜質脫除
周鴻立等研究了透析法去除玉米須多糖中小分子雜質的工藝,發現透析液與緩沖液體積比為1 ∶ 50的最佳透析條件為透析時間為7 h,溫度為30 ℃,更換緩沖液次數為3次,多糖純度由27.00%提高到42.35%[38]。
2.4 均一多糖制備
經脫蛋白、脫色等純化處理后,雖可提高多糖含量,但由于多糖自身分子量分布非常廣泛,所以單純提高糖含量(苯酚硫酸法等化學方法測定的糖含量),并不能制備到純多糖,即均一多糖(純多糖的概念不同于小分子化合物,沒有絕對的純品,而是相對純品,是指分子量分布相近的多糖組分的集合,因此稱之為均一多糖)。目前,均一多糖制備比較成熟的方法是先采用離子柱色譜對粗多糖進行初步純化,再將分離到的組分過凝膠柱色譜,最終制備到均一多糖。關于玉米須均一多糖的制備研究非常少。趙文竹等利用交聯葡聚糖凝膠色譜G-75和G-100分離經脫色和脫蛋白處理的玉米須多糖,但未分離到均一多糖[32]。郭曉強等運用DEAE-650C離子交換柱層析從水提醇沉法制備的玉米須粗多糖中分離到中性和酸性多糖組分各1個,質量分數分別為92.9%和95.3%,但沒對2種多糖的純度進行鑒定[39]。經高效凝膠滲透色譜法( HPGPC) 測定,中性和酸性多糖組分重均分子量分別為364 754.0 u和184 926.9 u。孫曉雪等優化了DEAE 纖維素純化玉米須總糖工藝,經DEAE 纖維素純化后中性多糖和酸性多糖分別占總多糖的30. 43% 和58. 88%,純度分別提高了約2.5、2倍[40]。
3 玉米須多糖的組成
由于玉米須均一多糖制備的缺失,僅有少量關于玉米須粗多糖的單糖組成和糖苷鍵類型的研究報道。趙文竹等運用氣相色譜分析發現玉米須粗多糖由甘露糖、半乳糖、木糖、阿拉伯糖和果糖組成[32]。王磊等同樣采用氣相色譜分析發現玉米須水溶性粗多糖由鼠李糖、阿拉伯糖和甘露糖3種單糖組成[41]。賈亞敏等報道經Sevag法脫蛋白初步純化的玉米須粗多糖CSCP,由鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖和半乳糖組成,它們的摩爾比為1 ∶ 1.99 ∶ 1.58 ∶ 0.54 ∶ 3.65 ∶ 3.61;紅外光譜顯示CSCP主要通過α-糖苷鍵連接[42]。趙文竹等利用紅外光譜分析了微波提取玉米須多糖的結構,發現該多糖具有明顯的多糖物質特征吸收峰,為吡喃型糖環[19]。劉曉飛等以氣相色譜-質譜聯用測定了經Sephadex G-100凝膠層析純化后的玉米須多糖,發現其以葡萄糖為主,另外還含有5種單糖,含量由高至低為半乳糖、阿拉伯糖、甘露糖、木糖和來蘇糖[43]。制備方法、玉米種類等因素不僅影響到玉米須多糖提取率,而且對玉米須多糖的組成也有一定影響,綜合多位學者研究結果,組成玉米須多糖的單糖的種類有葡萄糖、半乳糖、阿拉伯糖、甘露糖、木糖、鼠李糖、果糖和來蘇糖,其中葡萄糖和半乳糖可能含量較高。
4 玉米須多糖的生物活性
4.1 降血糖
糖尿病是目前危害人體健康的主要慢性疾病,經常伴隨多種并發癥,嚴重降低病患的生活質量,甚至危害生命。報道顯示玉米須多糖具有降血糖作用,可以降低模型小鼠的血糖值,提高肝糖原含量,減緩小鼠體質量降低[44](體質量減輕是糖尿病患常伴有并發癥)。梁啟超等報道玉米須水溶性多糖中劑量組(200 mg/kg)和高劑量組(400 mg/kg)可顯著降低高血糖模型小鼠血糖值(P<0.01),并呈現量效關系,其中高劑量組與二甲雙胍效果相當[45]。張艷等以玉米須多糖低、中、高劑量(3%、6%、12%的多糖溶液)分別灌胃給藥7 d后,皮下注射質量濃度0.1%腎上腺素,觀察玉米須多糖對小鼠肝糖原含量和胸腺、肝臟、脾臟和腎臟指數以及30、60、90 min的血糖值的影響。結果高劑量組能明顯降低60 min 和90 min 腎上腺素所致高血糖小鼠的血糖值和增加高血糖小鼠體內肝糖原含量,但對小鼠免疫臟器指數無明顯影響,表明玉米須多糖具有抗腎上腺素所致的升血糖作用[46]。玉米須多糖對高血糖小鼠的降糖作用,可能是通過合成肝糖原來調節血糖代謝,或可能與調節胰島細胞的分泌有關[47]。
4.2 免疫調節
現代醫學、細胞生物學和分子生物學的發展使人們認識到免疫系統的紊亂不僅會產生多種疾病,并且與人體衰老和老年發病有關。大量的研究表明,多糖最重要的藥理作用是免疫調節作用[48]。多糖主要通過誘生多種細胞因子,促進干擾素、白細胞介素等的產生;激活巨噬細胞(MΦ)、自然殺傷細胞(NK細胞)和T、B淋巴細胞等免疫細胞;激活網狀內皮系統和補體系統;促進抗體產生等多途徑、多層面來提高機體特異性和非特異性免疫功能[49]。鄭鴻雁等報道,玉米須多糖能顯著提高小鼠抗體生成脾細胞數以及增加脾臟、胸腺器官質量,表明其具有較強的調節小鼠體液免疫功能,同時還可以提高巨噬細胞吞噬指數,對巨噬細胞有一定的激活作用[50]。魏宏明等報道玉米須多糖具有較強的調節小鼠體液免疫功能和一定程度的調節小鼠巨噬細胞吞噬功能的作用[51]。賈亞敏等研究發現玉米須水溶性多糖CSCP(10、30、100 mg/mL)能夠明顯刺激小鼠脾細胞增殖,并呈現一定的量效關系,顯示玉米須多糖具有調節免疫作用[42]。
4.3 抗氧化
生物體自身代謝過程中會產生大量超氧陰離子自由基、羥自由基、過氧化氫(H2O2)和單線態氧等活性氧,前2種為自由基。活性氧有很強的氧化能力,可以引發脂質過氧化,破壞細胞膜、DNA等重要組織,對生物體危害極大。為了清除活性氧等氧化劑,生物體自身具有2類抗氧化系統。一類是以超氧化物歧化酶(SOD)、過氧化物酶(POD)、過氧化氫酶(CAT)、谷胱甘肽過氧化物酶(GSH-Px)、谷胱甘肽還原酶(GSH-R)等為主的酶催防御體系,另一類是包括維生素E、維生素A、維生素C,輔酶Q和硒等的非酶催反應系統。因此,正常機體的活性氧代謝是動態平衡的。現代自由基醫學研究顯示,生物體的衰老、癌變、炎癥和免疫性疾病等都與自由基代謝失衡有關[48]。玉米須多糖在體內和體外都有清除自由基、抗氧化作用。梁子安等發現200 mg/(kg·d) 和 400 mg/(kg·d) 2種劑量的玉米須多糖能明顯降低老年大鼠血清中丙二醛(MDA) 及腦和肝組織脂褐質(Lf) 含量,提高皮膚羥脯氨酸(Hyp)含量,并明顯提高老年大鼠血清中超氧化物歧化酶(SOD)、過氧化氫酶(CAT) 和谷胱甘肽過氧化物酶(GSH-Px) 活性,表明玉米須多糖具有體內抗氧化作用[52]。郭曉強等報道,多糖濃度為2.0 mg /mL 時,玉米須中性多糖對DPPH有微弱清除作用,而酸性多糖對自由基的生成具有很小的促進作用,但兩者都對超氧陰離子和羥自由基具有一定的清除作用,效果低于維生素C[39]。其中,中性玉米須多糖對DPPH、超氧陰離子以及羥自由基的清除率分別為4.158%、47.7%、43.8%,酸性多糖組分的相應清除率分別為-3.89%、53.2%、43.3%。
4.4 抗菌
何余堂等研究發現活性炭和大孔陰離子交換樹脂D315脫色后玉米花絲多糖對大腸桿菌、枯草芽孢桿菌、綠膿假單孢菌和痢疾志賀氏菌的抑菌活性與未脫色多糖相當,但次氯酸鈉和過氧化氫氧化脫色后的玉米花絲多糖的抑菌活性有所下降[35]。何余堂等還發現脫蛋白、脫色后玉米花絲多糖對細菌和真菌都具有明顯的抑菌活性,其中對革蘭氏陰性菌的抑制作用稍微優于革蘭氏陽性菌,總體上對細菌的抑制活性優于真菌,不同種類細菌抑制活性也有所不同,對綠膿假單孢菌、枯草芽孢桿菌、大腸桿菌和變形桿菌具有較強的抑制作用;對真菌的抑菌活性為絲黑穗病菌>白色念珠菌>玉米小斑病菌>釀酒酵母>玉米條銹病菌[53]。
4.5 利尿
張艷等報道玉米須Sevag法精制多糖(多糖含量54.0%)能明顯增加水負荷小鼠的排尿量(P<0.05),且同濃度下優于玉米須粗多糖[54]。竇傳斌等也曾報道玉米須多糖具有明顯的利尿作用[55]。
4.6 抗癌
研究發現玉米須多糖可以誘導人肝癌SMMC-7721細胞凋亡,從而抑制SMMC -7721細胞生長,并且抑制作用呈現劑量依賴和時間依賴[56]。
5 結束語
我國是玉米生產大國,據統計玉米年產量居世界第2位。因此,作為玉米副產物的玉米須資源十分豐富,但對它的開發利用并不充分。玉米須中多糖含量較高,且具有降糖、調節免疫、抗菌、抗腫瘤和利尿等作用,在醫藥、食品方面均有很好的應用前景和開發價值。近2年有關玉米須多糖的研究報道增長迅速,標志著玉米須多糖的研究和開發正成為熱點,但目前的研究也存在很多不足,如研究報道主要集中在粗多糖提取工藝和生物活性方面,而關于玉米須多糖的純化、多糖組成、結構以及均一多糖的生物活性等方面的研究非常少。雖然也有關于粗多糖單糖組成的研究報道[41-43],但由于粗多糖成分復雜,并不能真實反映玉米須多糖的單糖組成情況。因此,目前首要的問題是盡快解決玉米須多糖的純化難題,分離到玉米須均一多糖,以進一步研究其組成、結構及生物學活性,為其開發利用奠定理論基礎。
參考文獻:
[1]中華人民共和國衛生部藥材標準委員會.中華人民共和國衛生部藥材標準[M]. 北京:人民衛生出版社,1986.
[2]魯 彥,姚嵩坡,白大芳,等. 中藥玉米須對小鼠胸腺免疫功能的影響的實驗研究[J]. 黑龍江醫藥科學,2004,27(6):38.
[3]Maksimovi c' Z A,Kova cˇevi c' N. Preliminary assay on the antioxidative activity of Maydis stigma extracts[J]. Fitoterapia,2003,74(1/2):144-147.
[4]Maksimovi c' Z,Malen cˇi c' D,Kova cˇevi c' N. Polyphenol contents and antioxidant activity of Maydis stigma extracts[J]. Bioresource Technology,2005,96(8):873-877.
[5]Liu J,Wang C N,Wang Z Z,et al. The antioxidant and free-radical scavenging activities of extract and fractions from corn silk (Zea mays L.) and related flavone glycosides[J]. Food Chemistry,2011,126(1):261-269.
[6]張艷榮,許秀穎,劉婷婷,等. 玉米花絲飲品對糖尿病鼠的降血糖作用[J]. 吉林大學學報:醫學版,2008,34(4):569-572.
[7]Weight control drug products for over the counter human use,certain active ingredients[Z]. USA Food and Drug Administration,1991,56(153):37792.
[8]Wang C,Zhang T,Liu J,et al. Subchronic toxicity study of corn silk with rats[J]. Journal of Ethnopharmacology,2011,137(1):36-43.
[9]王英平,李向高. 玉米須化學成分和藥理作用研究進展[J]. 特產研究,2004(2):42-46.
[10]應奇才,華啟洪,蔡玲斐,等. 玉米須多糖提取工藝條件的優化[J]. 中國生化藥物雜志,2006,27(4):233-234.
[11]金麗梅,劉 偉,湯一哲,等. 水提醇沉法玉米須多糖提取工藝研究[J]. 黑龍江八一農墾大學學報,2007,19(5):62-66.
[12]李春陽,李 波,趙永春,等. 玉米須多糖提取工藝的研究[J]. 河南科技學院學報:自然科學版,2007,35(4):54-55.
[13]呂 剛,申 野,李 坦,等. 玉米須蠶繭多糖提取工藝條件優化研究[J]. 北華大學學報:自然科學版,2009,10(3):226-229.
[14]邵信儒,孫海濤,王 惠. 玉米須多糖提取工藝探究[J]. 通化師范學院學報,2010,31(10):49-51.
[15]于 輝,黃彩萍. 玉米須多糖高溫水提工藝研究[J]. 食品與發酵科技,2010,46(3):88-90.
[16]徐小麗,曹雁平. 超聲技術在食品工業中的研究進展[J]. 食品科技,2006(7):1-5.
[17]Prakash Maran J,Manikandan S,Thirugnanasambandham K,et al. Box-Behnken design based statistical modeling for ultrasound-assisted extraction of corn silk polysaccharide[J]. Carbohydrate Polymers,2013,92(1):604-611.
[18]汪茂田,謝培山,王忠東,等. 天然有機化合物提取分離與結構鑒定[M]. 北京:化學工業出版社,2004.
[19]趙文竹,殷涌光,于志鵬,等. 玉米須多糖微波提取工藝及其紅外光譜結構分析[J]. 吉林大學學報:工學版,2012,42(2):515-520.
[20]陳 棟,周永傳. 酶法在中藥提取中的應用和進展[J]. 中國中藥雜志,2007,32(2):99-101,119.
[21]游雪嬌,顧振新. 水-酶連續提取百合非淀粉多糖工藝研究[J]. 食品工業科技,2013,34(8):295-300.
[22]鄭 義,邵 穎,陳安徽,等. 斑玉蕈多糖的酶輔助提取及其抗氧化活性分析[J]. 食品工業科技,2013,34(12):210-213,233.
[23]宋東亮,沈君輝,李來庚. 高等植物細胞壁中纖維素的合成[J]. 植物生理學通訊,2008,44(4):791-796.
[24]何余堂,潘孝明,王兵兵. 玉米花絲多糖的酶法提取研究[J]. 食品科技,2010,35(3):230-232.
[25]孫海濤,邵信儒,夏光輝,等. 超聲輔助酶法提取玉米須多糖[J]. 食品研究與開發,2010,31(2):1-4.
[26]陳 紅,張艷榮,王大為,等. 微波協同酶法提取玉米須多糖工藝的優化研究[J]. 食品科學,2010,31(10):42-46.
[27]易延逵,張 璐,劉 莉,等. 正交設計優選玉米須多糖酶解提取工藝[J]. 山西醫科大學學報,2011,42(1):63-66.
[28]李布青,張慧玲,舒慶齡,等. 中低檔綠茶中茶多糖的提取及降血糖作用[J]. 茶葉科學,1996,16(1):67-72.
[29]汪東風,李 俊,王常紅,等. 茶葉多糖的組成及免疫活性研究[J]. 茶葉科學,2000,20(1):45-50.
[30]周鴻立,楊曉紅,李春華,等. 玉米須多糖sevag法脫蛋白的方法研究[J]. 安徽農業科學,2010,38(28):15517-15518,15521.
[31]周鴻立,楊曉虹. 玉米須多糖中蛋白質脫除的Sevag與酶法聯用工藝優化[J]. 食品科學,2011,32(8):129-132.
[32]趙文竹,于志鵬,于一丁,等. 玉米須多糖純化工藝的研究[J]. 食品工業科技,2009,30(12):292-296.
[33]王在貴,劉朝良,吳曉峰,等. 可溶性玉米須多糖的提取與純化[J]. 中國飼料,2010(9):33-35.
[34]連喜軍,羅慶豐,魯曉翔,等. 國內甘薯糖蛋白研究進展[J]. 糧食與油脂,2007,29(10):9-12.
[35]何余堂,宮照杰. 玉米花絲多糖脫色方法的研究[J]. 食品科學,2009,30(18):50-53.
[36]何余堂,潘孝明,宮照杰.利用大孔樹脂對玉米花絲多糖脫色的研究[J]. 食品工業科技,2011,32(5):299-301.
[37]周鴻立,吳德恒,董衛權,等. 玉米須多糖脫色工藝條件的研究[J]. 上海中醫藥雜志,2010,44(4):76-79.
[38]周鴻立,李春華,張英俊. 透析法精制玉米須多糖工藝的研究[J]. 上海中醫藥雜志,2010,44(10):81-83.
[39]郭曉強,何 鋼,楊軼浠,等. 玉米須多糖的制備及體外抗氧化活性研究[J]. 四川師范大學學報:自然科學版,2013,36(5):767-771.
[40]孫曉雪,康 杰,王 昶,等. DEAE纖維素純化玉米須總多糖的工藝優選[J]. 中國實驗方劑學雜志,2014,20(15):28-30.
[41]王 磊,劉秀鳳,邱芳萍,等. 微波輔助提取玉米須多糖及其組成的研究[J]. 食品與生物技術學報,2009,28(1):72-75.
[42]賈亞敏,朱艷霞,郭玉海.玉米須多糖理化特性及免疫調節活性研究[J]. 中國農業大學學報,2010,15(4):20-24.
[43]劉曉飛,劉 寧,張 娜,等. 氣相色譜-質譜聯用法測定玉米須多糖的單糖組成[J]. 食品科學,2012,30(20):249-251.
[44]楊靈玲,農紹莊,崔 瑾,等. 玉米須多糖的降血糖作用研究[J]. 食品科技,2011,36(3):152-154.
[45]梁啟超,武蕾蕾,才玉婷,等. 超聲波提取玉米須多糖對糖尿病小鼠血糖的影響[J]. 牡丹江醫學院學報,2011,32(3):15-16.
[46]張 艷,李永哲,周鴻立,等. 玉米須多糖對腎上腺素所致高血糖小鼠的影響[J]. 吉林化工學院學報,2011,28(7):27-29.
[47]俞利平,徐小冬,陳小囡,等. 玉米須多糖對糖尿病小鼠降糖作用的研究[J]. 浙江中醫雜志,2009,44(4):258-259.
[48]丁一芳,李連闖,趙 璽.多糖的研究進展[J]. 黑龍江醫藥,2006,19(2):123-126.
[49]劉 穎,金 宏,程義勇.多糖生物活性及其作用機制研究進展[J]. 中國公共衛生,2006,22(5):627-629.
[50]鄭鴻雁,閔偉紅,昌友權,等. 玉米須多糖調節免疫功能研究[J]. 食品科學,2004,25(10):291-293.
[51]魏宏明,李 娜.玉米須多糖調節免疫功能研究[J]. 吉林工程技術師范學院學報:自然科學版,2007,23(6):32-34.
[52]梁子安,李海劍,王克定,等. 玉米須多糖對老年大鼠的抗氧化作用研究[J]. 核農學報,2009,23(4):656-658.
[53]何余堂,潘孝明,王兵兵.玉米花絲多糖的分離與抑菌研究[J]. 食品研究與開發,2010,31(4):119-122.
[54]張 艷,金海甲,周靜姝,等. 精制玉米須多糖對小鼠利尿作用的研究[J]. 吉林化工學院學報,2010,27(2):24-26.
[55]竇傳斌,杜 娟,許啟泰.玉米須多糖的利尿作用研究[J]. 河南大學學報:醫學版,2007,26(3):35-37.
[56]呂冬霞,王曉麗,魏鳳香,等. 玉米須多糖誘導人肝癌SMMC-7721細胞凋亡的研究[J]. 黑龍江醫藥科學,2006,29(4):28-29.

