H2O2對水稻幼苗生長和生理的調節
蔡鳳香+陳豆豆+楊飛+鄭欣+張思韜+趙鳳云

摘要: 用水稻 (Oryza sativa L.) 中花 11 號分析了0.06%、0.006%、0.000 6% H2O2 處理 5 d 對水稻幼苗生長、H2O2 產生、細胞死亡及生長素積累分布的影響。結果表明,高濃度 H2O2 (0.06%)抑制地上部分和不定根的伸長及不定根上側根的形成和生長,但對初生根上的側根生長無明顯影響。低濃度(0.000 6% )H2O2 促進初生根和不定根的伸長及其側根數量增多和長度增加。根尖 H2O2 積累和細胞死亡隨著 H2O2 濃度的增大而增加。利用 DR5-GUS 轉基因水稻分析顯示高濃度 H2O2 促進生長素在根尖的過量積累,本試驗條件下 H2O2 對生長素積累和分布的調節與其激活轉錄有關。由此可見,高濃度 H2O2 對水稻幼苗生長的抑制作用與其誘導細胞死亡及生長素過度積累有密切關系。
關鍵詞: 過氧化氫(H2O2);生長素;水稻;幼苗;生理調節;側根數量;側根長度;根尖細胞
中圖分類號:S511.01 文獻標志碼: A
文章編號:1002-1302(2016)03-0074-04
H2O2是植物體內重要的信號分子,參與調節眾多細胞應答過程,包括生長發育、向地性生長和激素信號等[1]。對H2O2與根系生長發育的關系研究發現,在正常和脅迫條件下H2O2都參與根系形態建成的調節。如用不同脅迫處理擬南芥,產生的表型非常相似,暗示有共同的分子-生理系統調節脅迫下的形態應答,推測H2O2在控制形態建成變化中可能起關鍵作用[2]。非脅迫條件下,清除H2O2促進擬南芥根的伸長但抑制根毛的形成[3-4]。研究還發現,H2O2 既是玉米根細胞壁松弛和伸長生長所必需的[5],也是水稻根生長所必需的[6]。H2O2 是黃瓜[7] 和綠豆[Mucuna pruriens (Linn.) DC. var. utilis][8] 不定根形成和發育的信號分子。這些結果表明,H2O2 對調節根系的生長發育可能起關鍵作用。眾所周知,生長素是調節根系生長發育不可缺少的信號分子,它們是根細胞分裂、伸長生長、向地性應答和側根發育必需的[9]。研究顯示,H2O2 與生長素的相互作用對根系的生長發育產生影響。在正常生長條件下,生長素誘導H2O2 的產生是玉米根向地性生長所必需的[10]。用綠豆研究發現,外源生長素IBA誘導H2O2的過量產生,從而促進不定根的形成[8]。生長素促進番茄根尖H2O2 積累但抑制根的生長[11]。對擬南芥研究表明,H2O2代謝的變化可能通過影響生長素的平衡而控制脅迫誘導的形態生長應答[2]。氧化脅迫抑制擬南芥主根的伸長,但是能促進側根的形成。在脅迫誘導的生長重新定向過程中,H2O2可能促進生長素驅動的細胞分裂[2]。這些研究表明,H2O2 和生長素之間的相互作用參與了根系生長發育的調節。筆者前期研究發現,Cd脅迫誘導水稻根系生長的變化與H2O2 的積累有關[12]。Zn對Cd脅迫水稻根系生長的調節與其減少H2O2產生并誘導生長素積累和分布的變化有密切關系[13]。本試驗旨在研究非脅迫條件下外源H2O2調節水稻幼苗生長的生理機制。
1 材料與方法
1.1 材料與處理
挑選籽粒飽滿的水稻種子(品種為中花 11 號),去殼后消毒:75%乙醇(30 s)、0.1% 氯化汞(15 min)、2% 次氯酸鈉(20 min),用無菌水沖洗干凈,再將種子植入MS 培養基上,放入培養箱內[光周期為 14 h光照,光照強度為 200 μmol/(m2·s),溫度 26 ℃,夜間10 h,溫度 20 ℃;相對濕度約為 50%~60%]培養6 d后轉到Hoagland營養液,使其適應12 h后進行H2O2處理:在 Hoagland營養液中分別添加0.06%、0.006%、0.000 6%的H2O2處理5 d。每天更換1次培養液,每種處理重復3次,每次至少3個重復,每個重復約50株。
1.2 根系生長指標統計
初生根的長度:用尺子測量;初生根上側根的數量:只統計大于1 mm的;初生根上側根的長度:只測量5條最長的。每次重復測20株,每種處理統計60株。
不定根的數量:只計算大于1 cm的;不定根的長度:每株只測量5條最長的;不定根上側根的長度:每株只測量5條最長的不定根上的側根,每條不定根上只測量5條最長的側根;每條不定根上側根的數量:只統計大于1 mm的。每次重復測20株,每種處理統計60株。
1.3 H2O2的定性和定位測定
利用DAB染色法對根尖H2O2進行定性和定位分析[14],每種處理至少用20株染色。
1.4 細胞完整性的測定
通過Evans blue染色法對細胞完整性進行定性測定[15],每種處理至少染色20株。
1.5 根尖生長素分布和積累的測定
以轉DR5-GUS 基因水稻為材料,通過GUS 染色法對根尖生長素的分布和積累進行測定,GUS 染色參考Petersson 等的方法[16]進行。轉基因水稻種子在MS 培養基萌發生長6 d后轉入Hoagland營養液使其適應12 h后添加0.06%的H2O2,在上述同樣條件下處理3 h,該處理至少重復3次,每次重復至少用20株進行GUS 染色和活性測定。
1.6 H2O2 在RNA水平對水稻根系生長素分布的影響
將在MS固體培養基中培養6 d的水稻幼苗轉入 Hoaglands 營養液中適應12 h。在Hoaglands營養液中加入 DRB (5,6-dichlorobenzimidazole 1-β-D-ribofuranoside,RNA 合成抑制劑,濃度為65 μmol/L)預處理2 h后取出,轉入含0.06% H2O2的Hoaglands營養液中,在上述同樣條件下處理3 h。該處理至少重復3次,每次重復至少用20株進行GUS 染色和活性測定。
1.7 數據處理
用SPSS軟件對試驗數據進行處理,求出3次重復試驗的平均值和標準誤差。利用單因子方差分析各種處理與對照之間以及3種不同處理之間的差異,P<0.05 代表差異顯著。
2 結果與分析
2.1 H2O2對水稻幼苗生長的影響
2.1.1 H2O2對水稻幼苗株高和初生根長度的影響 圖1-A顯示,高濃度 H2O2 抑制植株生長,低濃度(0.000 6%)H2O2 對植株生長無顯著作用。0.06% H2O2處理5 d時其幼苗的株高比CK的低 24.3%,差異顯著(P<0.05)。低濃度(0.000 6%)H2O2 處理稍微促進初生根的伸長生長,但各濃度H2O2處理與對照組之間差異不顯著(P>0.05)(圖1-B)。
2.1.2 H2O2對水稻幼苗初生根上側根數量和長度的影響 與CK相比,低濃度(0.000 6% )H2O2促進初生根上側根數量的增多和長度的增加(P<0.05);高濃度(0.06% )H2O2處理幼苗初生根上側根的數量和長度與對照組差異不顯著(圖2)。
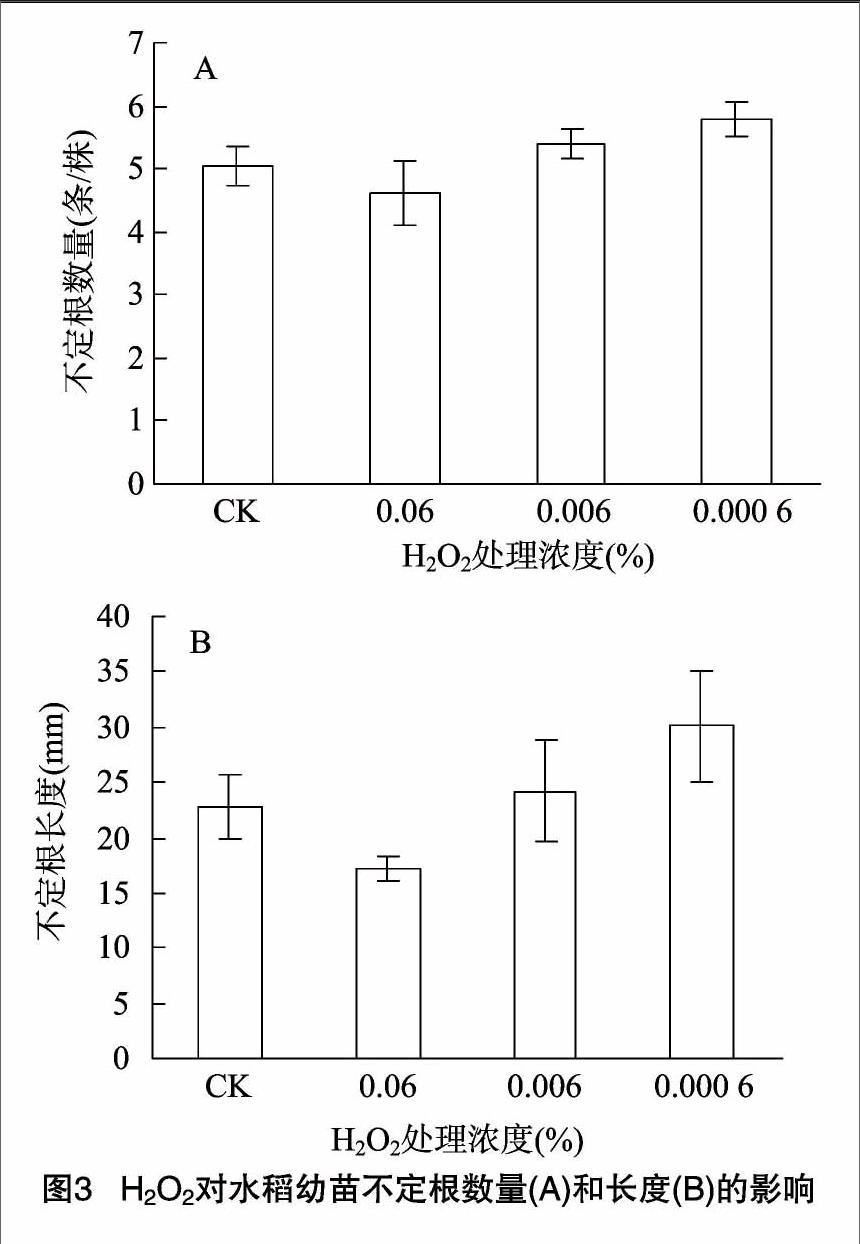
2.1.3 H2O2對水稻幼苗不定根數量和長度的影響 由圖 3-A 可見,3種濃度的 H2O2 處理幼苗的不定根數量與對照組之間無明顯差異(P>0.05)。高濃度(0.06% )H2O2處理抑制不定根的伸長生長,而低濃度H2O2 則促進不定根的伸長生長,0.000 6% H2O2處理的幼苗不定根比CK 的長32%(P<0.05),差異顯著(圖3-B)。
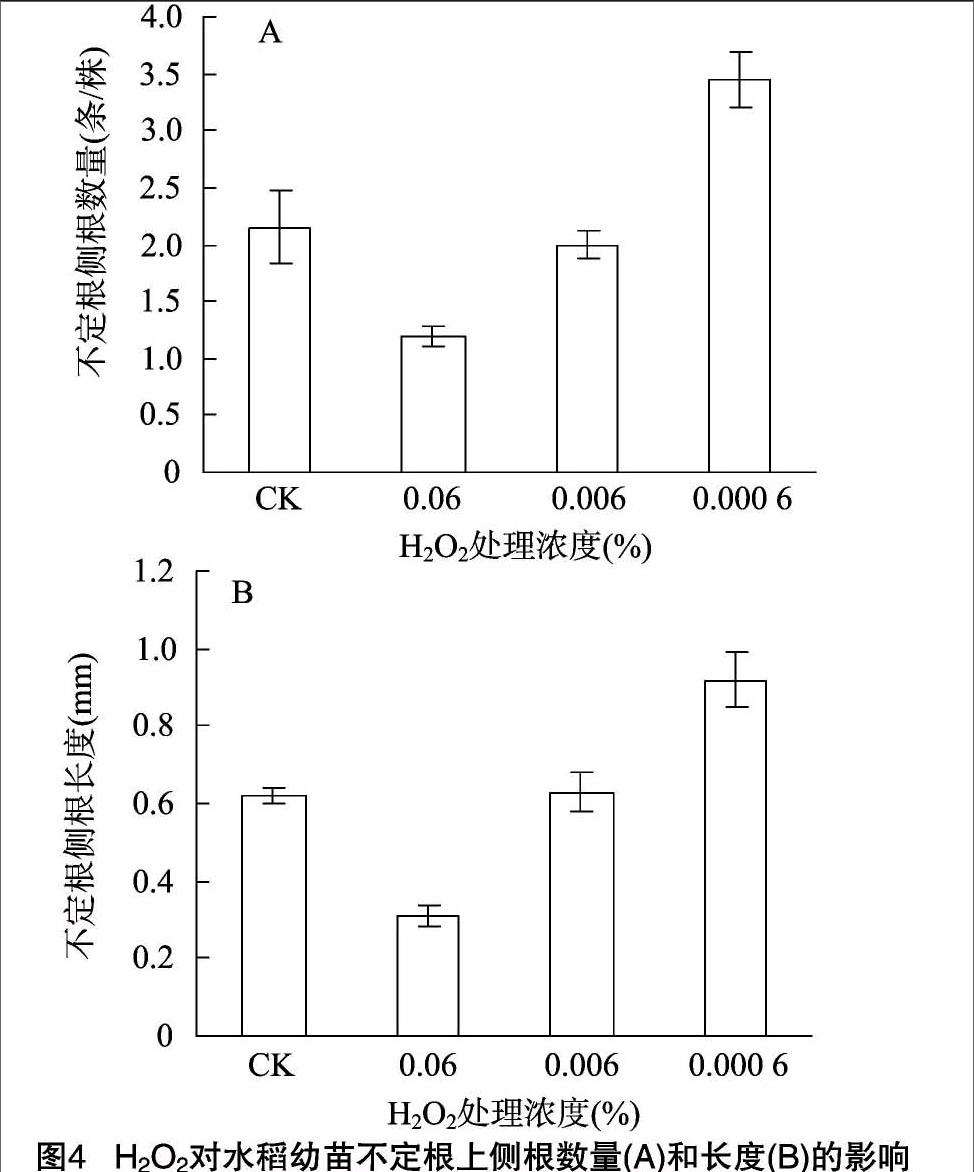
2.1.4 H2O2對水稻幼苗不定根上側根數量和長度的影響
與對照組相比,低濃度(0.000 6% )H2O2促進不定根上側根數量的增多和長度的增加(P<0.05);高濃度(0.06%)H2O2 處理顯著抑制不定根上側根的形成和生長(圖4),該處理條件下不定根上的側根數比對照組的少44.1%,差異極顯著(P<0.01)。
2.2 H2O2處理對水稻幼苗根系H2O2積累和分布的影響
如圖5所示,不同處理條件下初生根根尖上H2O2的積[JP3]累量存在差異,H2O2產生量由少到多的順序為CK <0.000 6% H2O2<0.006% H2O2<0.06% H2O2。H2O2主要集中在成熟區前端和伸長區,外源H2O2濃度越高積累面積越大。H2O2在不定根根尖中的積累變化情況與初生根的類似(數據略)。
2.3 H2O2處理對水稻幼苗根系細胞完整性的影響
細胞完整性是檢測氧化脅迫程度的重要指標之一,它與H2O2的積累有密切關系。為進一步了解外源H2O2 對細胞完整性的影響,試驗利用Evans blue染色法定性測定了細胞完整性的變化。圖6顯示,不同濃度H2O2處理條件下初生根上染色程度和分布面積存在差異,染色由淺到深和面積從小到大的順序為CK<0.000 6% H2O2<0.006% H2O2<0.06% H2O2。各種處理中染色深度與H2O2的積累(圖5)基本一致。在不定根根尖中的染色變化情況與初生根的類似(數據略)。
2.4 H2O2對水稻幼苗根系生長素積累和分布的調節
生長素是調節根系生長的重要信號分子之一。為了解H2O2對水稻幼苗根系生長的調節是否與生長素有關,本試驗利用轉DR5-GUS 轉基因水稻對0.06% H2O2處理幼苗根系生長素的分布和積累進行了測定 (圖7)。與對照相比,H2O2誘導生長素在整個初生根根尖的積累明顯增加,同樣條件下不定根中生長素的積累和分布與初生根的類似(數據略)。為了進一步分析H2O2 調節生長素積累分布的機制,對根系分別進行了DRB (RNA合成抑制劑)、BFA(蛋白運輸抑制劑)、CHX (蛋白合成抑制劑) 和 MG132(蛋白降解抑制劑)處理,結果顯示H2O2 +DRB處理的初生根根尖生長素的積累比單一H2O2處理的明顯減少。該處理條件下不定根中生長素積累也顯著減少(數據略),但是在H2O2 +BFA/CHX/MG132處理條件下根尖生長素的積累與單一H2O2處理的無明顯差異,說明本試驗條件下0.06% H2O2 誘導生長素的增加與其激活轉錄有密切關系。
3 討論
H2O2 是植物體內重要的信號分子之一,參與植物生長發育的眾多過程[1-8]。本研究結果表明,高濃度 H2O2 抑制水稻幼苗地上部分及不定根的生長,特別對不定根上側根的形成和生長具有顯著的抑制作用,但低濃度的 H2O2 促進植物的生長。在本試驗中,高濃度H2O2 對水稻幼苗生長的抑制作用可能與其誘導細胞的死亡增加有關。生長素在調節植物根系生長過程中發揮重要作用,但是生長素的過度積累則抑制植物的生長。大量研究顯示,H2O2 與生長素的相互作用對根系的生長發育產生影響[2,8,11]。如生長素促進番茄根尖 H2O2 的積累但抑制根的生長[11]。筆者前期研究發現,Cd 脅迫下水稻根系生長的變化與 H2O2 的產生和生長素的積累分布有關[12]。Zn 對 Cd 脅迫水稻根系生長的調節也與其減少H2O2 產生并誘導生長素積累和分布的變化有密切關系[13]。本試驗條件下高濃度(0.06%)的外源 H2O2 對水稻幼苗生長的抑制作用可能是由其誘導生長素的過度積累造成的。試驗結果表明,H2O2 導致的生長素過度積累可能是通過激活轉錄途徑調節的。由此可見,H2O2 和生長素互為因果關系,二者的平衡對調節植物的生長具有重要作用。綜上所述,適量 H2O2 是調節植物生長所必須的。高濃度 H2O2 引起細胞死亡和生長素在根尖的過度增加從而抑制植物生長。
參考文獻:
[1]Pasternak T,Potters G,Caubergs R,et al. Complementary interactions between oxidative stress and auxins control plant growth responses at plant,organ,and cellular level[J]. Journal of Experimental Botany,2005,56(418):1991-2001.
[2]Pasternak T,Rudas V,Potters G,et al. Morphogenic effects of abiotic stress:reorientation of growth in Arabidopsis thaliana seedlings[J]. Environmental and Experimental Botany,2005,53(3):299-314.
[3]Dunand C,Crèvecoeur M,Penel C. Distribution of superoxide and Hydrogen peroxide in Arabidopsis root and their influence on root development:possible interaction with peroxidases[J]. The New Phytologist,2007,174(2):332-341.
[4]Foreman J,Demidchik V,Bothwell J H,et al. Reactive oxygen species produced by NADPH oxidase regulate plant cell growth[J]. Nature,2003,422(6930):442-446.
[5]Liszkay A,Van Der Zalm E,Schopfer P. Production of reactive oxygen intermediates O-2[KG-*2]· ,H2O2,and ·OH by maize Roots and their role in wall loosening and elongation growth[J]. Plant Physiology,2004,136(2):3114-3123;discussion 3001.
[6]Kim S G,Kim S T,Kang S Y,et al. Proteomic analysis of reactive oxygen species (ROS)-related proteins in rice Roots[J]. Plant Cell Reports,2008,27(2):363-375.
[7]Li S W,Xue L,Xu S J,et al. Hydrogen peroxide involvement in formation and development of adventitious Roots in cucumber[J]. Plant Growth Regulation,2007,52(2):173-180.
[8]Li S W,Xue L,Xu S J,et al. Hydrogen peroxide acts as a signal molecule in the adventitious root formation of mung bean seedlings[J]. Environmental and Experimental Botany,2009,65(1):63-71.
[9] Joanovic M,Lefebvre V R,Laporte P,et al. How the environment regulates root architecture in dicots[J]. Advances in Botanical Research,2008,46:36-74.
[10]Joo J H,Yoo H J,Hwang I,et al. Auxin-induced reactive oxygen species production requires the activation of phosphatidylinositol 3-kinase[J]. FEBS Letters,2005,579(5):1243-1248.
[11]Ivanchenko M G,Den Os D,Monshausen G B,et al. Auxin increases the hydrogen peroxide(H2O2) concentration in tomato (Solanum lycopersicum) root tips while inhibiting root growth[J]. Annals of Botany,2013,112(6):1107-1116.
[12]Zhao F Y,Han M M,Zhang S Y,et al. Hydrogen peroxide-mediated growth of the root system occurs via auxin signaling modification and variations in the expression of cell-cycle genes in rice seedlings exposed to cadmium stress[J]. Journal of Integrative Plant Biology,2012,54(12):991-1006.
[13]高華健,王玉禎,侯 丹,等. 鋅調節鎘脅迫水稻幼苗根系生長的生理機制[J]. 江蘇農業科學,2013,41(12):49-52.
[14]Chen Z H,Feng T T,Liu L Y,et al. Effect of glucose on zinc-induced growth of root system in rice[J]. Agricultural Science and Technology,2011,12(9):1334-1337.
[15]Zhao F Y,Hu F,Zhang S Y,et al. MAPKs regulate root growth by influencing auxin signaling and cell cycle-related gene expression in cadmium-stressed rice[J]. Environmental Science and Pollution Research International,2013,20(8):5449-5460.
[16]Petersson S V,Johansson A I,Kowalczyk M,et al. An auxin gradient and maximum in the Arabidopsis root apex shown by high-resolution cell-specific analysis of IAA distribution and synthesis[J]. The Plant Cell,2009,21(6):1659-1668.

