高中化學“離子反應”(第二課時)教學設計
陳靜
摘 要:將“誘思導學”教學模式應用于“離子反應”(第二課時)的課堂教學中,同時將“建構學科觀念”作為教學設計的核心和向導。課堂教學以學生發展為根本,教師應引導學生獨立、主動、創造性地學習,以期實現對學生化學素養的培養、思維品質的提升。
關鍵詞:高中化學 誘思導學 離子反應 微粒觀
實驗探究
如何運用素質教育觀念優化教學過程、培養學生良好的學科素養和思維品質?這是我們迫切需要思考的問題。在“離子反應”(第二課時)教學中,我深入研究了新課標中對本節內容的學習要求,針對本節課的教學設計進行了一些思考和探索。
一、教材和學情分析
“離子反應”是高中新教材必修一第二章《化學物質及其變化》第二節的教學內容。從教材體系上看,它起著承上啟下的作用,是溶液導電性實驗、酸堿鹽電離知識的延續和深化,又是學習電解質溶液理論知識的基礎。學好這一節內容,能揭示溶液中離子反應的本質,既鞏固了前面已學過的電離初步知識,又為后面元素化合物知識、電解質溶液的學習打下了重要理論基礎。讓學生正確而又熟練地書寫離子方程式是學生必須掌握的一項基本技能。
高一學生已初步理解了復分解反應,學習了酸堿鹽在水溶液中的電離,會書寫電離方程式,會區分常見的電解質和非電解質;在學習“常見離子的檢驗”時已開始嘗試從離子角度去看待復分解反應,但認識未上升到一定高度;已初步接觸了一些水溶液中的反應,但還不能用離子的觀點來分析問題。
二、教學設計思路
英國教育理論家懷特海說:“學生是有血有肉的人,教育的目的是為了激發和引導他們的自我發展之路。”本節課中,我采用“誘思導學”教學模式,即“變教為誘,變學為思,以誘達思,以思促學”,以學生發展為根本,積極主動地創造條件,引導學生獨立、主動、創造性地學習。這種教學模式能在很大程度上推進化學教學的素質化,培養學生在創新、實踐、觀察等方面的能力。
知識能改變一個人看世界的深度,而學科思想可以決定一個人看世界的角度。“離子反應”專題是中學化學“觀念建構”教學模式的重要載體,它提供了一種分析問題、解決問題的新視角。在教學中,教師要引導學生逐步建立“分析溶液中物質的微粒及微粒間作用”的思路和方法,以此實現化學基本觀念“微粒觀”的建構。
三、教學目標
1.知識與技能
了解離子反應和離子方程式的含義;掌握離子反應發生的條件;學會用離子方程式表示溶液中的離子反應。
2.過程與方法
通過實驗探究和問題討論的過程,使學生學會運用以實驗為基礎的實驗研究方法;運用比較、分類、歸納、概括等方法對信息進行加工,初步形成分析推理、綜合歸納的能力。
3.情感、態度與價值觀
通過實驗激發學習化學的興趣,培養樂于探究的科學態度,體驗透過現象看本質的辯證唯物主義思想。
四、教學過程(見表1)
第一環節:情境引入,順勢激趣
師:這是一瓶Ba(OH)2溶液,“溶液中存在哪些離子呢?”
生:Ba2+、OH-。
師:用哪些物質能檢驗其中的Ba2+?(學生爭相發言)
生:Na2SO4、H2SO4等含有SO42-的可溶性的物質都可以。
師:如果將Ba(OH)2溶液與同學們選擇的這些物質的溶液相混合,溶液中這些看不見、摸不著的離子會悄悄發生變化嗎?今天就讓我們一起來探究其中的奧秘,共同領略“離子反應”的魅力。
(設計意圖:用問題創設情境,激發學生的學習熱情;起點較低,學生能夠迅速地對已有知識進行回憶,便于思維的持續發展;引導學生運用微粒觀,切入本節課的研究新視角。)
第二環節:誘發探究,概念建構
師:首先讓我們來研究Ba(OH)2溶液與Na2SO4溶液的混合情況,Na2SO4溶液中含有哪些離子呢?
生:Na+、SO42-。
師:這兩種溶液混合時,會有什么現象發生呢?從微觀角度分析,這是怎么回事呢?
生:Ba2+和SO42-結合生成了白色沉淀BaSO4。
師:Ba2+和SO42相互作用發生變化,那么原來溶液中的Na+和OH-變化了嗎?請設計實驗方案來探究。(學生之間交流討論,共享學習成果)
生1:向Ba(OH)2溶液中滴入酚酞溶液,再向其中加入Na2SO4溶液,觀察酚酞的顏色變化。
生2:向Ba(OH)2與Na2SO4反應后的溶液中加入CuSO4溶液,觀察是否有藍色沉淀產生。
師:這兩個方案都很有道理,第一位同學的方案更為簡單一些,下面請同學們動手試試第一種設計方案。
探究實驗:向盛有2 mL Ba(OH)2溶液的試管里滴入1滴酚酞溶液,再用膠頭滴管向試管里滴入2 mL Na2SO4溶液,振蕩后靜置。
生:分組實驗,并匯報實驗現象——有白色沉淀產生,酚酞依然為紅色,幾乎無明顯變化。
師:這一現象說明了什么問題?你能從微觀角度分析嗎?
生1:酚酞依然為紅色,說明OH-幾乎沒有變化。由于整個溶液不顯電性,Na+也沒有變。
生2:在這個反應中,Na+和OH-只是旁觀而已。這個反應的實質是Ba2+和SO42相互作用生成了BaSO4沉淀。
師:同學們分析得很好,能不能用離子符號來表示上述離子間的相互作用呢?
生:Ba2++SO42-=BaSO4↓
師:像這樣電解質在溶液中發生的離子之間的反應,我們稱之為離子反應。用實際參加反應的離子符號來表示的式子我們稱之為離子方程式。
(設計意圖:誘發學生進行實驗探究,培養學生的設計實驗方案能力和實驗操作技能,幫助其樹立科學的實驗觀;帶領學生從微觀粒子角度認識物質在水溶液中的存在狀態及行為,分析水溶液中的化學反應,從而建構離子反應的概念,構建“微粒觀”。)
第三環節:引導思維,概念深化
師:下面我們來探究Ba(OH)2溶液與H2SO4溶液混合的情況,請注意觀察實驗中的溶液現象和小燈泡的亮度變化。
(演示實驗:向燒杯中加入一定量0.01 mol/L Ba(OH)2溶液,滴加幾滴酚酞,在滴定管中加入0.2 mol/L H2SO4溶液,開啟電源開關按鈕,向燒杯中逐滴滴加稀H2SO4,攪拌。)
生:(驚奇,驚嘆,爭先恐后匯報實驗現象)
師:請同學們從宏觀和微觀兩個角度分析,為什么會產生這樣的實驗現象?
生1:出現白色沉淀,是因為有白色沉淀BaSO4產生。
生2:小燈泡的明暗變化反映了溶液導電性的變化,也就是溶液中離子濃度發生了變化。首先燈泡由亮→熄滅,說明溶液中幾乎無自由移動的離子;后來燈泡由熄滅→亮,說明溶液中又產生了自由移動的離子,這些現象都說明有離子參加了反應。
生3:溶液中的紅色逐漸褪去,是因為溶液中的OH-逐漸減少。
師:同學們分析得太精彩了,大家能不能嘗試從微觀角度定量地分析溶液中微粒數量的變化,進一步解開實驗現象背后的奧秘呢?大家可以參考化學方程式:Ba(OH)2+H2SO4= BaSO4↓+2H2O
生:(思考片刻,舉手發言)
1 mol Ba(OH)2在溶液中能電離出1 mol Ba2+和2 mol OH-,1 mol H2SO4在溶液中能電離出2 mol H+和1 mol SO42-。當1 mol Ba2+與1mol SO42-結合生成了1 mol難溶的BaSO4時,2 mol OH-與2 molH+結合生成了2 mol難電離的H2O。這樣,溶液中幾乎無自由移動的離子了,燈泡由亮→熄滅,后加入的過量的硫酸又電離出自由移動的H+和SO42-,燈泡由熄滅→亮。
師:同學們成功地分析了這些離子間的相互作用。那么,如何用化學符號表達這個反應的離子方程式呢?
生:(躍躍欲試,難掩興奮)
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
(設計意圖:通過教師演示實驗,學生發現了奇妙的實驗現象,激發了學生的強烈學習興趣;逐步引導學生經歷科學探究的思維過程,幫助其形成“從宏觀到微觀,從定性到定量”的認知過程,深化對“離子反應”概念的理解,強化了“微粒觀”,促進學生科學素養的發展。)
第四環節:解決問題,概念表達
師:接下來請同學們思考以下這些酸堿鹽之間,哪些能兩兩發生反應?如能發生反應,請寫出對應的化學方程式。
稀鹽酸 NaOH溶液
CuSO4溶液 CaCO3粉末
生:NaOH+HCl=NaCl+H2O
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
CaCO3+2HCl=CaCl2+H2O+CO2↑
師:你能從微觀角度分析反應的實質嗎?請嘗試寫出以上方程式對應的離子方程式。
生:OH-+H+=H2O
Cu2++OH-=Cu(OH)2↓
CO32-+2H+=H2O+CO2↑
師:下面請同學們來幫助剛才的幾位同學分析一下,寫得好不好呢?
生1:Na+和Cl-沒有參與反應,實際參加反應的是OH-和H+,這是對的。
生2:Na+和SO42-沒有參與反應,實際參加反應的是Cu2+和OH-。但是,1 mol Cu2+能與2 mol OH-發生反應,所以離子方程式應為Cu2++2OH-=Cu(OH)2↓。
生3:反應過程中,Cl-未發生變化。反應物CaCO3不能在溶液中電離出自由移動的離子,應寫成化學式CaCO3,反應后生成了Ca2+。因此離子方程式應為CaCO3+2H+= Ca2++H2O+CO2↑。
師:請同學們再來觀察一下這幾個反應方程式,想一想這些酸堿鹽在溶液中相互交換成分而發生復分解反應,從微觀角度分析,實際上交換的是什么?
生:(恍然大悟)交換的是離子,原來復分解反應的實質是這樣呀!
師:同學們學會了從微觀角度分析離子反應的實質來書寫離子方程式,這樣的思路和方法很有效。下面你能總結書寫離子方程式的一般步驟嗎?
生1:第一步,寫出化學方程式;第二步,分析判斷溶液中有哪些微觀粒子;第三步,判斷哪些微粒之間能夠相互作用(可以刪除旁觀的、未變化的離子)。
生2:寫完離子方程式,為保證準確無誤還要檢查:原子個數是否守恒(元素守恒);電荷是否守恒;是否遵守客觀事實。
師:在書寫離子方程式時,第二步是關鍵。你能嘗試歸納書寫離子方程式時,哪些物質寫離子形式,哪些物質寫化學式?
生1:離子形式——易溶于水、易電離的物質(如強酸HCl,強堿NaOH,可溶性鹽NaCl、Na2SO4、CaCl2)
生2:化學式——難溶的物質、氣體、水(如CaCO3、Cu(OH)2,H2O,CO2)
師:請同學們根據以上幾個反應方程式,嘗試歸納復分解型離子反應發生的條件。
生:只要有沉淀或氣體或水生成,復分解型離子反應就能發生。
師:你能從離子方程式找到對應的化學反應嗎?比如,哪些物質之間的反應可以用離子方程式Ba2++SO42-= BaSO4↓表示?
生1:BaCl2+Na2SO4=BaSO4↓+2NaCl
生2:BaCl2+H2SO4=BaSO4↓+2HCl
生3:Ba(NO3)2+K2SO4=BaSO4↓+2KNO3
師:這幾個反應的化學方程式不同,但它們的離子方程式相同。這說明離子方程式不僅可以表示某一個具體的化學反應,還可以表示同一類型的離子反應。那么是不是所有含有Ba2+、SO42-的物質之間的反應都可以用這個離子方程式表示呢?
生1:不是,比如Ba(OH)2+CuSO4=BaSO4↓+Cu(OH)2↓
生2:還有Ba(OH)2+H2SO4=BaSO4↓+2H2O
(設計意圖:在離子方程式書寫的演練中,將自評、互評、師評相結合,突出學生的主體地位,使學生更好地熟練離子方程式的書寫技能;引導學生把化學知識和方法運用到解決實際問題中,從離子及其相互作用的角度分析酸堿鹽之間的反應,鞏固“微粒觀”。)
第五環節:鞏固提高,概念應用
師:我們今天學習了離子反應的概念、離子方程式的書寫以及復分解型離子反應的發生條件。認識并掌握了離子反應很有用處,在混合物分離、物質提純和鑒定、清除水中污染物等方面都能大顯身手。下面我們一起來試一試吧!
反饋習題:粗鹽中含有MgCl2、Na2SO4、CaCl2等雜質,工業提純粗鹽的工藝流程如圖2所示。請寫出粗鹽提純過程中發生反應的化學方程式和離子方程式。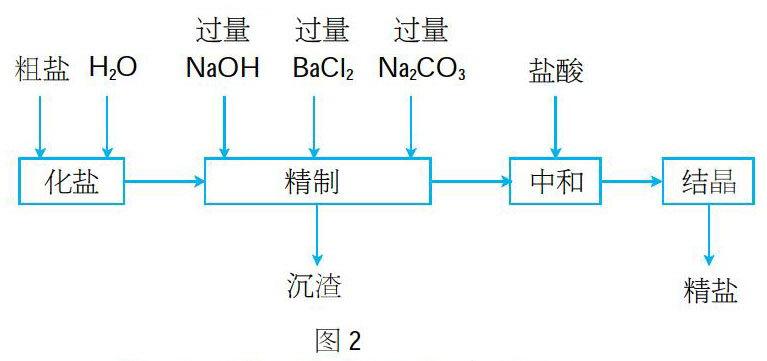
生:MgCl2+2NaOH=Mg(OH)2↓+2NaCl
Mg2++2OH-=Mg(OH)2↓
生:Na2SO4+BaCl2=BaSO4↓+2NaCl
SO42-+Ba2+=BaSO4↓
生:CaCl2+Na2CO3=CaCO3↓+2NaCl
Ca2++CO32-=CaCO3↓
生:BaCl2+Na2CO3=BaCO3↓+2NaCl
Ba2++CO32-=BaCO3↓
生:2HCl+Na2CO3=2NaCl+H2O+CO2↑
2H++CO32-=H2O+CO2↑
生:HCl+NaOH=NaCl+H2O
H++OH-=H2O
(設計意圖:給學生一個真實的應用情境,讓學生體驗到化學的學科價值觀;了解離子反應的應用,進一步學會從微觀角度分析粗鹽提純問題,理解復分解反應的本質。)
五、教學感悟
在帶領學生探索求知的過程中,看到學生收獲了成功的喜悅,作為教師的我更是欣喜萬分。學生的化學學科素養和良好思維品質得到了培養和發展,實現了真正的“化學味”的課堂教學。在本節課的教學中,我有這樣幾點感悟和體會。
1.問題設置是關鍵
問題是教學的內容,是實施有效“誘思導學”教學的核心,是保證教學運作的軸心。“誘發探究,引導思維”需要從創設好的問題開始,不同環境需要設置不同類型的問題。在“情景引入”環節中,問題設置的起點不高,但直奔主題,充分利用學生的最近發展區,便于思維的持續發展,學生的積極性非常高。在“引導思維”環節中,通過海問、點問、追問,循序漸進,步步深入,讓師生的思維相互交融;通過預設問題的層層推進,抽絲剝繭,一步步解開實驗現象背后的奧秘,讓學生體會到收獲成功的喜悅,大大提高了學生學習的自信心,增強了學生持續探究的動力。
2.實驗探究是載體
在“誘思導學”教學模式中,學生是設計、觀察以及實驗等活動的主體,通過親身活動來獲取知識,從多角度理解知識。化學是一門實驗性的科學,化學實驗為學生的實踐活動創造了條件。實驗探究教學活動能增強化學教學的探索性,激發學生學習化學的興趣,培養其創造精神和創造能力。在“誘發探究”環節中,設置開放式的問題情境,能夠調動學生的積極性,誘發學生自主探究及設計實驗方案。在“引導思維”環節中,利用導電性實驗裝置展示Ba(OH)2與H2SO4溶液反應帶來的精彩實驗現象,為學生創設一個可以持續深入思維的探究情境,激發學生的探求欲望,為預設問題的層層推進鋪平道路、創造條件。
3.學科觀念是核心
著名化學教育家宋心琦教授認為:“能夠使學生終身受益的化學教學,不是具體的化學知識,而是影響學生人生觀和價值觀的化學思想觀念。”“微粒觀”是中學化學中的一個重要的核心觀念。本節課中采用基于“微粒觀”的教學方法能夠真正讓學生從微粒的視角認識溶液和溶液中的反應。在“引導思維”環節中,逐步引導學生從微觀角度認識溶液中反應的思路來書寫離子方程式,分析溶液中微粒的來源和數量、溶液中微粒間的相互作用及其結果,從而巧妙地突破書寫離子方程式時“反應過程中離子間的定量關系”這一難點。在“解決問題”環節中,學生熟練運用“微粒觀”來書寫離子方程式,輕松實現理論與實踐間的循環。
參考文獻:
[1]懷特海.教育的目的[M].上海:文匯出版社,2012.
[2]王磊,張毅強,喬敏.觀念建構為本的化學教學設計研究[J].化學教育,2008,29(6).

