同時測定6種柿葉黃酮類物質方法的建立
安淼 余賢美 王潔 劉加芬 艾呈祥

摘 要:為建立一種同時測定6種柿葉黃酮類物質的方法,通過對液相色譜檢測波長、流動相、柱溫等條件的探索,最終確定了蘆丁、山柰素、異鼠李素、槲皮素、異槲皮苷和紫云英苷6種黃酮類物質標準品的液相色譜檢測條件:以十八烷基硅烷鍵合硅膠為填充劑,以甲醇為流動相A,以0.5%乙酸溶液為流動相B,進行梯度洗脫,0~100 min A∶B為20∶80,105 min后為40∶60;檢測波長為360 nm;柱溫為35℃;體積流量1.0 mL/min。并以兩個品種的柿葉為樣品,對所建立的方法進行驗證,得到了預期結果,說明建立的檢測方法是可行的。
關鍵詞:柿葉;黃酮類物質;高效液相色譜;同時檢測
中圖分類號:S665.209.9文獻標識號:A文章編號:1001-4942(2016)05-0131-06
Abstract The HPLC method for simultaneous detection of 6 flavonoids from persimmon leaves was established by exploring the detection conditions such as wavelength, mobile phase and column temperature. The 6 flavonoids were lutin, kaempferol, isorhamnetin, quercetin, isoquercitrin and astragalin. The results showed that the 6 flavonoid standards could be detected simultaneously under the following conditions: using C18 as stuffing bulking agent, carbinol as mobile phase A and 0.5% acetic acid as mobile phase B; the samples were gradiently eluted at the ratios of phase A∶B as 20∶80 in 0~100 minutes and 40∶60 after 105 minutes; and the detection was carried out with 360 nm of wavelength, 35℃ of column temperature and 1.0 mL/min of volume flow rate. The detection method was verified with the leaves of two persimmon varieties, and the expected results were obtained, which indicated that the established method was feasible.
Key words Persimmon leaves; Flavonoid; HPLC; Simultaneous detection
柿葉中含有豐富的黃酮苷、蘆丁、三萜類、酚類、膽堿、維生素C、胡蘿卜素、香豆素、植物甾醇類、有機酸、脂肪酸、揮發油、生物堿、還原糖、多糖、鞣質、香脂精、多種氨基酸及鐵、鋅、鈣等對人體健康有益的營養成分[1]。近幾年,隨著人們越來越注重健康的生活,柿葉的功能成分逐漸受到重視。
黃酮類物質是柿葉中最主要的功能成分,已發現的柿葉黃酮類物質主要有紫云英苷、黃芪苷、槲皮素、異槲皮苷、山柰酚、蘆丁、蕓香苷、金絲桃苷、楊梅樹皮苷等[2]。對柿葉黃酮的開發研究,可提高柿樹的利用效率,增加其經濟效益。
目前,對于柿葉黃酮的研究主要是總黃酮或少量幾種黃酮類物質的提取[3~5]、檢測方法及含量分析[6,7],以及不同品種間總黃酮含量的比較[8]。關于同時檢測柿葉中6種黃酮類物質的方法迄今未見報道。筆者以西村早生和禪寺丸兩個品種的柿葉為材料,通過對液相色譜條件的摸索,建立了一種同時檢測6種柿葉黃酮類物質的液相色譜檢測方法,為適宜柿葉茶等深加工的高黃酮柿樹品種的選育做前期探索。
1 材料與方法
1.1 材料
1.1.1 儀器 索氏提取器;Agilent LC1260 高效液相色譜儀;DAD紫外二極管陣列檢測器;ZORBAX Eclipse XDB-C18 4.6 mm×250 mm,5 μm色譜柱。
1.1.2 試劑 蘆丁標準品、山柰素標準品、異鼠李素標準品、槲皮素標準品、異槲皮苷標準品、紫云英苷標準品,購自Sigma;色譜級甲醇,購自天津市科密歐化學試劑有限公司;色譜級冰乙酸,購自天津市凱通化學試劑有限公司;水為超純水。
1.1.3 柿葉樣品 西村早生和禪寺丸兩個品種的柿葉樣品取自山東省果樹研究所萬吉山柿樹試驗示范基地。
1.2 方法
1.2.1 高效液相色譜檢測條件的選擇 檢測波長的確定:對6種標準品分別進行紫外全波長掃描,根據吸收光譜圖中的吸收峰確定檢測波長。
流動相的選擇:以乙腈-0.5%乙酸、甲醇-0.5%乙酸為流動相,根據分離效果選擇適宜流動相。
流動相比例的選擇:比較甲醇-0.5%乙酸比例分別為10∶90、20∶80、30∶70、40∶60、50∶50、60∶40的流動相,根據分離效果確定最佳流動相比例。
柱溫的選擇:比較25、30、35、40℃幾種柱溫條件下的分離效果,確定最適柱溫。
體積流量的選擇:比較0.4、0.8、1.0 mL/min不同體積流量,根據峰型及分離效果確定最佳體積流量。
1.2.2 校正表的建立 精密稱量蘆丁標準品5.1 mg,異槲皮苷標準品5.1 mg,紫云英苷標準品5.2 mg,槲皮素標準品5.1 mg,山柰素標準品4.9 mg,分別置于10 mL棕色容量瓶中,用甲醇溶解后定容并搖勻。精密稱量異鼠李素標準品5.2 mg,置于50 mL棕色容量瓶中,用甲醇溶解后定容并搖勻。取蘆丁、異槲皮苷、紫云英苷、槲皮素、山柰素標準品母液各4 mL,取異鼠李素標準品母液20 mL,混合置于50 mL容量瓶中,加甲醇至刻度,搖勻,得混合標準品貯備液。分別取混合標準品貯備液1、2、4、6、8、10 mL,置于10 mL容量瓶中,加甲醇至刻度,搖勻,得不同濃度混合標準品溶液。精密吸取不同濃度混合標準品溶液各20 μL,注入液相色譜儀進行檢測,計算校正表。
1.2.3 液相色譜檢測方法的驗證 樣品溶液的制備:將新鮮葉片洗凈,105℃殺青15 min后于70℃烘干。干燥葉片經0.5 mm孔篩粉碎,得樣品粉末。稱取樣品粉末約1 g,置于索氏提取器中,使用四氯甲烷回流除雜后用甲醇回流提取至無色。將提取液轉移至100 mL容量瓶中,用少量甲醇洗滌容器,洗液并入同一容量瓶中,加甲醇至刻度,搖勻。使用0.22 μm微孔有機濾膜過濾,得供試樣品溶液。
樣品中6種黃酮類物質含量的測定:精密吸取供試品溶液20 μL,注入液相色譜儀,按照建立的液相色譜條件對樣品進行檢測。根據色譜圖,經校正表計算,得到樣品中各黃酮類物質的含量。
2 結果與分析
2.1 液相檢測條件的建立
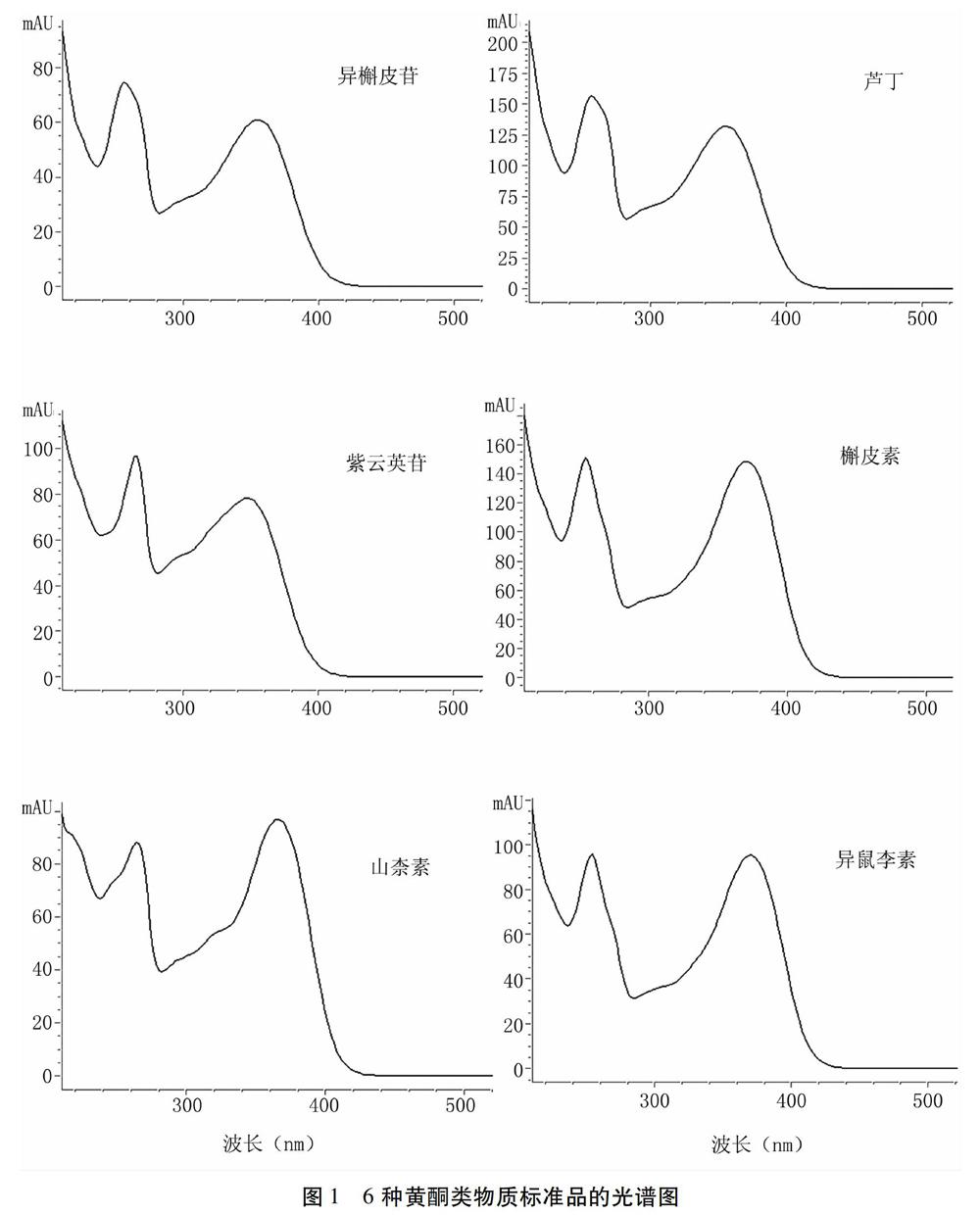
2.1.1 檢測波長的確定 對6種黃酮類物質標準品進行紫外全波長掃描,結果顯示,各標準品在257 nm和360 nm處均有較高的吸收峰(圖1)。但是257 nm處受到溶劑吸收峰等干擾,故選擇360 nm作為檢測波長。
2.1.2 流動相的確定 對乙腈-0.5%乙酸、甲醇-0.5%乙酸兩種流動相體系的分離效果進行比較,結果顯示,使用乙腈-0.5%乙酸做流動相,分離度差,且進樣時溶劑峰較明顯;使用甲醇-0.5%乙酸做流動相,分離效果較好,且樣品的溶解和提取均使用甲醇,因此,選用甲醇-0.5%乙酸為流動相以減少溶劑峰的影響。
2.1.3 流動相比例的確定 當甲醇濃度為30∶70或以上時,混合標準品中異槲皮苷與蘆丁難以分開。當甲醇濃度為20∶80或以下時,難以出峰。故選擇梯度洗脫,使用低甲醇比例流動相使樣品分離,再用較高甲醇比例流動相使樣品出峰。
以甲醇-0.5%乙酸為流動相,比較了幾種比例流動相的梯度效果,結果顯示,先使用20∶80流動相,后改為40∶60可以達到分離樣品與出峰峰型較好的平衡。
2.1.4 柱溫的確定 比較了25、30、35、40℃幾種柱溫條件下的分離效果,高柱溫時保留時間短,低柱溫條件下保留時間延長,但由于峰型變寬,分離度反而降低。綜合考慮,選擇35℃作為柱溫條件。
2.1.5 體積流量的確定 經比較,體積流量為1.0 mL/min時,峰型及分離效果均較好,因此,確定1.0 mL/min為高效液相色譜檢測的最佳體積流量。
2.1.6 液相檢測條件的確定 綜合上述結果,確定高效液相色譜檢測條件為:以十八烷基硅烷鍵合硅膠為填充劑,以甲醇為流動相A,以0.5%乙酸溶液為流動相B,按表1的條件進行梯度洗脫;檢測波長為360 nm;柱溫為35℃;體積流量為1.0 mL/min;進樣量為20 μL。
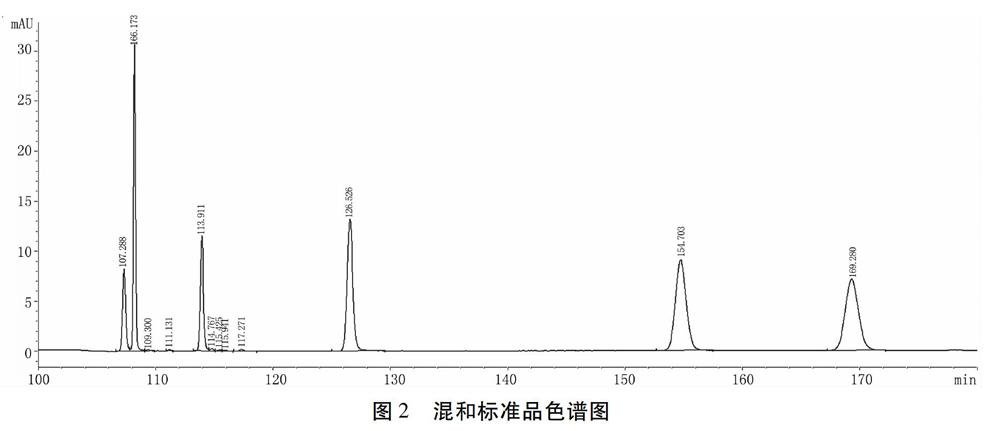
2.1.7 混合標準品色譜圖 以上述建立的條件對6種黃酮類物質混合標準品進行檢測,得到混合標準品色譜圖(圖2),6種標準品得到了很好的分離,保留時間由短至長分別為異槲皮苷、蘆丁、紫云英苷、槲皮素、山柰素、異鼠李素。
2.2 校正表的建立
將6種黃酮類物質標準品混合,取不同濃度混合標準品溶液(表2)注入液相色譜儀,在360 nm處檢測其吸光度,以濃度為橫坐標、峰面積為縱坐標做標準曲線,得到6種黃酮類物質的回歸方程(圖3)。
2.3 樣品中6種黃酮類物質含量測定
用上述建立的方法,測定了西村早生及禪寺丸兩個品種柿葉的6種黃酮類物質,根據色譜圖(圖4),按照標準曲線進行計算,得出西村早生中各黃酮類物質含量(mg/g干燥葉):異槲皮苷2.31;蘆丁0.13;紫云英苷6.8;槲皮素0.51;山柰素0.52。禪寺丸中各黃酮類物質含量(mg/g干燥葉):異槲皮苷1.35;蘆丁2.04;紫云英苷4.39;槲皮素1.64;山柰素2.04;異鼠李素0.075。
3 結論與討論
黃酮類物質是一類重要的生理活性物質,具有抗氧化、抗炎、抗過敏、抗衰老、抗癌等功能[9~14]。在中藥中測定黃酮含量已趨于成熟,《中華人民共和國藥典》(簡稱《中國藥典》)(一部)中詳細記載了天南星、沙棘、槐花等幾種中草藥總黃酮含量及單種黃酮類物質含量的測定方法,以及山楂葉總黃酮含量的測定和銀杏葉總黃酮醇苷含量的測定方法[15],其他果樹黃酮含量的測定并沒有記載。用于柿葉黃酮類物質的檢測方法主要有分光光度法[16,17]、高效液相色譜法[6,7,18,19]和薄層色譜法[20,21]。本試驗采用高效液相色譜法,借鑒《中國藥典》中關于其他中草藥黃酮類物質的測定方法,建立了一種同時測定6種黃酮類物質的方法。
試驗過程中發現,在制備標準品母液時,由于異鼠李素在甲醇中的溶解度較低,無法達到其他標準品母液的濃度,因此,使用較大量甲醇將其溶解,得到較低濃度的母液,在配制混合標準品貯備液時,按比例吸取各標準品母液,使各標準品濃度相近,便于計算。
試驗中還發現,山柰素(3,5,7-三羥基-4-甲氧基黃酮)和山柰酚(3,5,7,4-四羥基黃酮)標準品在所建立的HPLC條件下,吸收峰重疊無法分開,有可能與二者結構極其相似有關。因此,本試驗以山柰素為標準品分析其含量。
選擇檢測波長時,紫外全波長掃描結果顯示,各標準品在257 nm和360 nm處均有較高的吸收峰。但在試驗中發現257 nm處受到溶劑峰干擾,而在360 nm處各標準品可得到較好的圖譜,所用溶劑截止波長均在257 nm以下[22],因此,選擇360 nm為檢測波長。
選擇流動相時,比較了乙腈-0.5%乙酸、甲醇-0.5%乙酸兩種流動相體系的分離效果,發現使用乙腈-0.5%乙酸做流動相,分離度差,且溶劑峰較明顯。另外,標準品溶液的制備和樣品的提取均使用了甲醇,因此,選用甲醇-0.5%乙酸為流動相以減少溶劑峰的影響。對于流動相比例,選擇梯度洗脫,先使用20∶80,后改為40∶60可以取得較好的效果。在上述條件下,體積流量超過1.0 mL/min時,壓力過大,為防止對設備的損害,不考慮更大體積流量。
本試驗建立的梯度洗脫方法,可以達到分離樣品與出峰峰型較好的平衡,但總體時間較長。對于如何在保證樣品分離度與出峰峰型的前提下,進一步縮短總體保留時間,提高試驗效率,有待于進一步研究。
為驗證所建立方法的可行性,筆者以西村早生和禪寺丸兩個品種的柿葉為樣品,測定了6種黃酮類物質的含量。2個品種柿葉中均檢測到蘆丁、異槲皮苷、紫云英苷、槲皮素、山柰素,而異鼠李素僅在禪寺丸中有微量發現(0.075 mg/g干燥葉)。是否完全沒有或者含量低于可測定限值,以及哪些品種柿葉中可能含有異鼠李素,有待于進一步研究。
參 考 文 獻:
[1]
林嬌芬, 林河通, 謝聯輝, 等. 柿葉的化學成分、藥理作用、臨床應用及開發利用[J]. 食品與發酵工藝, 2005, 31(7): 90-96.
[2] 郭玫, 董曉萍, 徐文萍. 柿葉的研究概況[J]. 甘肅中醫學院學報, 2000 (增刊): 78-82.
[3] 衛靜莉, 薛笑莉, 陳玉章. 提取柿葉黃酮類化合物工藝研究[J].食品研究與開發, 2013,34(13):29-32.
[4] 宋常春, 鮑慶勝. 柿葉黃酮類化合物提取方法和抗氧化性的研究[J]. 食品與發酵工業,2004, 30(9): 117-119.
[5] 張秀梅, 曾祖平, 王永紅. 柿葉總黃酮提取工藝的研究[J]. 時珍國醫國藥,2008, 19(1): 35-36.
[6] 羅旭艷, 王麗惠, 王乃平, 等. 柿葉總黃酮中槲皮素的含量測定[J]. 廣西醫科大學學報, 2011, 28(1): 26-27.
[7] 覃冬杰, 梁永紅, 黃瑞松, 等. 壯藥柿葉槲皮素和山柰素含量測定方法的建立[J]. 廣西醫學, 2012, 34(9): 1133-1136.
[8] 孫化鵬. 湖南省柿資源優選及柿葉黃酮類化合物分離鑒定研究[D]. 長沙: 湖南農業大學, 2010.
[9] 羅志剛, 趙喜紅, 何小維. 柿葉中黃酮類物質提取的影響因素及抗氧化性研究[J]. 廣東農業科學, 2006(12): 67-70.
[10]Sun L J, Zhang J B, Lu X Y, et al. Evaluation to the antioxidant activity of total flavonoids extract from persimmon (Diospyros kaki L.) leaves [J]. Food and Chemical Toxicology, 2011, 49:2689-2696.
[11]王宇翎, 張艷, 方明, 等. 白花蛇舌草總黃酮的抗炎及抗菌作用[J]. 中國藥理學通報, 2005, 21(3): 348-350.
[12]黃麗, 韋保耀, 滕建文. 紫蘇葉抗過敏有效成分的研究[J]. 食品科技, 2005(5): 90-93.
[13]Chen L, Ma X B, Liang Y H, et al. Effects of persimmon leaf total
flavonoid on enzyme of lipoprotein metabolism and antioxidation in hyperlipidemia rats [J].Chinese Journal of Natural Medicines,2011(1): 74-77.
[14]張芳芳, 沈漢明, 朱心強. 木犀草素抗腫瘤作用的研究進展[J]. 浙江大學學報:醫學版, 2006, 35(5): 573-578.
[15]國家藥典委員會. 中華人民共和國藥典[M]. 北京:中國醫藥科技出版社, 2010.
[16]梅為云, 曹冠華, 賀森, 等. 采收期對甜柿柿葉茶品質的影響[J].食品科技, 2015, 40(3):57-60.
[17]孫彩云, 柳鳳娟. 磨盤柿葉總黃酮的提取研究[J].化學工程師, 2014(2):67-70.
[18]原江鋒, 楊建雄, 張志琪. 反相高效液相色譜法測定不同采收期柿葉蘆丁、齊墩果酸的含量[J]. 天然產物研究與開發, 2006,18(6): 1023-1026.
[19]貝偉劍, 羅杰, 吳愛鑾, 等. HPLC法測定柿葉浸膏中槲皮素和山柰酚[J]. 中草藥, 2005, 36(7): 1014-1015.
[20]段保宏. 柿葉的鑒別及其總黃酮的提取工藝考察[J]. 世界中西醫結合雜志, 2010, 5(6): 500-501.
[21]許本善, 趙瑞萍, 雷寧,等.柿葉的定性與定量研究[J].西北藥學雜志, 2015,30(5):566-569.
[22]方惠群, 于俊生, 史堅. 儀器分析[M].北京:科學出版社, 2002:279.

