低氮低熱量腸外營養在肝葉切除患者術后的應用
陳劍 鐘耀星 余蓮花 鄒道發 孫秋冬
低氮低熱量腸外營養在肝葉切除患者術后的應用
陳劍 鐘耀星 余蓮花 鄒道發 孫秋冬
目的 探討低氮低熱量腸外營養對肝葉切除術后患者的影響。方法 將預實施肝葉切除患者60例,隨機分為試驗組和對照組,各30例,術后分別應用低氮低熱量腸外營養和傳統腸外營養支持。比較2組患者血漿白蛋白(ALB)、前白蛋白(Pre-ALB)、谷草轉氨酶(AST)、谷丙轉氨酶(ALT)、術后住院天數及住院費用的變化。結果 (1)手術前后ALB對照組:術前(37.6±3.7),術后3 d(34.2±3.4);試驗組:術前(35.7±4.2),術后3 d(35.1±2.8);手術前后Pre-ALB對照組:術前(0.25±0.04),術后3 d(0.23±0.01);試驗組:術前(0.26±0.08),術后3 d(0.27±0.03);術后試驗組
ALB、Pre-ALB均高于對照組,2組蛋白總體水平較術前均有下降(P<0.05);(2)手術前后AST對照組:術前(125.0±13.5),術后3 d(150±24);試驗組:術前(121±15),術后3 d(120±18);手術前后ALT對照組:術前(99.0±15.5),術后3 d(70.0±8.8);試驗組:術前(105±12),術后3 d(60.0±10.5)。術后
2組患者AST、ALT均較術前升高(P<0.05),試驗組轉氨酶水平低于對照組,但差異無統計學意義;(3)2組住院天數:對照組(15±4)d,試驗組(13±2)d;2組住院費用:對照組(19 306.0±526.6)元,試驗組(18 047.0±415.3)元。試驗組術后住院天數和住院費用明顯低于對照組(P<0.05)。結論 實施肝葉切除患者術后低氮低熱量腸外營養支持有利于改善營養狀態,減少術后住院天數和住院費用。
低氮;低熱量;腸外營養;肝葉切除
手術創傷可引起機體免疫功能失調、激活潛在的促炎介質,引起局部炎性細胞因子的生成釋放,可能繼發全身炎癥反應[1],其結局是延長住院時間,增加患者住院費用。臨床研究表明手術后給予合理的營養支持,有助于減少術后應激反應,縮短住院時間,促進康復。國內多個隨機對照研究[2-3]結果提示低氮低熱量腸外營養較傳統腸外營養更有利于患者術后恢復,所以臨床營養支持已成為多種外科疾病的治療手段。但這些研究大多以胃腸腫瘤手術患者為研究對象,而針對肝葉切除術后患者資料甚少。本研究擬探討不同氮量、熱量腸外營養對肝葉切除術后患者營養狀況、肝功能及術后住院天數及住院費用的影響。
1 資料與方法
1.1 一般資料 收集本院2014年10月~2015年10月實施肝葉切除患者60例,將符合納入標準患者隨機分成試驗組和對照組,各30例,其中應用低氮低熱量腸外營養支持者作為試驗組,接受傳統腸外營養支持者作為對照組。納入標準:(1)年齡30~60歲;(2)營養風險篩查(NRS2002)≥3,病情比較平穩;(3)凡實施肝葉切除手術患者,包括肝癌、肝血管瘤、肝囊腫、肝內膽管結石、肝破裂患者;(4)手術方式包括:肝左外葉、肝右后葉、肝左葉、肝右葉切除等。排除標準:(1)嚴重肝腎功能異常;(2)心功能Ⅳ級;(3)重癥感染;(4)有嚴重干擾能量代謝的疾病或治療。2組患者手術均由同一手術組完成,并應用統一手術方法及器械,除營養補充方式外其它治療措施同本院實施該手術傳統治療模式。2組患者一般資料比較差異無統計學意義,具有可比性。見表1。
1.2 方法 將參與試驗行肝葉切除患者,于術后第1天開始應用低氮低熱量腸外營養補充能量,對照組采用傳統腸外營養方式,連續3 d;分別于術后第1~3天抽取晨空腹血檢測血漿ALB、Pre-ALB、AST、ALT,并于出院時計算術后住院天數、總住院費用。
1.3 營養支持方法 本研究所有參與試驗者,術后第1天起連續3 d補充腸外營養。根據人體應激狀態下營養消耗標準補充氮量、熱量,試驗組采用卡文(1 440 mL,華瑞公司),補充標準:非蛋白質熱量為85~105 kJ/(kg?d),氮為0.10~0.15 g/ (kg?d),氮熱比為1 g∶410~500 kJ,糖脂比為1∶1~1.2。對照組患者采用單瓶輸注葡萄糖、氨基酸和脂肪乳劑,非蛋白質熱量為125 kJ/(kg?d),氮為0.20 g/(kg?d),氮熱比為1 g:620 kJ,糖脂比為1∶1.2~1.5。試驗組和對照組均通過中心靜脈均勻輸入,同時補充電解質、微量元素及維生素。
1.4 觀察指標 在研究開始前及研究結束時,采集所有病例的晨空腹血標本。檢測血漿ALB、Pre-ALB、ALT、AST,同時統計患者術后住院天數,住院費用。
1.5 統計學方法 采用SPSS 12.5統計分析軟件分析本研究全部數據,計量資料采用“x±s”表示,組間比較采用t檢驗,計數資料組間比較采用χ2檢驗;P<0.05為差異有統計學意義。
2 結果
2.1 術前、術后白蛋白變化 術前2組血漿ALB、Pre-ALB的差異無統計學意義,研究結束時2組血漿ALB、Pre-ALB濃度均低于術前,試驗組ALB、Pre-ALB水平均高于對照組,2組間比較差異有統計學意義(P<0.05)。見表2。
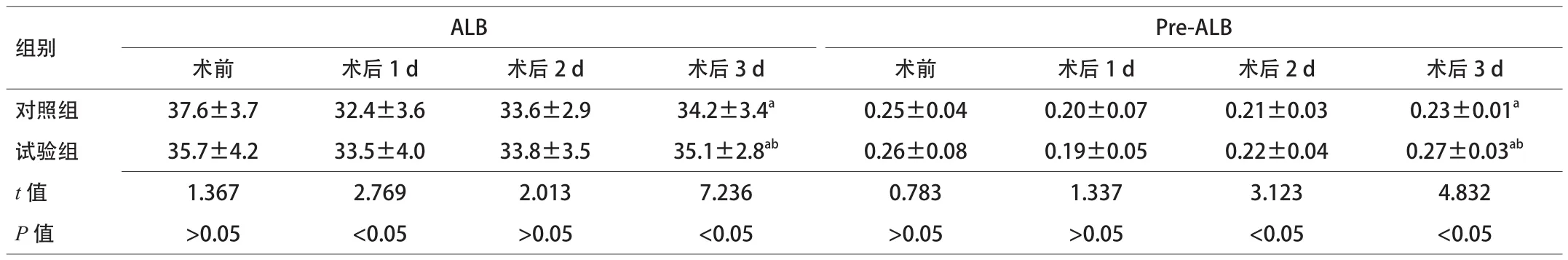
表2 2組術前后血漿蛋白變化比較(x±s,n=30)
2.2 術前后肝功能變化 術前2組AST、ALT的差異無統計學意義,研究結束時2組AST、ALT水平均高于于術前,試驗組低于對照組,2組之間比較差異無統計學意義。見表3。
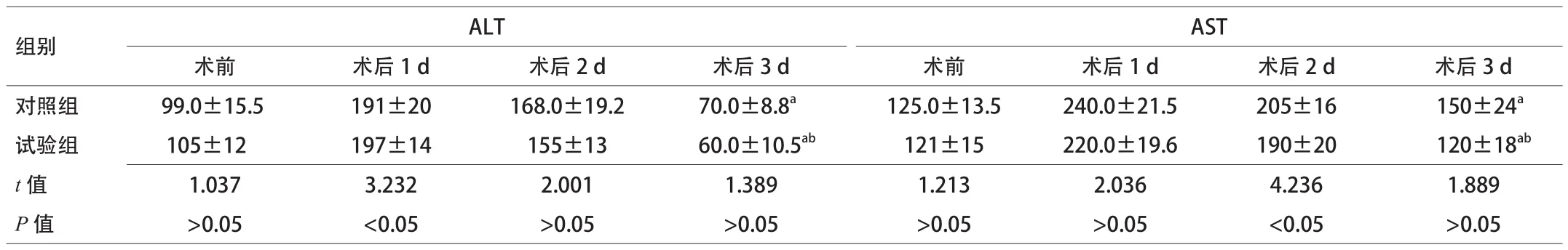
表3 2組術前后肝功能變化情況比較(x±s,n=30)
2.3 術后組間住院費用、術后住院天數變化 研究結束時2組住院費用、術后住院天數對比顯示,試驗組住院費用、術后住院天數明顯低于對照組,2組之間比較差異有統計學意義(P<0.05)。見表4。

表4 2組住院費用及住院天數比較(x±s,n=30)
3 討論
目前傳統腸外營養傾向于進行高熱量高氮量的營養補充,張莉研究認為[4]:對于重癥患者早期給予高氮、高熱量腸外營養法具有顯著的臨床效果,安全可靠。但近幾年來有研究表明[5],嚴重創傷應激、大手術后等高代謝患者,較高能量與營養底物的供給對患者造成不利的臨床結局,同時給予高熱量高氮營養,不利于糾正術后蛋白質的分解代謝[6],而且提供過多的氮量對累積氮平衡也無益處,仍會出現負氮平衡,這只會加重患者的應激程度[7]。低氮低熱量腸外營養支持,亦可使血糖保持在較低的水平,有利于減少二氧化碳的產生,從而減少心肺不良事件的發生[8],亦可有效對患者組織器官的結構、功能產生維持性作用,降低術后感染的發生率,進而縮短住院時間,減少患者的醫療費用[9]。總之,低氮低熱量腸外營養支持是一種安全有效的營養治療方法,有利于腹部手術后患者的康復[10]。
肝臟本身是主要物質代謝場所,實施肝葉切除手術操作相對復雜、耗時,又是麻醉、手術創傷、大量失血、低氧等各種因素首當其沖損害的臟器。由于手術減少肝組織,增加殘存正常肝組織代謝負擔,如不合理的能量補充,有可能進一步加重肝臟負擔,誘發或加速肝衰;再者,經歷大手術后機體處于中重度應激狀態,代謝率升高,分解代謝增強,總體呈現負氮平衡,適當的營養支持不但能滿足機體的代謝需求,而且有利于術后患者營養狀況的改善,因此及時合理的營養支持是肝葉切除等重大手術患者術后治療重要組成部分。術后及時給予營養支持以維持機體功能與代謝,提高機體免疫力,以利于患者的康復,當然腸外營養支持并非百益無害之事,長時間腸外營養治療有腸粘膜萎縮,通透性增強和淤膽等缺點,可造成細菌和內毒素的易位,引發敗血癥,最終可導致多器官衰竭[11]。早期進行低氮低熱量腸外營養支持,選擇合適時機綜合使用營養支持療法效果比單一使用傳統胃腸外營養方法效果好[12]。
本研究結果示,實施肝葉切除患者合并不同程度肝功能損害。術后血漿蛋白水平降低和轉氨酶水平升高,考慮與手術創傷、麻醉、術后禁食等因素有關。經合理營養支持,術后腸外營養支持后2組患者血漿ALB、Pre-ALB有所上升,雖未達術前水平,但有升高趨勢,提示肝葉切除術后早期營養支持有助于改善患者營養狀況;而2組患者轉氨酶則均有明顯下降趨勢,提示經手術切除病損肝組織并合理營養支持,有利于肝功能快速恢復;值得注意的是,試驗組術后住院天數、住院費用較對照組明顯下降(P<0.05)。由于營養費用低,術后住院天數減少,故住院費用亦同樣減少(P<0.05)。
綜上所述,肝葉切除術后給予低氮低熱量腸外營養支持有利于改善患者營養狀態,減少術后住院天數及住院費用。在本研究現有的樣本量下,不足以全面完整反映肝葉切除術后應用低氮低熱量腸外營養支持的優缺點,但僅從本研究情況來看,近期實驗結果令人鼓舞,遠期效果及對術后并發癥、血糖、免疫功能等的影響,不得而知,均需長周期、大樣本、甚至多中心等研究證實。
[1] Badia JM,Whanell SA,Scott-coombes DM,et al.Peritoneal and systemic cytokine response to laparotomy[J].Br J Surg,1996,83(3):347-348.
[2] 詹文華,蔣朱明,唐云,等.低氮低熱量腸外營養對胃手術后患者結局的影響:120例隨機對照多中心臨床研究[J].中華醫學雜志,2007, 87(25):1729-1733.
[3] 蔣朱明,王秀榮,韋軍民,等.低氮低熱量腸外營養與傳統氮熱量腸外營養對術后患者血糖、感染相關并發癥、住院時間、費用等影響的比較(100例隨機、對照、多中心臨床研究)[J].中國臨床營養雜志, 2003,11(3):179-183.
[4] 張莉.重癥病人急性期不同腸外營養策略的護理要點分析[J].中外醫療,2015(27):144-146.
[5] Mccowen KC,Friel C,Sternberg J,et al.Hypocaloric total parenteral nutrition:effectiveness in prevention of hyperglycemia and in fectious complications, a randomized clinical trial[J].Crit Care Med,2000,28(11):3606-3611.
[6] Nordenstrom J.Free fatty acid mobilization and oxidation during parenteral nutrition[J].Ann Surg,1983,198:725-730.
[7] 蔡斌,江華,王秀榮,等.低熱卡及低氮腸外營養對術后患者影響的隨機對照研究的系統評價[J].中國臨床營養雜志,2003,11(1):19-23.
[8] 翟春波,李偉,胡德宏.低氮低熱量腸外營養對食管癌術后營養狀態、血糖和并發癥的影響[J].中國醫學創新,2014,17(299):11-14.
[9] 李中國,吳瑤強.低氮低熱量腸外營養對腹腔鏡大腸癌術后患者短期療效的影響探討[J].中國醫藥指南,2016,2(16):107-108.
[10] 康凱,舒曉亮,姬舒榮,等.低氮低熱量腸外營養對腹部手術病人療效及預后影響的Meta分析[J].腸外與腸內營養,2013,20(6):332-337.
[11] 謝毅堅,黃利鵬,洪云峰.腸內、外營養對胃腸道腫瘤術后患者恢復的療效觀察[J].當代醫學,2012,18(12):119-120.
[12] 李季冬.低氮低熱量腸外營養聯合腸內營養在老年胃癌術后的應用分析[J].現代診斷與治療,2014,25(11):2517-2518.
Objective To observe the effects of hypocaloric andhyponitrogenic parenteral nutrition on patients after hepatolobectomy. Methods Six typatients after hepatolobectomy were randomly divided into control group (n=30) and study group (n=30), treated with hypocaloric and hyponitrogenic parenteral nutrition, and traditional parenteral nutrition respectively.serumalbumin (ALB), prealbumin (Pre-ALB), glutamic oxaloacetic transaminase (AST), glutamic pyruvic transaminase (ALT), postoperative hospital stay, total hospitalization expenditure were analyzed. Results (1)Perioperative period ALB the control group: preoperative (37.6±3.7), postoperative 3d (34.2±3.4); the experimental group: preoperative (35.7±4.2), postoperative 3d (35.1±2.8); perioperative period Pre-ALB the control group: preoperative (0.25±0.04), postoperative3d (0.23±0.01); the experimental group: preoperative (0.26±0.08), postoperative 3d (0.27±0.03); The experimental group ALB, Pre-ALB were higher than the control group after treatment, the overall level of serum proteins were decreased compared with preoperative (P<0.05); (2)Perioperative period AST the control group: preoperative (125.0±13.5), postoperative 3d (150±24); the experimental group: preoperative (121±15), postoperative 3d (120±18); perioperative period ALT the control group: preoperative (99.0±15.5), postoperative 3d (70.0±8.8); the experimental group: preoperative (105±12), postoperative 3d (60.0±10.5). Postoperative AST, ALT were increased compared with preoperative (P<0.05), the experimental group transaminase levels lower than the control group, but the difference was not statistically significant; (3)Postoperative hospital stay: the control group (15±4)d, the experimental group (13±2)d; total hospitalization expenditure: the control group (19 306.0±526.6), the experimental group (18 047.0±415.3). postoperative hospital stay, total hospitalization expenditure were signif i cantly lower than the control group (P<0.05). Conclusion The application of hypocaloric and hyponitrogenic parenteral nutritionon patients after hepatolobectomy will help to improve the nutritional status, reduce postoperative hospital stay and total hospitalization expenditure.
Hypocaloric; Hyponitrogenic; Parenteral nutrition; Hepatolobectomy
10.3969/j.issn.1009-4393.2016.32.002
九江市科技支撐計劃項目(20150102)
江西 332400 修水縣第一人民醫院肝膽外科(陳劍 鐘耀星 余蓮花 鄒道發 孫秋冬)

